Perossido di magnesio
| Perossido di magnesio | |
|---|---|
 | |
| Nome IUPAC | |
| perossido di magnesio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | MgO2 |
| Peso formula (u) | 56.3038 |
| Aspetto | polvere incolore |
| Numero CAS | |
| Numero EINECS | 238-438-1 |
| PubChem | 61745 |
| DrugBank | DBDB13486 |
| SMILES | [O-][O-].[Mg+2] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 3 |
| Solubilità in acqua | insolubile |
| Temperatura di fusione | 223 °C |
| Temperatura di ebollizione | 350 °C (decomposizione) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 272 - 314 |
| Consigli P | 220 - 280 - 305+351+338 [1] |
Il perossido di magnesio (MgO2) è un composto chimico che si presenta come una polvere fine inodore di colore che va dal bianco al biancastro. È simile al perossido di calcio perché il perossido di magnesio rilascia anche ossigeno scomponendosi a una velocità controllata con l'acqua. In commercio, il perossido di magnesio esiste spesso come composto di perossido di magnesio e idrossido di magnesio. A contatto con l'acqua si decompone secondo le seguenti reazioni successive:
Struttura
[modifica | modifica wikitesto]È stato determinato che la struttura del perossido di magnesio è di forma triangolare con la molecola di ossigeno (O2) che si lega lateralmente al magnesio. Questa disposizione è il risultato della donazione di una carica da parte del magnesio, che diventa Mg+, all'ossigeno e della creazione di:
- .
Il legame tra O2 e l'atomo di magnesio ha un'energia di dissociazione approssimativamente di [2]
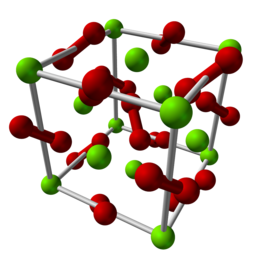
Allo stato solido, il perossido di magnesio ha una struttura cristallina cubica di tipo pirite e la previsione evolutiva della struttura cristallina è una transizione di fase a una struttura tetragonale quando viene esercitata una pressione di 53 GPa. In condizioni normali il perossido di magnesio è un composto metastabile (meno stabile di ); a pressioni superiori ai 116 GPa si prevede che diventi termodinamicamente stabile nella fase tetragonale. Questa previsione teorica è stata confermata sperimentalmente tramite sintesi in una cella a incudine di diamante riscaldata al laser.[3]
Sintesi
[modifica | modifica wikitesto]il perossido di magnesio può essere prodotto mescolando ossido di magnesio (MgO) con perossido di idrogeno (H2O2) per creare perossido di magnesio e acqua. Trattandosi di una reazione esotermica dovrebbe essere raffreddata e mantenuta intorno ai 30-40 gradi Celsius. È anche importante rimuovere quanto più ferro possibile dall'ambiente di reazione a causa della capacità del ferro di catalizzare la degradazione del perossido. L'aggiunta di stabilizzanti dell'ossigeno come il silicato di sodio (Na2SiO3) possono essere utilizzati anche per aiutare a prevenire la degradazione prematura del perossido. Indipendentemente da ciò, una buona resa di questa reazione è solo del 35% circa:[4]
Rese più elevate sono ulteriormente complicate dal fatto che il perossido di magnesio reagisce con l'acqua per degradare il perossido in idrossido di magnesio (Mg(OH)2), noto anche come latte di magnesia.
Applicazioni
[modifica | modifica wikitesto]Il perossido di magnesio è un composto stabile che rilascia ossigeno, utilizzato nelle industrie agricole e ambientali. Viene usato per ridurre i livelli di contaminanti nelle acque sotterranee e nel biorisanamento del suolo contaminato, migliorando la qualità del suolo per la crescita e il metabolismo delle piante. Viene anche utilizzato nel settore dell'acquacoltura per il biorisanamento.
Per scopi igienico-sanitari, il perossido di magnesio viene spesso utilizzato come fonte di ossigeno per gli organismi aerobici nel trattamento e nello smaltimento dei rifiuti biologici. Poiché la scomposizione degli idrocarburi nel suolo è solitamente più rapida in condizioni aerobiche, il perossido di magnesio può essere aggiunto anche ai cumuli di compost o nel suolo per accelerare le attività microbiche e ridurre gli odori prodotti nel processo.[5]
In alcune circostanze è stato anche dimostrato che il perossido di magnesio inibisce la crescita dei batteri. In particolare, la crescita di batteri solforiduttori può essere inibita in un ambiente contenente perossido di magnesio. Mentre l'ossigeno si dissocia lentamente, si teorizza che possa agire per spostare il solfato, che normalmente agisce come accettore terminale di elettroni terminale nella catena di trasporto degli elettroni.[6]
Tossicità
[modifica | modifica wikitesto]Il perossido di magnesio è un irritante che può causare arrossamento, prurito, gonfiore e può bruciare la pelle e gli occhi in caso di contatto. L'inalazione può anche causare irritazione a polmoni, naso e gola, oltre a provocare tosse. L'esposizione a lungo termine può portare a danni ai polmoni, mancanza di respiro e irrigidimento del torace. L'ingestione infine può causare numerosi effetti avversi tra cui: gonfiore, eruttazione, dolore addominale, irritazione della bocca e della gola, nausea, vomito e diarrea.[7][8]
Dal punto di vista ambientale, il perossido di magnesio non è un composto naturale e non è noto che persista nell'ambiente per tempi prolungati o che si bioaccumuli. La degradazione naturale del perossido di magnesio porta a idrossido di magnesio, ossigeno molecolare (O2) e acqua. Se versato, il perossido di magnesio dovrebbe essere contenuto e isolato da tutti i corsi d'acqua, scarichi fognari e dovrebbe essere isolato da materiali combustibili o sostanze chimiche tra cui carta, stoffa e legno.[5]
Reazioni ambientali comuni
[modifica | modifica wikitesto]Il magnesio esiste nell'alta atmosfera in diverse forme molecolari. A causa della sua capacità di reagire con l'ossigeno comune e semplici composti carbonio-ossigeno, il magnesio può esistere in composti ossidati tra cui per l'appunto il perossido di magnesio, OMgO2, ossido di magnesio e O2MgO2.[9] Reazioni che danno tra i prodotti finali il perossido di magnesio sono le seguenti:
A contatto con l'acqua si decompone seguendo le reazioni:
Note
[modifica | modifica wikitesto]- ^ Scheda del composto su http://gestis-en.itrust.de IFA-GESTIS[collegamento interrotto]
- ^ (EN) Richard J. Plowright, Thomas J. McDonnell, Timothy G. Wright e John M. C. Plane, Theoretical Study of Mg+−X and [X−Mg−Y]+Complexes Important in the Chemistry of Ionospheric Magnesium (X, Y = H2O, CO2, N2, O2, and O), in Journal of Physical Chemistry, vol. 113, n. 33, 28 luglio 2009, p. 9354–9364, DOI:10.1021/jp905642h, PMID 19637880.
- ^ (EN) Sergey S. Lobanov, Qiang Zhu, Nicholas Holtgrewe, Clemens Prescher, Vitali B. Prakapenka, Artem R. Oganov e Alexander F. Goncharov, Stable magnesium peroxide at high pressure, in Scientific Reports, vol. 5, n. 1, 1º settembre 2015, p. 13582, Bibcode:2015NatSR...513582L, DOI:10.1038/srep13582, PMC 4555032, PMID 26323635, arXiv:1502.07381.
- ^ (EN) Mark A. Shand, The Chemistry and Technology of Magnesia, John Wiley & Sons, 2006, ISBN 978-0-471-98056-8.
- ^ a b (EN) M. Vidali, Bioremediation. An overview, in Pure and Applied Chemistry, vol. 73, n. 7, 1º luglio 2001, p. 1163–1172, DOI:10.1351/pac200173071163.
- ^ (EN) Yu-Jie Chang, Yi-Tang Chang e Chun-Hsiung Hung, The use of magnesium peroxide for the inhibition of sulfate-reducing bacteria under anoxic conditions, in J Ind Microbiol Biotechnol, vol. 35, n. 11, 2008, p. 1481–1491, DOI:10.1007/s10295-008-0450-6, PMID 18712535.
- ^ Product Safety Summary: Magnesium Peroxide (PDF), su solvaynorthamerica.com, Solvay America Inc.. URL consultato il 25 aprile 2012.
- ^ (EN) Richard P. Pohanish, Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens, William Andrew, 2011, p. 1645–1646, ISBN 978-1437778700.
- ^ (EN) John M. C. Plane e Charlotte L. Whalley, A New Model for Magnesium Chemistry in the Upper Atmosphere, in Journal of Physical Chemistry A, vol. 116, n. 24, 2012, p. 6240–6252, Bibcode:2012JPCA..116.6240P, DOI:10.1021/jp211526h, PMID 22229654.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Perossido di magnesio
Wikimedia Commons contiene immagini o altri file su Perossido di magnesio










