Potere assorbente del terreno
Il potere assorbente del terreno è la proprietà che ha un suolo di trattenere l'acqua e gli elementi nutritivi indispensabili per la nutrizione delle piante e dei microrganismi.
Ritenzione dell'acqua[modifica | modifica wikitesto]
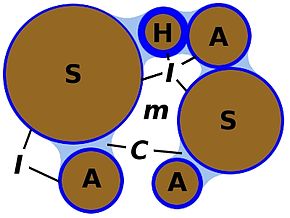
Legenda:
S: particella non colloidale
A: colloide minerale
H: colloide organico
I: acqua d'imbibizione
C: acqua capillare
m: macroporo
Il terreno trattiene l'acqua grazie al concorso di due differenti fenomeni, l'imbibizione e la capillarità, il primo di natura fisico-chimica, il secondo di natura fisica. In entrambi i casi la capacità di ritenuta è riconducibile a forze elettrostatiche che si instaurano fra le molecole d'acqua e la matrice solida del terreno. La pressione che occorre esercitare per sottrarre l'acqua trattenuta dalla matrice solida è detta tensione matriciale e assume valori negativi.
La ritenuta per capillarità è dovuta alla risultante delle forze che agiscono su ogni molecola d'acqua che occupa i pori del terreno. Escludendo la forza esercitata dalle piante con l'assorbimento radicale, queste forze sono riconducibili alle seguenti quattro:
- forze di coesione interne fra le molecole d'acqua;
- forze di adesione fra le molecole d'acqua e la superficie della matrice solida (interfaccia liquido-solido);
- forze di attrazione fra l'atmosfera del terreno e le molecole d'acqua (interfaccia liquido-gas);
- forze gravitazionali che agiscono sulle molecole.
In particolare, sulle molecole disposte a breve distanza dalle particelle solide del terreno, la risultante è concorde alle forze di adesione, mentre sulle molecole relativamente distanti si esercita una risultante concorde alla forza gravitazionale. In altri termini, l'acqua "lontana" dalle particelle solide è soggetta alla percolazione perché attratta dalla forza di gravità, mentre quella "vicina" alle particelle solide è soggetta ad essere trattenuta perché attratta dalle forze di adesione.
Considerando un sistema formato da due particelle solide disposte ad una distanza reciproca d e lo spazio fra loro compreso, l'acqua che occupa questo spazio è soggetta a percolazione se la distanza d supera un determinato valore, mentre è soggetta a ritenuta capillare se la stessa distanza è inferiore. Per convenzione il valore di riferimento della distanza d è di 8 μm: i pori con diametro inferiore a 8 µm (detti micropori) trattengono l'acqua per capillarità vincendo la forza di gravità, mentre quelli con diametro superiore (detti macropori) non riescono a trattenere l'acqua perché soggetta alla forza di gravità. In condizioni ottimali di umidità e aerazione i micropori sono occupati dall'acqua, i macropori dall'aria. L'eventuale presenza di acqua nei macropori è di carattere temporaneo in quanto si tratta di acqua libera, destinata a muoversi lungo il profilo del terreno. Per convenzione si chiama acqua capillare quella trattenuta nei micropori e acqua gravitazionale quella soggetta a movimento attraverso i macropori. L'acqua capillare si dispone nei micropori formando menischi concavi in corrispondenza dell'interfaccia di separazione aria/acqua.
La ritenuta per imbibizione è dovuta alla proprietà delle particelle dotate di cariche elettriche superficiali di attirare l'acqua grazie alle forze elettrostatiche riconducibili al tipo ione-dipolo. L'attrazione elettrostatica è esercitata sia dagli ioni incorporati nel reticolo cristallino dei minerali, sia dai gruppi funzionali dissociati dei composti organici, sia dagli ioni adsorbiti sulla superficie dei colloidi.
In virtù di queste forze, l'acqua tende a formare un velo il cui spessore dipende dall'intensità del campo elettrostatico generato dalle particelle solide. L'interazione fra acqua e particella solida è di tipo superficiale e dipende pertanto dalla densità elettrica della particella. Come tutti i fenomeni d'interfaccia superficiale, l'intensità di questa interazione aumenta all'aumentare del rapporto superficie/volume e, quindi, decresce all'aumentare delle dimensioni delle particelle. In pratica, le forze di attrazione sono molto intense nel caso di particelle di dimensioni atomiche (ioni), relativamente intense nel caso di particelle di dimensioni colloidali (inferiore a 0,1 µm), molto deboli nel caso delle particelle di dimensioni macroscopiche (argilla di oltre 0,1 µm, limo, sabbia e scheletro). La differente intensità delle forze d'attrazione si traduce nello sviluppo di strati d'idratazione di diverso spessore: gli ioni sono circondati da uno spesso strato di molecole d'acqua che ne determina la dispersione in soluzione; le particelle di dimensioni colloidali generano campi abbastanza intensi da legare gli ioni scambiabili e, attraverso la loro idratazione, uno strato di molecole d'acqua abbastanza spesso. Lo spessore di questo strato non ne permette la dispersione, perciò i colloidi del terreno flocculano restando allo stato di gel. Solo nel caso di elevate quantità di sodio adsorbito si avrà un'idratazione tale da disperdere i colloidi. Le particelle più grandi, infine, generano un campo elettrico di modesta intensità e la quantità d'acqua che possono legare è modesta.
Sulla base di quanto detto, la capacità di un terreno di trattenere l'acqua dipende in sostanza da due fattori:
- Porosità totale e rapporto micropori/macropori. Da essi dipende la capacità del terreno di legare l'acqua per capillarità. Queste due proprietà derivano dalla tessitura e dalla struttura: un terreno ricco di particelle grossolane (scheletro e sabbia) ha una modesta superficie di sviluppo, perciò ha una bassa porosità, in gran parte rappresentata da macropori; al contrario, un terreno ricco di particelle fini (limo e, soprattutto, argilla) ha un'elevata superficie di sviluppo e, quindi, una porosità elevata (superiore al 50%) e un rapporto fra micro e macropori a favore dei primi. La struttura influisce soprattutto nei terreni a tessitura fine o finissima: a parità di tessitura i terreni ben strutturati hanno un'elevata porosità e un rapporto equilibrato fra micro e macropori; i terreni mal strutturati hanno una porosità più bassa e prevalentemente composta da micropori.
- Tenore in colloidi. Da questa proprietà dipende la capacità del terreno di legare l'acqua per imbibizione. Dal momento che le particelle colloidali (humus e colloidi minerali) fanno parte della classe granulometrica dell'argilla, tale capacità sarà più alta quanto più alta è la percentuale di argilla. La capacità di imbibizione dipende anche dalla natura dei colloidi: l'humus ha una capacità di ritenuta più alta rispetto ai colloidi minerali; nell'ambito di questi ultimi la capacità è più alta nei minerali ricchi di strati di vermiculite e, soprattutto, montmorillonite.
Assorbimento degli elementi nutritivi[modifica | modifica wikitesto]
L'assorbimento degli elementi nutritivi è una proprietà indispensabile per garantire la nutrizione delle piante e della maggior parte dei microrganismi: gli elementi che compongono i minerali del terreno non sono utilizzabili in quanto, salvo casi particolari, gli organismi viventi non riescono ad estrarre gli ioni incorporati nei reticoli cristallini. Questi sono disponibili nel lungo termine attraverso i processi di disgregazione, alterazione, solubilizzazione che fanno parte della pedogenesi. Gli elementi nutritivi più o meno direttamente assimilabili sono infatti dispersi nella soluzione circolante oppure sono in rapporto con la frazione solida attraverso fenomeni di superficie che interessano solo una quota minima dell'intera massa solida inerte.
La mobilità delle forme direttamente assimilabili degli elementi nutritivi è un requisito essenziale affinché si possa svolgere la nutrizione minerale delle piante, tuttavia predispone queste forme alle perdite per dilavamento. Il terreno possiede pertanto una proprietà di assorbimento che gli permette di trattenere gli elementi in forme stabili in equilibrio con quelle direttamente assimilabili, permettendo il ripristino degli elementi allontanati dalla soluzione circolante.
L'assorbimento è riconducibile a quattro differenti meccanismi, i quali hanno una diversa incidenza secondo gli elementi e secondo le condizioni ambientali.
Assorbimento meccanico[modifica | modifica wikitesto]
L'assorbimento meccanico è la proprietà per cui le particelle contenenti gli elementi nutritivi sono trattenute dal terreno in virtù della loro dimensione maggiore rispetto al diametro dei pori. In altri termini, la porosità del terreno si comporta come un filtro che lascia passare l'acqua e le sostanze in essa disciolte trattenendo le particelle troppo grandi.
Questo meccanismo interessa gli elementi incorporati nei granuli dei concimi e nella sostanza organica. Si tratta di un meccanismo di limitata importanza ai fini pratici perché questi elementi saranno rilasciati in tempi più o meno brevi e saranno soggetti alla mobilità nella soluzione circolante o ad altri meccanismi di assorbimento.
Assorbimento biologico[modifica | modifica wikitesto]
L'assorbimento biologico è la proprietà per cui gli elementi nutritivi sono trattenuti dal terreno attraverso la temporanea immobilizzazione nel ciclo del carbonio. Gli elementi allo stato minerale sono assimilati dagli organismi del terreno, principalmente le piante e i microrganismi, e incorporati nei composti organici per mezzo di legami con il carbonio oppure, come nel caso dei cationi metallici, in forma ionica associati ad acidi organici. Il processo di incorporamento vero e proprio nella sostanza organica è detto organicazione. Per estensione il concetto di organicazione si può applicare anche agli elementi nutritivi presenti in forma ionica sotto forma di sali minerali nelle strutture cellulari e nei liquidi organici in generale (calcio, potassio, magnesio, ecc.): questi elementi saranno infatti restituiti in gran parte al terreno solo con la decomposizione della sostanza organica.
In generale gli elementi immobilizzati nella sostanza organica, sotto forma di biomassa vivente o morta e di humus, sono temporaneamente sottratti sia alle dinamiche di assorbimento da parte degli organismi viventi sia alle dinamiche chimico-fisiche nel terreno. Poiché la sostanza organica del terreno è praticamente immobile (salvo casi molto particolari in cui può migrare lungo il profilo), l'organicazione permette di trattenere gli elementi nutritivi fino alla mineralizzazione.
Si tratta del meccanismo di assorbimento più importante per la ritenzione degli elementi dotati di grande mobilità, quali l'azoto e lo zolfo. Per quanto riguarda l'azoto, la fonte naturale fondamentale è rappresentata dall'azoto atmosferico (N2), convertito prima in forma organica e poi nelle forme assimilabili (ione ammonio e ione nitrato) attraverso l'azotofissazione. La fissazione biologica è un processo che assume proporzioni di grande portata solo in tempi molto lunghi grazie all'accumulo e al riciclo attraverso la sovrapposizione del ciclo dell'azoto con il ciclo del carbonio; in assenza di questa stretta connessione gran parte dell'azoto fissato annualmente si perderebbe.
L'assorbimento biologico è anche la forma principale con cui il terreno trattiene gli elementi nutritivi nelle regioni tropicali: in queste regioni i suoli sono notoriamente poveri a causa dell'intensa mineralizzazione e del dilavamento attuato dalle piogge tropicali. Il motore del flusso di materia nell'ecosistema è rappresentato dalla biomassa vivente, l'unica in grado di sottrarre stabilmente gli elementi nutritivi alle perdite e rilasciarli gradualmente attraverso la fase di mineralizzazione del ciclo del carbonio. Negli ambienti tropicali, la distruzione di una foresta in effetti lascia il terreno in condizioni temporanee di elevata fertilità chimica, ma le condizioni di fertilità sono di breve durata in quanto questi suoli vanno incontro ad un rapido impoverimento come fase iniziale della desertificazione.
Assorbimento chimico[modifica | modifica wikitesto]
L'assorbimento chimico si ha quando una specie chimica passa da una forma solubile ad una insolubile, che precipita. Il fenomeno coinvolge i sali neutri dell'acido carbonico, dell'acido solforico e dell'acido fosforico combinati con metalli alcalino-terrosi (calcio e magnesio), terrosi (alluminio) e il ferro. Non sono interessati dall'assorbimento chimico i rispettivi sali acidi, i nitrati e tutti i sali dei metalli alcalini (potassio, sodio) e dell'ammoniaca.
La precipitazione è causata dal concorso di due fattori:
1. Instaurazione di equilibri di scambio doppio spostati verso la forma insolubile in quanto questa viene sottratta all'equilibrio. Ad esempio, il carbonato di sodio e il nitrato di calcio, entrambi solubili, sono in equilibrio di doppio scambio con il nitrato di sodio e il carbonato di calcio. Quest'ultimo, essendo insolubile, precipita e viene sottratto all'equilibrio determinando il completo spostamento dell'equilibrio verso destra:
2. Instaurazione di equilibri multipli acido-base di acidi poliprotici spostati verso la forma totalmente dissociata del residuo acido che, combinata con determinati cationi, è in genere insolubile (fatta eccezione per i sali ammoniacali e di quelli dei metalli alcalini). Ad esempio, l'acido fosforico in soluzione forma i seguenti equilibri multipli:
Il bilanciamento di questi equilibri è in funzione del pH: all'aumentare del suo valore gli equilibri si spostano verso le forme più dissociate.
L'assorbimento chimico riguarda in particolare il fosforo, soggetto a retrogradazione nei terreni a pH anomalo. Le piante assorbono questo elemento nutritivo sotto forma di ione fosfato biacido (H2PO4-); le condizioni migliori per l'assorbimento si verificano nei terreni neutri, dove gli equilibri multipli dell'acido fosforico sono spostati verso questo ione, neutralizzato dal calcio. In presenza di calcare attivo il valore del pH del terreno aumenta e gli equilibri si spostano verso ione fosfato neutro che precipita sotto forma di fosfato tricalcico:
La precipitazione del fosforo sotto forma di fosfato tricalcico si verifica nei terreni calcarei, con pH superiore a 8. Si tratta di un fenomeno negativo in quanto è sostanzialmente irreversibile e determina una perdita di fosforo assimilabile. La solubilizzazione del fosfato tricalcico, infatti, procede molto lentamente e a questi valori di pH è annullata dalla retrogradazione.
Un'altra forma di assorbimento chimico è la retrogradazione del fosforo nei terreni acidi. In questo caso i residui dell'acido fosforico sono adsorbiti dai colloidi elettropositivi (idrossidi ferro e alluminio) e precipitano sotto forma di fosfati di Fe e Al.
Assorbimento per scambio ionico[modifica | modifica wikitesto]
L'adsorbimento sui colloidi è il meccanismo di assorbimento più importante insieme a quello biologico anche per gli importanti riflessi sulle altre proprietà chimiche del terreno. Interessa in modo particolare i cationi e i residui dell'acido fosforico. Si distingue un adsorbimento cationico e un adsorbimento anionico, che seguono meccanismi differenti.
Colloidi del terreno[modifica | modifica wikitesto]
Come visto in precedenza, le particelle del terreno che hanno dimensioni inferiori a 1 μ hanno proprietà colloidali e si comportano come colloidi idrofili. Dal punto di vista chimico, i colloidi del terreno sono riconducibili a tre tipi: colloidi organici, minerali argillosi, idrossidi di ferro e alluminio.
1. Colloidi organici
I colloidi organici sono rappresentati dalle particelle di humus. L'humus è un composto dotato di proprietà anfotere perché provvisto di gruppi funzionali sia acidi sia basici. Fra i primi rientrano i gruppi carbossilici (-COOH) e i gruppi ossidrile dei fenoli (-OH); entrambi si comportano come acidi cedendo ioni idrogeno e assumendo quindi carica negativa:
Sono basici invece i gruppi amminici in quanto l'azoto può comportarsi come base cedendo il suo doppietto elettronico e assumendo quindi carica positiva:
Ai valori ordinari del pH del terreno, nell'humus prevale la dissociazione delle funzioni acide, perciò si comporta come colloide idrofilo elettronegativo.
2. Minerali argillosi

Anche i minerali argillosi hanno proprietà anfotere derivate dalla possibilità di comportarsi sia come acidi deboli sia come basi deboli. Le cariche negative presenti sui minerali argillosi possono avere differenti origine:
- Presenza di ioni ossidrile sulla superficie del reticolo. L'elemento strutturale dei fillosilicati (ai quali si riconducono i minerali argillosi) è il tetraedro [SiO4]4- polimerizzato con un rapporto Si:O di 1:2,5. In altri termini, tre delle cariche negative sono neutralizzate dalla condensazione del tetraedro con altri tre condividendone gli ioni ossigeno, mentre la quarta è neutralizzata dalla condensazione del piano dei tetraedri con un piano ottaedrico di brucite o di gibbsite. Ai lati dei piani tetraedrici la condensazione dei tetraedri si interrompe e in sostituzione dell'ossigeno sono presenti gruppi idrossido, i quali possono dissociarsi generando cariche elettriche negative:

- In realtà la proprietà acida dei gruppi -OH laterali delle argille è debolissima a causa della spiccata proprietà anfotera dell'acqua e dei gruppi idrossido. Questi siti si dissociano solo a pH superiore a 7, perciò nei terreni neutri e nei terreni acidi non partecipano alla formazione delle cariche negative.
- Sostituzione isomorfa del silicio con l'alluminio nello strato tetraedrico. La sostituzione di un tetraedro [SiO4]4- con un tetraedro [AlO4]5- genera un eccesso di carica negativa che può essere neutralizzata da sostituzioni isomorfe inverse nel piano ottaedrico, con l'adsorbimento o la fissazione di cationi metallici o con la cloritizzazione, ossia con l'alternanza di uno strato 2:1 con uno strato ottaedrico elettropositivo. In ambiente fortemente acido queste cariche sono neutralizzate da ioni idrogeno.
Le proprietà basiche sono invece dovute all'ossigeno dei gruppi idrossido laterali, il quale può comportarsi come base cedendo un doppietto elettronico:
Questa proprietà basica è analoga a quella degli idrossidi di ferro e alluminio e si manifesta in particolare a pH minore di 7. Assume un peso rilevante nei suoli acidi nei minerali argillosi dotati di bassa capacità di scambio cationico, come ad esempio la caolinite, che hanno un comportamento simile a quello degli idrossidi di ferro e alluminio.
Ai valori ordinari del pH del terreno, nei minerali argillosi prevale la dissociazione acida, pertanto si comportano come colloidi idrofili elettronegativi.
3. Idrossidi di ferro e alluminio
Contrariamente agli idrossidi dei metalli alcalini e alcalino-terrosi, l'idrossido ferrico, Fe(OH)3, e l'idrossido di alluminio, Al(OH)3, non si sciolgono in acqua dissociandosi come ioni idratati, bensì formano sospensioni colloidali di unità polimere in cui il metallo (il ferro o l'alluminio) lega sei ioni idrossido in coordinazione ottaedrica. L'unità strutturale è l'ottaedro [M(OH)6]6+[forse 6-?], dove le sei cariche negative in eccesso sono neutralizzate con la condensazione con altri tre ottaedri.
Come si è visto per i minerali argillosi, anche gli idrossidi di ferro e alluminio possono comportarsi come composti anfoteri in virtù della possibilità di cedere gli ioni idrogeno dei gruppi idrossido o di addizionarne ad un doppietto elettronico dell'ossigeno. Nel primo caso si formeranno cariche negative, nel secondo cariche positive.
Ai valori ordinari del pH del terreno prevale la funzione basica, perciò gli idrossidi di ferro e alluminio si comportano come colloidi idrofili elettropositivi.
Scambio cationico[modifica | modifica wikitesto]

Le cariche dei colloidi elettronegativi sono neutralizzate, in condizioni ordinarie, da ioni di metalli del gruppo II (soprattutto calcio e magnesio) e del gruppo I (soprattutto potassio e sodio). Nell'insieme, calcio, magnesio, potassio e sodio sono detti basi di scambio. Oltre alle basi di scambio partecipano alla neutralizzazione lo ione ammonio (NH4+) e, in tracce, metalli pesanti quali il bario, lo stronzio, il rubidio, il cesio, ecc. Quando le basi non sono sufficienti a neutralizzare le cariche, condizione che si verifica nei terreni neutri e, con intensità crescente, nei terreni acidi, una parte più o meno rilevante delle cariche dei colloidi è neutralizzata dagli ioni idrogeno e dagli idrossidi di ferro e alluminio, che diventano prevalenti nei terreni marcatamente acidi.
La superficie sviluppata della matrice colloidale elettronegativa del terreno è detta complesso di scambio e si comporta a tutti gli effetti come uno scambiatore ionico: i cationi sono legati a questa superficie in modo reversibile, in equilibrio con quelli disciolti nella soluzione circolante. Il fenomeno, di natura chimico-fisica, rientra in quello più generale dell'adsorbimento.
La facilità con cui i cationi sono adsorbiti sul complesso di scambio è correlata alla densità di carica e, quindi, in prima analisi, all'elettrovalenza. L'affinità per il complesso di scambio è molto alta nei cationi trivalenti (Al3+ e Fe3+), diminuisce nei cationi bivalenti (Ca2+ e Mg2+) e ancora di più in quelli monovalenti (NH4+, K+, Na+). A questa "regola" fa eccezione lo ione idrogeno, che è il catione con la maggiore affinità per il complesso di scambio. In definitiva gli ioni idrogeno competono con tutti i cationi tendendo a sostituirli nel complesso di scambio quando sono presenti in elevata concentrazione (condizione di acidità), così come il calcio si lega al complesso di scambio più facilmente di quanto faccia il potassio.
A parità di carica elettrica l'affinità per il complesso di scambio è determinata dall'ingombro sterico e, tenendo presente che i cationi sono presenti in soluzione in forma idratata, il fattore determinante è l'energia di idratazione: gli ioni di minori dimensioni hanno una carica elettrica più alta, perciò si idratano più facilmente e avranno una minore affinità per lo scambiatore. Poiché il raggio ionico aumenta con il numero atomico, ne consegue che nell'ambito dello stesso gruppo sono adsorbiti più facilmente gli elementi con numero atomico più alto: in pratica, il calcio si lega più facilmente del magnesio e il potassio più facilmente del sodio.
Ai suddetti fattori si aggiunge la concentrazione nella soluzione circolante: l'affinità di una specie ionica per il complesso di scambio aumenta all'aumentare della sua concentrazione nella soluzione: lo ione sodio ha una bassa affinità per gli scambiatori, tuttavia un'elevata concentrazione di sodio nella soluzione determina una maggiore competitività nello scambio e la tendenza a sostituirsi ad altri cationi.
Questo comportamento è alla base del potere adsorbente del terreno, rendendolo un'importante riserva di elementi nutritivi: quando si verifica un aumento di concentrazione di una base, ad esempio in seguito ad una concimazione, il complesso di scambio tende a trattenerlo rilasciando ioni idrogeno; viceversa, la riduzione del tenore in una base determina il rilascio dal complesso di scambio e l'adsorbimento di ioni idrogeno. In questo modo il complesso di scambio si comporta come un serbatoio di compensazione: trattiene gli elementi nutritivi impedendone il dilavamento e li rilascia gradualmente nella frazione solubile mettendoli a disposizione delle piante.
La ripartizione delle basi di scambio nel terreno è la risultante di un complesso di equilibri in cui entrano in gioco l'affinità per il complesso di scambio, il pH del terreno e la composizione chimica della soluzione circolante.
| Saturazione del complesso di scambio in relazione alla reazione del terreno | ||||
|---|---|---|---|---|
| Terreni fortemente acidi (pH < 5) |
Terreni acidi (pH 5-6) |
Terreni neutri o quasi (pH 6,5-7,5) |
Terreni calcarei (pH 8-8,5) |
Terreni sodici (pH > 8,5) |
| Idrogeno Idrossidi di Fe e Al |
Idrogeno Idrossidi di Fe e Al Magnesio Potassio |
Calcio Magnesio Potassio Idrogeno |
Calcio Magnesio |
Sodio Calcio Magnesio |
Adsorbimento anionico[modifica | modifica wikitesto]
L'adsorbimento degli anioni segue meccanismi differenti e più complessi, in parte fisici perché di natura elettrostatica, in parte chimici perché determinati da vere e proprie reazioni che avvengono sulla superficie dei colloidi. La dinamica di questi fenomeni non è ancora ben nota e non è di facile quantificazione, in quanto fondata sul concorso di meccanismi diversi che possono avere sviluppi differenti. Questo fa in modo che alcuni elementi, presenti in forma anionica, siano trattenuti bene con l'adsorbimento (fosforo), mentre altri siano trattenuti solo in misura marginale e tale da poterli considerare estremamente mobili (azoto nitrico, zolfo, cloro).
Gli anioni di maggiore importanza presenti nel terreno sono i seguenti:
- Ione cloruro: Cl-;
- Ione nitrato: NO3-;
- Ione solfato: rappresentato da due forme, in equilibrio fra loro regolato dal pH, HSO4- e SO42-;
- Ione fosfato: rappresentato da tre forme, in equilibrio fra loro regolato dal pH, H2PO4-, HPO42- e PO43-.
I meccanismi di adsorbimento anionico sono riconducibili a tre tipi:
1. Adsorbimento negativo
In realtà non contribuisce al potere assorbente del terreno in quanto consiste nell'azione repulsiva che i colloidi elettronegativi esercitano sugli anioni. Da un punto di vista quantitativo l'adsorbimento negativo è correlato positivamente alla concentrazione dell'anione nella soluzione circolante e al pH.
2. Adsorbimento non specifico
È un processo fisico-chimico di superficie dovuto ad interazioni elettrostatiche. Si fonda sugli stessi meccanismi dell'adsorbimento cationico, pertanto interessa la frazione colloidale elettropositiva, rappresentata per lo più dagli idrossidi di ferro e alluminio e dai minerali argillosi del tipo della caolinite, cioè dotati di scarsa capacità di scambio cationico e ricchi di gruppi -OH in superficie.
L'adsorbimento non specifico interessa tutti gli anioni, compresi quelli molto mobili come il cloruro e il nitrato, tuttavia gli ioni fosfato hanno una notevole affinità, perciò in presenza anche di basse concentrazioni di fosfati, l'adsorbimento del cloruro e del nitrato viene inibito.

3. Adsorbimento chimico
È un processo chimico di superficie dovuto alla formazione di legami covalenti, che interessa le strutture ottaedriche dei minerali argillosi e degli idrossidi di ferro e alluminio e coinvolge per lo più gli ioni fosfato. L'adsorbimento si svolge attraverso una reazione di scambio di superficie in cui gli ioni H2PO4- e HPO42- si sostituiscono ad uno o due gruppi idrossido. L'adsorbimento si può svolgere in due modi:
- Adsorbimento bidentato: lo ione fosfato si sostituisce a due gruppi idrossido;
- Adsorbimento monodentato: lo ione fosfato si sostituisce ad un gruppo idrossido.
Negli idrossidi di ferro si verifica sempre l'adsorbimento bidentato, mentre negli idrossidi di alluminio si ipotizza che si svolga l'adsorbimento bidentato o quello monodentato in funzione del grado di adsorbimento[1].
Adsorbimento del fosforo[modifica | modifica wikitesto]
Quello del fosforo è l'aspetto più importante dell'adsorbimento anionico. Gli altri anioni, infatti, non sono praticamente interessati dal potere assorbente se non attraverso l'assorbimento biologico, perciò in forma minerale sono sostanzialmente mobili. Al contrario, come si è visto, il fosforo è trattenuto dal potere assorbente con vari meccanismi e nel complesso è un elemento nutritivo poco mobile, se non addirittura soggetto a fenomeni di immobilizzazione irreversibile.
Limitatamente all'adsorbimento anionico, il fosforo può essere trattenuto mediante meccanismi differenti[1]:
- adsorbimento non specifico sui colloidi elettropositivi;
- adsorbimento chimico sui colloidi elettropositivi;
- adsorbimento chimico sui colloidi argillosi in corrispondenza dei gruppi idrossido laterali; in quest'ultimo caso la presenza di basi di scambio bivalenti sui minerali argillosi favorisce la reazione di scambio;
- adsorbimento chimico sull'humus; si ipotizza che il processo si attui attraverso il ferro e l'alluminio complessati all'interno dell'humus e, quindi, il meccanismo sia analogo a quello descritto in precedenza;
- adsorbimento chimico sul calcare.
In merito a quest'ultimo meccanismo, si è riscontrato che le particelle più fini di calcare a basso grado di cristallizzazione hanno proprietà di adsorbimento nei confronti dei fosfati: gli ioni calcio presenti in superficie sono in parte neutralizzati da ioni idrossido, pertanto possono formare complessi con gli ioni fosfato analoghi a quelli che si formano sugli idrossidi di ferro e alluminio.
Un aspetto particolare è il rapporto fra l'adsorbimento anionico del fosforo e la retrogradazione, che rende ancora più complesso il chimismo del fosforo nel terreno. L'aggiunta di fosforo solubile avvia due tipi di interazioni di superficie con la frazione solida che si svolgono con differenti velocità.
Quelle del primo tipo si svolgono in generale nell'arco di poche ore e si identificano con l'adsorbimento non specifico e, soprattutto, con l'adsorbimento chimico. Per le loro caratteristiche intrinseche si tratta di processi reversibili, perciò si può parlare di scambio anionico vero e proprio.
Quelle del secondo tipo si svolgono molto lentamente e si identificano con l'assorbimento chimico (retrogradazione) in quanto portano alla formazione di complessi insolubili. In condizioni di pH anomalo i complessi formati con l'adsorbimento chimico sono instabili e nel tempo portano alla separazione di fosfati insolubili di ferro e alluminio in ambiente acido e di calcio in ambiente basico. In condizioni prossime alla neutralità (fra pH 5,5 e pH 7,5) i fosfati adsorbiti sono più stabili e resistono alla retrogradazione. La retrogradazione è rallentata anche nel caso di adsorbimento sui colloidi organici. Infine, nel microambiente circostante le radici assorbenti (rizosfera), entrano in gioco dinamiche chimiche più complesse e ancora poco note che interferiscono nel chimismo generale del fosforo nel terreno.
Questi aspetti sono di fondamentale importanza nell'impostazione di una corretta tecnica di concimazione fosfatica, in quanto condizioni di pH anomalo portano di fatto a perdite di fosforo per insolubilizzazione, che possono essere contenute solo ricorrendo ad accorgimenti particolari (impiego di concimi ad alto titolo in fosfato monocalcico, ricorso alla concimazione localizzata, somministrazioni dilazionate nel tempo con dosaggi contenuti).
Note[modifica | modifica wikitesto]
Bibliografia[modifica | modifica wikitesto]
- Autori vari, Chimica del suolo, a cura di Paolo Sequi, Bologna, Pàtron, 1989.
- Luigi Giardini, Agronomia generale, 3ª ed., Bologna, Pàtron, 1986.
- Alda Belsito, et al., Chimica agraria, Bologna, Zanichelli, 1988, ISBN 88-08-00790-1.



