Nitrato
| Ione nitrato | |
|---|---|
 | |
| Nome IUPAC | |
| nitrato | |
| Caratteristiche generali | |
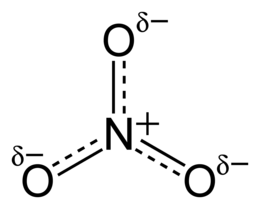
| Formula bruta o molecolare | NO3⁻ |
| Numero CAS | |
| PubChem | 943 |
| DrugBank | DB14049 |
| SMILES | [N+](=O)([O-])[O-] |
| Indicazioni di sicurezza | |
Lo ione nitrato è uno anione poliatomico. Esso ha formula NO−3, e numeri di ossidazione +5 per l'azoto e −2 per ogni atomo di ossigeno. Viene ridotto ad ammoniaca dalla lega di Devarda, formata da una miscela di polveri metalliche.
Presenza[modifica | modifica wikitesto]
Lo ione NO−3 proviene dalla ionizzazione completa dell'acido nitrico HNO3 o dei nitrati quando sono sciolti in acqua. Ciò avviene secondo la seguente formula:
Poiché l'acido nitrico è un acido forte, lo ione nitrato, che costituisce la sua base coniugata, presenta soltanto ridottissime proprietà basiche. Per questo motivo i suoi sali con metalli alcalino-terrosi e di transizione, che sono tutti idrosolubili e che sono detti nitrati, hanno spesso pH acido in soluzione acquosa. Fa eccezione il caso in cui la parte cationica sia l'acido coniugato di una base forte.
Sali[modifica | modifica wikitesto]
I nitrati, composti in cui è presente lo ione nitrato, sono i sali dell'acido nitrico.
Sono tutti molto solubili in acqua e per questo motivo sulla crosta terrestre si possono trovare solo in territori estremamente aridi. I più diffusi in natura sono il nitrato di sodio e il nitrato di potassio.
Sali principali[modifica | modifica wikitesto]
I sali dell'acido nitrico più famosi e di maggior importanza sono i seguenti:
- Nitrato di alluminio (Al(NO3)3).
- Nitrato di ammonio (NH4NO3).
- Nitrato di argento (AgNO3).
- Nitrato di potassio (KNO3).
- Nitrato di piombo (Pb(NO3)2).
- Nitrato di stronzio (Sr(NO3)2).
- Nitrato di tallio (TlNO3).
- Nitrato di zinco (Zn(NO3)2).
Analisi a umido[modifica | modifica wikitesto]
Nell'analisi a umido si procede per riduzione dei nitrati a nitriti e successiva reazione di questi con reattivo di Griess.
Una soluzione alcalina del campione viene trattata con acido acetico fino a che il suo pH è 4-5 e si aggiunge quindi zinco metallico, che riduce i nitrati a nitriti. Per aggiunta del reattivo di Griess, in presenza di nitriti si produce una tipica colorazione rosa.
Un'alternativa per verificare la presenza di nitrati è il saggio dell'anello bruno.
Applicazioni e importanza[modifica | modifica wikitesto]
Lo ione NO−3 ed alcuni suoi sali ricoprono un'importanza fondamentale sia per la natura sia per l'uomo; esso è infatti indispensabile per il metabolismo vegetale e quindi per il mantenimento di tutti gli ecosistemi. Inoltre è un ottimo fertilizzante, soprattutto quando è compreso nel nitrato d'ammonio NH4NO3, un suo sale, a causa dell'elevato contenuto d'azoto.
Nel secolo scorso il sale AgNO3, o nitrato d'argento, è stato adoperato per lo studio e la creazione dei primi apparecchi fotografici ed è tuttora adoperato per saggiare la potabilità dell'acqua di rubinetto. Il nitrato di argento è anche utilizzato come catalizzatore nella reazione che è alla base del funzionamento dell'alcool test. Infine questo ione è anche il nutrimento dei cosiddetti batteri denitrificanti che hanno il ruolo biologico di produrre azoto molecolare N2 a partire da esso.
Diverse categorie di nitrati sono utilizzati dall'industria alimentare come conservanti di categoria E, coloranti e antiossidanti. Sono indicati nelle etichette con le sigle E251 ed E252. Il loro impiego è praticamente reso obbligatorio per i salumi crudi stagionati ed è principalmente dovuto al fatto che i nitrati sono al momento l'unica alternativa nota per contrastare la germinazione delle spore di Clostridium botulino, una delle più gravi forme di infezione alimentare dall'esito mortale, infezione che può soltanto essere prevenuta.
La ricerca di base per altre forme è vietata nei laboratori non specializzati a contatto con gli studenti quali sono le università, limitando ulteriormente i centri disponibili.
Un secondo scopo è quello di formare e stabilizzare il colore rosso delle carni, in particolare del prosciutto cotto. Questo scopo è secondario perché è ottenibile anche con l'impiego di vitamina C oppure di particolari banchi gastronomici con tipi di vetro che riflettono opportunamente la luce. In alcuni casi stabilizzare il colore richiede quantità anche più alte di quelle strettamente necessarie alla conservazione o alla prevenzione del botulismo.
Le carni, come l'acqua potabile e numerosi ortaggi, contengono naturalmente nitrati e nitriti. I nitriti sono un componente del salnitro impiegato nella preparazione degli insaccati e trovano un impiego in quantità minori per esaltare il colore e il sapore della carne.
I nitrati sono presenti anche in alimenti di origine vegetale, specialmente a causa dei fertilizzanti.
I nitrati possono essere trasformati in nitriti durante la preparazione e conservazione dei cibi o durante la digestione dall'azione di particolari batteri nitrificanti in un ambiente umido poco illuminato e acido. Le ammine sono presenti nei prodotti alimentari contenenti proteine (carne, salumi, formaggi). Come i nitriti, a seguito di determinate reazioni in ambiente acido a pH 3,2, il pH dello stomaco con acido cloridrico tra i succhi gastrici è compreso tra 1 e 2, possono formare nitrosammine, classificate come cancerogene.
I nitrati si trasformano in acido nitroso e poi in nitriti nel microbiota umano e nella saliva. Attraverso una serie di reazioni in ambiente acido diventano nitrosammine, provatamente cancerogene. La trasformazione di nitrati in nitriti è catalizzata dalla nitrato-reduttasi, enzima presente nel microbiota umano della cavità orale e del lume intestinale.
Tuttavia vitamina C (acido ascorbico) e la vitamina E (alfa-tocoferolo) sono capaci di inibire la conversione dei nitriti in nitrosammine, trasformandoli in monossido di azoto, importante per la vasodilatazione e il controllo dell'aggregazione piastrinica, dunque con un effetto antitrombotico; in altri casi la reazione chimica produce acido nitrico, nota sostanza mutagena.
I limiti sono stabiliti dalla Direttiva 2006/52/CE, recepita in Italia con il D.M. della Salute del 27 febbraio 2008, che supera il D.M. 209 del 27 febbraio 1996 e non modificati dal Regolamento 1129/2011. Nonostante la documentata pericolosità, l'impiego non è limitato in linea di principio alla sola funzione antibotulinica o di conservante, ma è esteso anche alle proprietà antiossidanti e coloranti dei nitrati, aumentandone a parità di limiti massimi il dosaggio possibile per singolo prodotto. Tuttavia i limiti massimi di legge, almeno per il nitrito di sodio fissati a 50–100 mg/kg, già di fatto coincidono con la quantità minima necessaria per la sicurezza alimentare[1]. L'impiego è consentito dalla legge anche nei prodotti DOC e IGP, salvo l'adozione di scelte e di un disciplinare diverso da parte dei singoli produttori.
Note[modifica | modifica wikitesto]
- ^ Scientific Panel on Biological Hazards presso l'EFSA, The EFSA Journal (2003), 14, 1-13
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su nitrato
Wikimedia Commons contiene immagini o altri file su nitrato
Collegamenti esterni[modifica | modifica wikitesto]
- nitrato, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- nitrato², su Vocabolario Treccani, Istituto dell'Enciclopedia Italiana.
- (EN) nitrate, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Effetti collaterali dei nitrati, su cibo360.it.
| Controllo di autorità | Thesaurus BNCF 37237 · GND (DE) 4115398-4 |
|---|


