Piridina
| Piridina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| piridina | |
| Abbreviazioni | |
| Py | |
| Nomi alternativi | |
| azina azabenzene | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C5H5N |
| Massa molecolare (u) | 79,1012 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 203-809-9 |
| PubChem | 1049 |
| SMILES | C1=CC=NC=C1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,978 |
| Indice di rifrazione | 1,509 |
| Costante di dissociazione acida (pKa) a 298 K | 5,3 |
| Solubilità in acqua | solubile |
| Temperatura di fusione | −42 °C (231 K) |
| Temperatura di ebollizione | 115 °C (388 K) |
| ΔebH0 (kJ·mol−1) | 40,4 |
| Tensione di vapore (Pa) a 293 K | 2000 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | 100,2 |
| C0p,m(J·K−1mol−1) | 132,7 |
| Indicazioni di sicurezza | |
| Punto di fiamma | 17 °C (290 K) |
| Limiti di esplosione | 1,7 - 12,4% vol. |
| Temperatura di autoignizione | 482 °C (755 K) |
| TLV (ppm) | TWA 10 (15 mg/m³) |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 225 - 302 - 312 - 332 [1] |
| Consigli P | 210 - 233 - 302+352 [2] |
La piridina è un composto eterociclico aromatico a sei termini, appartenente al gruppo delle azine; a temperatura ambiente si presenta come un liquido incolore dallo sgradevole odore caratteristico.
La piridina si ottiene sia per sintesi a partire da acetaldeide e ammoniaca oltreché per distillazione del carbone.
Proprietà[modifica | modifica wikitesto]
Basicità[modifica | modifica wikitesto]
Grazie alla disponibilità della coppia solitaria di elettroni sull'azoto, la piridina si comporta sia da base sia da nucleofilo. Tuttavia, poiché la coppia di elettroni risiede in un orbitale sp2 con maggior carattere s rispetto a un orbitale sp3, la sua basicità è notevolmente inferiore a quella delle ammine alifatiche.

In presenza di composti acidi, la piridina lega a sé uno ione H+ per dare il catione piridinio C5H5NH+.
Polarità[modifica | modifica wikitesto]
Essendo l'azoto più elettronegativo del carbonio, esso modifica la distribuzione elettronica all'interno dell'anello. La maggior densità elettronica risiede sull'atomo di azoto, mentre la minor densità elettronica risiede sugli atomi di carbonio, in particolare sui carboni α e γ.

Ciò significa che la piridina esibisce un elevato valore del momento dipolare che porta a un punto di ebollizione abbastanza alto (il benzene, a titolo d'esempio, bolle a 80 °C).

Chemical shift[modifica | modifica wikitesto]
La piridina presenta valori di chemical shift differenziati, a seconda della posizione nell'anello rispetto all'azoto. Infatti, per effetto mesomero e induttivo, i protoni in posizione α e γ hanno valori di chemical shift più elevati di quelli dei protoni in posizione β. Ciò è dovuto al momento dipolare della molecola e alla delocalizzazione nell'anello degli elettroni.

Da questo punto di vista l'effetto causato dall'azoto all'interno dell'anello può essere paragonato a quello del gruppo -NO2 del nitrobenzene.
Spettri[modifica | modifica wikitesto]


Struttura[modifica | modifica wikitesto]
La sua struttura è planare e ha la forma di un esagono grossomodo regolare, inoltre essendo aromatico presenta la tipica delocalizzazione degli elettroni sopra e sotto il piano.
L'atomo di azoto partecipa al sistema aromatico con un elettrone spaiato nell'orbitale p; il suo doppietto elettronico non condiviso giace pertanto sul piano della molecola in un orbitale sp2.

Reattività[modifica | modifica wikitesto]

La piridina dà reazione di sostituzione e non di eliminazione. L'azoto nella piridina essendo più elettronegativo degli atomi di carbonio attrae fortemente la nuvola elettronica π lasciando l'anello tendenzialmente positivo e quindi adatto a subire SNAr.
Reazioni acido-base[modifica | modifica wikitesto]
Come esposto sopra, la piridina è relativamente basica e dà reazioni acido-base classiche.

Benché per ragioni diverse, la sua basicità può essere paragonata a quella dell'anilina.

I gruppi sostituenti influenzano la basicità della piridina in base alla natura e alla posizione del sostituente nell'anello aromatico. Gruppi elettrofili (come il Cl) abbassano il pKa e quindi la basicità diminuisce, questo soprattutto se il gruppo è in posizione β. Gruppi elettrondonatori, invece, aumentano il carattere basico, soprattutto se sono nelle posizioni α e γ.

Reazioni con elettrofili[modifica | modifica wikitesto]

Sostituzione elettrofila aromatica[modifica | modifica wikitesto]
Il gruppo aza =N- si comporta come un gruppo fortemente elettronattrattore, paragonabile al gruppo -NO2. Come tale, esso disattiva l'anello verso la sostituzione elettrofila aromatica. Inoltre, l'interazione dell'azoto con reagenti e catalizzatori (acidi di Lewis), sovente necessari alla reazione, contribuisce a rendere l'anello della piridina ancor più disattivato. Ovviamente, come mostrano le strutture limiti di risonanza dell'intermedio carbocationico, la posizione che risulta meno disattivata è la posizione β che, di conseguenza, è quella che subisce l'attacco.
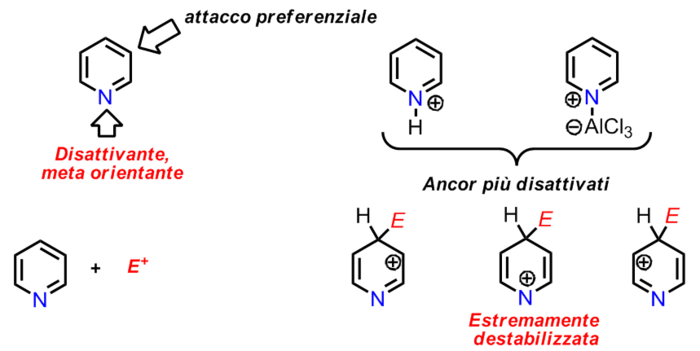
Nitrazione[modifica | modifica wikitesto]

È possibile notare che il prodotto finale è in concentrazioni molto basse.
Solfonazione[modifica | modifica wikitesto]

Acetossimercuriazione[modifica | modifica wikitesto]
Questo processo fornisce un intermedio di sintesi estremamente versatile e può essere usato per l'introduzione di diverse funzionalità nell'anello aromatico.

Alogenazione[modifica | modifica wikitesto]

La presenza di altri gruppi influenza notevolmente sia la reattività dell'anello piridinico sia l'orientamento. I gruppi elettron-attrattori (-SO3H, NO2, COR, etc.) rendono pressoché inerte l'anello piridinico. I gruppi elettron-donatori (OH, OR, NR2, ecc.) rendono più reattive le piridine sostituite. L'orientamento è quello previsto nelle sostituzioni elettrofile su benzeni sostituiti con un gruppo elettron-attrattore.

Sostituzione nucleofila aromatica[modifica | modifica wikitesto]
Quando la piridina si trova a reagire con nucleofili estremamente forti (ad esempio organometalli polari R-M) è possibile osservare la sostituzione dell'idrogeno, il quale esce come ione idruro. In questi casi speciali, l'attacco avviene sempre in posizione 2 (o α).

Reazioni di riduzione[modifica | modifica wikitesto]

Usi[modifica | modifica wikitesto]
La piridina è ampiamente usata come solvente, data la sua versatilità: è polare ma aprotica. È miscibile con una vasta gamma di solventi compreso esano e acqua. La piridina deuterata, denominata D5, è un solvente comune per la spettroscopia NMR.
Nella sintesi chimica la piridina è importante nel ramo industriale, sia come reagente fondamentale sia come un solvente per reazioni di sintesi organica. È, ad esempio, usata come solvente nella condensazione di Knoevenagel.
È inoltre un prodotto risultante dalla sintesi di prodotti come insetticidi, diserbanti, prodotti farmaceutici, aromi per alimenti, tinture, prodotti di gomma, adesivi, vernici, esplosivi e disinfettanti. La piridina inoltre è usata come denaturante per miscele antigelo, per l'alcol etilico e per fungicidi.
Tossicità[modifica | modifica wikitesto]
La piridina è una sostanza tossica per inalazione, ingestione e assorbimento attraverso la pelle. È un sospetto cancerogeno e riduce la fertilità maschile. Tra i sintomi più comuni legati all'esposizione alla piridina rientrano la nausea, il vomito, il mal di testa, la tosse e la difficoltà a respirare.
Immagini 3D della piridina[modifica | modifica wikitesto]


Note[modifica | modifica wikitesto]
- ^ ESIS - Classification and Labelling: CLP/GHS, page 3 Archiviato il 6 novembre 2014 in Internet Archive.
- ^ scheda della piridina su IFA-GESTIS
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su piridina
Wikimedia Commons contiene immagini o altri file su piridina
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) pyridine, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 20921 · LCCN (EN) sh85109332 · GND (DE) 4176469-9 · BNF (FR) cb12152312z (data) · J9U (EN, HE) 987007551084505171 · NDL (EN, JA) 00569116 |
|---|