Ossetano
| Ossetano | |
|---|---|
 | |
 | |
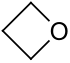
| Nome IUPAC | |
| Ossetano | |
| Nomi alternativi | |
| Ossido di trimetilene Ossido di 1,3-propilene 1,3-epossipropano Ossaciclobutano | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C3H6O |
| Massa molecolare (u) | 58,08 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 207-964-3 |
| PubChem | 10423 |
| SMILES | C1COC1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,89 |
| Indice di rifrazione | 1,3895 |
| Solubilità in acqua | 681 g/L |
| Coefficiente di ripartizione 1-ottanolo/acqua | -0,14 |
| Temperatura di fusione | -97 °C (176,15 K) |
| Temperatura di ebollizione | 48 °C (321,15 K) |
| Tensione di vapore (Pa) a 293,15 K | 35 000 |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 500 (ratto, sottocutanea) |
| Indicazioni di sicurezza | |
| Punto di fiamma | -37 °C (236,15 K) |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 225 - 302+312+332 |
| Consigli P | 210 - 233 - 302+352 - 403+235 [1] |
L'ossetano o ossido di 1,3-propilene, noto anche come ossido di trimetilene,[2] è un composto eterociclico a quattro termini contenente tre atomi di carbonio e uno di ossigeno ed è quindi un etere ciclico, l'omologo superiore dell'ossido di etilene. La sua formula molecolare è (CH2)3O e a temperatura ambiente si presenta come un liquido mobile incolore, dall'odore aromatico gradevole[3] e molto infiammabile; è solubile in acqua in ogni proporzione (come anche il suo omologo THF)[4][5] come pure in alcool, molto solubile in etere, acetone e nei comuni solventi organici.[6] La molecola è un po' più polare (μ = 1,94 D) dell'ossido di etilene (μ = 1,89 D) e dell'acqua (μ = 1,86 D)[7].
Sebbene non sia un epossido partecipa, limitatamente, ad alcune reazioni d'apertura d'anello (reazioni di addizione) che sono tipiche degli epossidi. Questo perché negli anelli a quattro termini permane una certa tensione d'anello, che però risulta minore che nel ciclobutano, da cui l'ossetano formalmente deriva. Mentre infatti la tensione angolare (parte della tensione d'anello dovuta agli angoli di legame) è praticamente invariata (anelli a quattro termini per entrambi), la tensione di eclissamento è un po' minore, derivando da 3 metileni (CH2), invece di 4, soggetti ad eclissamento in conformazione planare. Questo comporta che l'anello dell'ossetano, pur piegato lungo le diagonali (alternativamente), è più vicino alla planarità di quello del ciclobutano.[8]
Sintesi[modifica | modifica wikitesto]
Un metodo tipico di sintesi consiste nella reazione fra l'idrossido di potassio e il 3-cloropropil acetato a 150 °C:[9]

La resa in ossetano di questa reazione è del 40% circa, avendosi una varietà di sottoprodotti.
Un metodo alternativo sfrutta la ciclizzazione del 3-cloropropan-1-olo in presenza di una base forte:

La resa di quest'ultima reazione è ancora inferiore a quella della precedente (20-25%).[9]
Un'altra possibile sintesi usa la reazione di Paternò-Büchi. L'anello di ossetano può formarsi pure tramite la ciclizzazione di un diolo e la decarbossilazione di esteri ciclici dell'acido carbonico a sei atomi.
Reattività[modifica | modifica wikitesto]
Reagisce con i reattivi di Grignard o con i reattivi di organolitio in soluzione eterea alchilandosi [10] al C-2 (o C-4):
- (CH2)3O + RMgX → R(CH2)3OH
- (CH2)3O + RLi → R(CH2)3OH
ad esempio, con CH3MgI (o con metilitio) in THF dà, dopo idrolisi, l'1-butanolo.
Reagisce con le ammine per dare 1,3-amminopropanoli:[11]
- (CH2)3O + RNH2 → RNH(CH2)3OH
Gli acidi di Lewis come il trifluoruro di boro (BF3) possono legarsi all'ossetano attraverso un doppietto non condiviso dell'ossigeno. Utilizzando come solvente il diclorometano, in questo modo si ottiene una ciclo-oligomerizzazione con la formazione prevalente di un trimero ciclico (1):[12]

In condizioni di reazione differenti, specialmente in presenza di acqua, si ottengono polieteri lineari [–CH2CH2CH2O–]n.[12]
Presenza in natura[modifica | modifica wikitesto]
Il taxolo è un composto naturale, estratto originariamente dalla corteccia del tasso del Pacifico (Taxus brevifolia), che contiene un anello di ossetanico e viene utilizzato come farmaco anticancro in grado di inibire la mitosi.[13]
Note[modifica | modifica wikitesto]
- ^ Scheda dell'ossetano su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ Frank C. Whitmore, ORGANIC CHEMISTRY, Chapman & Hall, Ltd., 1937, p. 374.
- ^ (EN) PubChem, Oxetane, su pubchem.ncbi.nlm.nih.gov. URL consultato il 17 agosto 2021.
- ^ Altre fonti parlano di grande solubilità, ma non completa.
- ^ L'omologo successivo, il tetraidropirano, con anello a sei termini, ha una solubilità in acqua pari a 80 g/L soltanto.
- ^ (EN) PubChem, Oxetane, su pubchem.ncbi.nlm.nih.gov. URL consultato il 17 agosto 2021.
- ^ Haynes, William M., ed., Thomas J. Bruno, associate ed. e David R. Lide, Internet ed., CRC Handbook of Chemistry and Physics, Internet Version 2016, Boca Raton, FL: CRC Press., 1988, p. 9-58.
- ^ Michael B. Smith e Jerry March, MARCH’S ADVANCED ORGANIC CHEMISTRY, 6ª ed., Wiley-Interscience, 2007, p. 212, ISBN 0-471-72091-7.
- ^ a b C. R. Noller, Trimethylene Oxide, in Organic Syntheses, vol. 29, 1955, p. 92, DOI:10.15227/orgsyn.029.0092.
- ^ T. W. G. Solomons, C. B. Fryhle e S. A. Snyder, 12, in Organic Chemistry, 11ª ed., John Wiley & Sons, Inc., 2013, p. 575, ISBN 978-1-118-13357-6.
- ^ Michael B. Smith e Jerry March, MARCH’S ADVANCED ORGANIC CHEMISTRY, 6ª ed., Wiley-Interscience, 2007, pp. 565-566, ISBN 0-471-72091-7.
- ^ a b Theophil Eicher, Siegfried Hauptmann e Andreas Speicher, The Chemistry of Heterocycles, Wiley-VCH, 2012, pp. 45-48, ISBN 978-3-527-32747-8.
- ^ (EN) Dan Willenbring e Dean J. Tantillo, Mechanistic possibilities for oxetane formation in the biosynthesis of Taxol’s D ring, in Russian Journal of General Chemistry, vol. 78, n. 4, 2008-04, pp. 723–731, DOI:10.1134/S1070363208040336. URL consultato il 17 agosto 2021.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file sull'ossetano
Wikimedia Commons contiene immagini o altri file sull'ossetano
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) oxetane, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.