Tumore dello stomaco: differenze tra le versioni
+Segni e sintomo (da en.wiki) |
→Cause: Amplio (da en.wiki) |
||
| Riga 55: | Riga 55: | ||
== Cause == |
== Cause == |
||
Il tumore allo stomaco è una patologia multifattoriale.<ref>{{cite journal | author = Lee YY, Derakhshan MH |date=Jun 2013 | title = Environmental and lifestyle risk factors of gastric cancer | url = | journal = Arch Iran Med. | volume = 16 | issue = 6| pages = 358–65 | pmid = 23725070 }}</ref> L'infezione da ''[[Helicobacter pylori]]'' è un fattore di rischio riconosciuto nel 65%-80% dei casi, ma solo nel 2% di tali infezioni porta a sviluppare la neoplasia.<ref name="GVRF-4">{{cite web|url=http://www.who.int/vaccine_research/documents/en/gvrf2003.pdf |title=Proceedings of the fourth Global Vaccine Research Forum |date=April 2004 |work=Initiative for Vaccine Research team of the Department of Immunization, Vaccines and Biologicals |publisher=WHO |quote=Epidemiology of ''Helicobacter pylori'' and gastric cancer… |accessdate=2009-05-11}}</ref><ref name="pmid24011243">{{cite journal| author= González CA, Sala N, Rokkas T | title=Gastric cancer: epidemiologic aspects| journal=Helicobacter| year=2013 | volume=18 | issue=Supplement 1 | pages=34–38 | pmid=24011243 | doi=10.1111/hel.12082| last2=Sala| last3=Rokkas}}</ref> Il meccanismo con cui l'''H. pylori'' induce il cancro allo stomaco coinvolge l'infiammazione cronica o l'azione dei [[Virulenza|fattori di virulenza]], come il [[CagA]].<ref name="pmid16367902">{{cite journal | author = Hatakeyama, M. & Higashi, H | title = Helicobacter pylori CagA: a new paradigm for bacterial carcinogenesis | journal = Cancer Science | volume = 96 | issue = 12| pages = 835–843 | year = 2005 | pmid = 16367902 | doi = 10.1111/j.1349-7006.2005.00130.x | last2 = Higashi }}</ref> |
|||
L'incidenza del tumore dello stomaco aumenta in presenza di fattori ambientali e alimentari, in caso di dimostrata infezione da [[Helicobacter pylori]], [[gastrite cronica]], [[ulcera peptica]] e anche da carenza o eccesso alimentare di [[iodio]]<ref name="stod1">{{Cita pubblicazione|cognome= Venturi|nome= S.|coautori=Donati, F.M.; Venturi, A.; Venturi, M.;|url=http://www.medsci.org/v05p0189.htm|titolo= Role of iodine in evolution and carcinogenesis of thyroid, breast and stomach.= Adv Clin Path.|anno= 2000|volume= 4| pmid = 10936894 |numero= 4|pmc = 2452979|pp= 11-17}}</ref> |
|||
Il [[tabagismo]] aumenta significativamente il rischio di sviluppare il tumore allo stomaco: da un aumento del 40% per i fumatori correnti aumento a un 82% per i forti fumatori. I tumori gastrici causati dal fumo si verificano soprattutto nella parte superiore dello stomaco e nell'esofago distale.<ref name=ACS_Risk/><ref>{{cite journal | author = Nomura A, Grove JS, Stemmermann GN, Severson RK | title = Cigarette smoking and stomach cancer | journal = Cancer Research | volume = 50 | issue = 21 | pages = 7084 | year = 1990 | pmid = 2208177 | doi = | url = http://cancerres.aacrjournals.org/cgi/pmidlookup?view=long&pmid=2208177 | last2 = Grove | last3 = Stemmermann | last4 = Severson }}</ref><ref>{{cite journal | author = Trédaniel J, Boffetta P, Buiatti E, Saracci R, Hirsch A | title = Tobacco smoking and gastric cancer: Review and meta-analysis | journal = International Journal of Cancer | volume = 72 | issue = 4 | pages = 565–73 |date=August 1997 | pmid = 9259392 | doi = 10.1002/(SICI)1097-0215(19970807)72:4<565::AID-IJC3>3.0.CO;2-O | last2 = Boffetta | last3 = Buiatti | last4 = Saracci | last5 = Hirsch }}</ref> Alcuni studi mostrano un aumento del rischio dovuto al consumo di [[bevanda alcolica|alcol]].<ref name="pmid24011243"/><ref name="pmid24291271">{{cite journal | author =Thrumurthy SG, Chaudry MA, Hochhauser D, Ferrier K, Mughal M | title = The diagnosis and management of gastric cancer| journal = British Medical Journal | volume = 347 | issue = 16| pages = 1695–6 | year = 2013 | pmid =24291271 | doi =10.1136/bmj.f6367 | last2 = Chaudry| last3 = Hochhauser| last4 = Mughal}}</ref> |
|||
Non è stato dimostrato che l'adozione di una particolare [[dieta (alimentazione)|dieta]] possa essere una causa ma alcuni alimenti, tra cui cibi affumicati<ref name="pmid16865769">{{cite journal| author=Jakszyn P, González CA | title=Nitrosamine and related food intake and gastric and oesophageal cancer risk: A systematic review of the epidemiological evidence| journal=World J Gastroenterol| year=2006 | volume=12 | issue=27 | pages=4296–4303 | pmid=16865769| pmc=4087738| url = http://www.wjgnet.com/1007-9327/pdf/v12/i27/4296.pdf| last2=Gonzalez}}</ref>, cibi salati e ricchi di sale, carne rossa, carni lavorate e verdure sott'olio<ref name="pmid24011243"/>, sono stati correlati ad un rischio più elevato di incorrere in tale patologia. [[Nitrati]] e [[nitriti]] presenti nei [[salumi]] possono essere convertiti da alcuni [[batteri]], tra cui l'''H. pylori'', in composti che sono stati dimostrati essere responsabili, negli animali, dell'insorgenza di un tumore allo stomaco. D'altra parte, la frutta fresca e la verdura, gli [[agrumi]] e l'assunzione di [[antiossidanti]] sono associati con una diminuzione del rischio di cancro.<ref name="pmid24011243"/><ref name=ACS_Risk>{{cite web|url=http://www.cancer.org/cancer/stomachcancer/detailedguide/stomach-cancer-risk-factors|title=What Are The Risk Factors For Stomach Cancer(Website)|publisher=American Cancer Society|accessdate=2010-03-31}}</ref> Seguire una [[dieta mediterranea]] può portare un beneficio.<ref name="pmid20007304">{{cite journal |author=Buckland G, Agudo A, Luján L, ''et al.'' |title=Adherence to a Mediterranean diet and risk of gastric adenocarcinoma within the European Prospective Investigation into Cancer and Nutrition (EPIC) cohort study |journal=Am. J. Clin. Nutr. |volume=91 |issue=2 |pages=381–90 |year=2010 |month=February |pmid=20007304 |doi=10.3945/ajcn.2009.28209 |url=http://www.ajcn.org/cgi/pmidlookup?view=long&pmid=20007304}}</ref> |
|||
Esiste una correlazione tra carenza di [[iodio]] e il tumore allo stomaco.<ref name="stod1">{{Cita pubblicazione|cognome= Venturi|nome= S.|coautori=Donati, F.M.; Venturi, A.; Venturi, M.;|url=http://www.medsci.org/v05p0189.htm|titolo= Role of iodine in evolution and carcinogenesis of thyroid, breast and stomach.= Adv Clin Path.|anno= 2000|volume= 4| pmid = 10936894 |numero= 4|pmc = 2452979|pp= 11-17}}</ref><ref>{{Cite book|last=Josefssson |first=M. |last2=Ekblad |first2=E. |year=2009 |pages=215–220|chapter=22. Sodium Iodide Symporter (NIS) in Gastric Mucosa: Gastric Iodide Secretion |title=Comprehensive Handbook of Iodine: Nutritional, Biochemical, Pathological and Therapeutic Aspects |editor-first=Victor R. |editor-last=Preedy |editor2-first=Gerard N. |editor2-last=Burrow |editor3-first=Ronald |editor3-last=Watson|isbn=978-0-12-374135-6 |publisher=Elsevier}}</ref><ref>{{Cite journal|author=Venturi, Sebastiano|title=Evolutionary Significance of Iodine|journal=Current Chemical Biology-|volume=5|year=2011|issue=3 |pages=155–162 |issn=1872-3136|doi=10.2174/187231311796765012}}</ref><ref name="stod1">{{cite journal|last = Venturi II|first = S.|author2 =Donati, F.M.; Venturi, A.; Venturi, M.;|url=http://www.medsci.org/v05p0189.htm|title= Role of iodine in evolution and carcinogenesis of thyroid, breast and stomach.|journal= Adv Clin Path|year = 2000|volume = 4| pmid = 10936894 |issue = 1|pages = 11–17|last3 = Venturi|first3 = A|last4 = Venturi|first4 = M|last5 = Grossi|first5 = L|last6 = Guidi|first6 = A}}</ref> |
|||
L'[[incidenza (epidemiologia)|incidenza]] di questa neoplasia mostra una predominanza maschile: fino al doppio rispetto al sesso femminile. Sembra che gli [[estrogeni]] possano svolgere un rullo protettivo.<ref>{{cite book |
|||
| last = Chandanos |
|||
| first = Evangelos |
|||
|date=December 2007 |
|||
| title = Estrogen in the development of esophageal and gastric adenocarcinoma |
|||
| publisher = Karolinska Institutet |
|||
| isbn = 978-91-7357-370-2 |
|||
| url = http://diss.kib.ki.se/2007/978-91-7357-370-2/thesis.pdf |
|||
| format = PDF |
|||
| type = Doctoral thesis}} |
|||
</ref><ref>Chandanos E, Lagergren J. Oestrogen and the enigmatic male predominance of gastric cancer. Eur J Cancer. 2008 Nov;44(16):2397-403.</ref><ref name="pmid24934239">{{cite journal |author=Qin J, Liu M, Ding Q, ''et al.'' |title=The direct effect of estrogen on cell viability and apoptosis in human gastric cancer cells |journal=Mol. Cell. Biochem. |volume=395 |issue=1-2 |pages=99–107 |year=2014 |month=October |pmid=24934239 |doi=10.1007/s11010-014-2115-2 |url=http://dx.doi.org/10.1007/s11010-014-2115-2}}</ref> |
|||
Circa il 10% dei casi mostra una componente [[genetica]].<ref>{{cite journal | author = Lee H-J, Yang H-K, Ahn Y-O | title = Gastric cancer in Korea | journal = Gastric Cancer | volume = 5 | issue = 3 | pages = 177–82 | year = 2002 | pmid = 12378346 | doi = 10.1007/s101200200031 | last2 = Yang | last3 = Ahn }}</ref> |
|||
Le persone possono avere alcuni fattori di rischio, fisici o genetici, che possono alterare la loro suscettibilità al tumore dello stomaco. L'[[obesità]] è uno di questi fattori di rischio fisico che aumenta la probabilità di sviluppare [[adenocarcinoma]] gastrico in seguito all'instaurarsi della [[malattia da reflusso gastroesofageo]].<ref name="crew">{{cite journal | author = Crew K, Neugut A | title = Epidemiology of gastric cancer | journal = World Journal of Gastroenterology | volume = 12 | issue = 3 | pages = 354–62 |date=January 2006}}</ref> Il meccanismo esatto attraverso il quale l'obesità provoca il reflusso non è completamente noto. Gli studi ipotizzano che l'aumento dei grassi alimentari e del [[tessuto adiposo]] in eccesso, con conseguente aumento della pressione sullo stomaco e sullo sfintere esofageo inferiore, possa essere una spiegazione, ma vi sono (al 2014) ancore dati statisticamente significativi.<ref name="hamp">{{cite journal | author = Hampel Howard, Abraham Neena S., and El-Serag Hashem B. | title = Meta-Analysis: obesity and the risk for gastroesophageal reflux disease and its complications | journal = Annal of Internal Medicine | volume = 143 | issue = 3 | pages = 199–211 |date=August 2005}}</ref> Tuttavia, il rischio di adenocarcinoma gastrico con presenza di reflusso gastroesofageo è stato riscontrato con una frequenza doppia nelle persone obese.<ref name="crew"/> |
|||
Un difetto genetico del [[gene]] CDH1 è anch'esso un fattore di rischio. Questo gene, che codifica per le [[Caderina|E-caderine]], si trova sul [[cromosoma 16]].<ref name="chel"/> Quando va in corso ad una particolare [[mutazione genetica|mutazione]] si sviluppa il tumore allo stomaco attraverso un meccanismo che al 2014 non è stato ancora del tutto chiarito.<ref name="chel"/> Questa mutazione è considerata autosomica dominante.<ref name="chel"/> La diagnosi di ereditarietà al tumore allo stomaco solitamente avviene quando si riscontrano almeno due casi in membri della stessa famiglia, come ad esempio un genitore o un nonno, con almeno uno che avviene prima dei 50 anni.<ref name="chel"/> La diagnosi può essere fatta anche se vi sono almeno tre casi in famiglia senza dover considerare l'età.<ref name="chel">{{cite web |url=http://www.nostomachforcancer.org/gastric-cancer/hereditary-diffuse-gastric-cancer|title=Hereditary Diffuse Cancer|website= No Stomach for Cancer|accessdate=21 Oct 2014}}</ref> |
|||
Altri fattori associati ad un aumento del rischio sono l'[[AIDS]]<ref name="pmid24011243"/>, il [[diabete]]<ref name="pmid24587649">{{cite journal | author = Tseng C-H, Tseng F-H| title = Diabetes and gastric cancer: The potential links | journal = World J Gastroenterol| volume = 20 | issue = 7 | pages = 1701–11 | year = 2014 | pmid = 24587649 | pmc = 3930970 | doi = 10.3748/wjg.v20.i7.1701 | last2 = Tseng }}</ref>, l'[[anemia perniciosa]]<ref name="pmid24291271"/>, la [[gastrite cronica atrofica]]<ref name="pmid230756525">{{cite journal | author = Crosby DA, Donohoe CL, Fitzgerald L, Muldoon C, Hayes B, O’Toole D, Reynolds JV | title = Gastric Neuroendocrine Tumours | journal = Digestive Surgery | volume = 29 | issue = 4 | pages = 331–348 | year = 2004 | pmid = 23075625 | doi = 10.1159/000342988 | last2 = Donohoe | last3 = Fitzgerald | last4 = Muldoon | last5 = Hayes | last6 = O'Toole | last7 = Reynolds }}</ref>, la [[malattia di Ménétrier]]<ref name="pmid15227748">{{cite journal | author = Kim J, Cheong JH, Chen J, Hyung WJ, Choi SH, Noh SH| title = Menetrier's Disease in Korea: Report of Two Cases and Review of Cases in a Gastric Cancer Prevalent Region | journal = Yonsei Medical Journal | volume = 45 | issue = 3 | pages = 555–560 | year = 2004 | pmid = 15227748| url = http://www.eymj.org/Synapse/Data/PDFData/0069YMJ/ymj-45-555.pdf | last2 = Cheong | last3 = Chen | last4 = Hyung | last5 = Choi | last6 = Noh }}</ref>, l'[[ulcera peptica]] e la [[metaplasia intestinale]].<ref name="pmid16952033">{{cite journal | author = Tsukamoto T, Mizoshita T, Tatematsu M| title =Gastric-and-intestinal mixed-type intestinal metaplasia: aberrant expression of transcription factors and stem cell intestinalization| journal = Gastric cancer | volume = 9 | issue = 3 | pages = 156–166 | year = 2006 | pmid = 16952033 |
|||
| doi = 10.1007/s10120-006-0375-6| last2 =Mizoshita| last3 =Tatematsu}}</ref> |
|||
== Iodio nella mucosa gastrica == |
== Iodio nella mucosa gastrica == |
||
Versione delle 14:59, 13 dic 2014
| Tumore dello stomaco | |
|---|---|
 | |
| Specialità | oncologia e gastroenterologia |
| Classificazione e risorse esterne (EN) | |
| ICD-9-CM | 151.9 |
| ICD-10 | C16 |
| OMIM | 137215 |
| MedlinePlus | 000223 |
| eMedicine | 278744 |
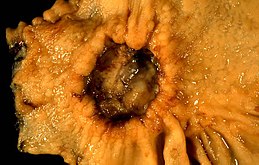
Il tumore dello stomaco è una neoplasia a carico di quest'organo dell'apparato digerente, tra i più colpiti da questa malattia. Le zone in cui questa si riscontra più frequentemente sono il piloro, la regione prepilorica e la piccola curva.
Epidemiologia
Prevalente nel sesso maschile, insorge dopo i 50 anni di età, più comune nei paesi asiatici e nelle classi socioeconomiche più basse.
Neoplasie benigne
I tumori benigni dello stomaco più comuni sono:
- i Polipi
- i Leiomiomi
- i Fibromi
- i Miofibromi
Neoplasie maligne
Tra le neoplasie maligne vi sono:
Forma del tutto particolare di neoplasia gastrica è il carcinoma precoce dello stomaco (Early gastric cancer).
Segni e sintomi
Il tumore dello stomaco, nelle sue fasi iniziali, appare spesso o asintomatico (cioè senza sintomi evidenti) o può causare solo sintomi aspecifici (sintomi che sono riconducibili non solo al tumore ma anche ad altri disturbi correlati o indipendenti). Con il trascorrere del tempo iniziano a manifestarsi alcuni sintomi e, a questo punto, il tumore spesso ha raggiunto uno stadio avanzato e può aver generato metastasi (diffusione in altre parti del corpo) e ciò rappresenta uno dei motivi della sua prognosi raramente positiva.[1]
Tumori allo stomaco precoci possono essere confusi con l'indigestione o con una sensazione di bruciore (pirosi). Tuttavia meno di 1 caso su 50 di endoscopie dovute ad indigestione presentano come referto un tumore.[2] Si può presentare intolleranza alla carne e scarsità di appetito.
Tumori gastrici che si sono espansi notevolmente e hanno invaso il tessuto normale possono causare debolezza, stanchezza, gonfiore di stomaco dopo i pasti, dolore addominale nella parte superiore, nausea e vomito occasionale, diarrea o costipazione. Una ulteriore espansione può causare una perdita di peso o sangue nel vomito o nelle feci, queste ultime appaiono con colorazione nera (melena) e talvolta ciò porta all'anemia. La presenza disfagia suggerisce un tumore nel cardias o l'estensione del tumore gastrico all'esofago.
Si noti che questi sintomi possono essere propri anche di altre patologie, come un'infezione virale allo stomaco, un' ulcera gastrica o sprue tropicale.
Tipologie

Le forme tumorali sono: adenocarcinoma nel 90% dei casi, linfoma primitivo nel 7%, sarcoma nell'1-3%.
Cause
Il tumore allo stomaco è una patologia multifattoriale.[3] L'infezione da Helicobacter pylori è un fattore di rischio riconosciuto nel 65%-80% dei casi, ma solo nel 2% di tali infezioni porta a sviluppare la neoplasia.[4][5] Il meccanismo con cui l'H. pylori induce il cancro allo stomaco coinvolge l'infiammazione cronica o l'azione dei fattori di virulenza, come il CagA.[6]
Il tabagismo aumenta significativamente il rischio di sviluppare il tumore allo stomaco: da un aumento del 40% per i fumatori correnti aumento a un 82% per i forti fumatori. I tumori gastrici causati dal fumo si verificano soprattutto nella parte superiore dello stomaco e nell'esofago distale.[7][8][9] Alcuni studi mostrano un aumento del rischio dovuto al consumo di alcol.[5][10]
Non è stato dimostrato che l'adozione di una particolare dieta possa essere una causa ma alcuni alimenti, tra cui cibi affumicati[11], cibi salati e ricchi di sale, carne rossa, carni lavorate e verdure sott'olio[5], sono stati correlati ad un rischio più elevato di incorrere in tale patologia. Nitrati e nitriti presenti nei salumi possono essere convertiti da alcuni batteri, tra cui l'H. pylori, in composti che sono stati dimostrati essere responsabili, negli animali, dell'insorgenza di un tumore allo stomaco. D'altra parte, la frutta fresca e la verdura, gli agrumi e l'assunzione di antiossidanti sono associati con una diminuzione del rischio di cancro.[5][7] Seguire una dieta mediterranea può portare un beneficio.[12]
Esiste una correlazione tra carenza di iodio e il tumore allo stomaco.[13][14][15][13]
L'incidenza di questa neoplasia mostra una predominanza maschile: fino al doppio rispetto al sesso femminile. Sembra che gli estrogeni possano svolgere un rullo protettivo.[16][17][18]
Circa il 10% dei casi mostra una componente genetica.[19]
Le persone possono avere alcuni fattori di rischio, fisici o genetici, che possono alterare la loro suscettibilità al tumore dello stomaco. L'obesità è uno di questi fattori di rischio fisico che aumenta la probabilità di sviluppare adenocarcinoma gastrico in seguito all'instaurarsi della malattia da reflusso gastroesofageo.[20] Il meccanismo esatto attraverso il quale l'obesità provoca il reflusso non è completamente noto. Gli studi ipotizzano che l'aumento dei grassi alimentari e del tessuto adiposo in eccesso, con conseguente aumento della pressione sullo stomaco e sullo sfintere esofageo inferiore, possa essere una spiegazione, ma vi sono (al 2014) ancore dati statisticamente significativi.[21] Tuttavia, il rischio di adenocarcinoma gastrico con presenza di reflusso gastroesofageo è stato riscontrato con una frequenza doppia nelle persone obese.[20]
Un difetto genetico del gene CDH1 è anch'esso un fattore di rischio. Questo gene, che codifica per le E-caderine, si trova sul cromosoma 16.[22] Quando va in corso ad una particolare mutazione si sviluppa il tumore allo stomaco attraverso un meccanismo che al 2014 non è stato ancora del tutto chiarito.[22] Questa mutazione è considerata autosomica dominante.[22] La diagnosi di ereditarietà al tumore allo stomaco solitamente avviene quando si riscontrano almeno due casi in membri della stessa famiglia, come ad esempio un genitore o un nonno, con almeno uno che avviene prima dei 50 anni.[22] La diagnosi può essere fatta anche se vi sono almeno tre casi in famiglia senza dover considerare l'età.[22]
Altri fattori associati ad un aumento del rischio sono l'AIDS[5], il diabete[23], l'anemia perniciosa[10], la gastrite cronica atrofica[24], la malattia di Ménétrier[25], l'ulcera peptica e la metaplasia intestinale.[26]
Iodio nella mucosa gastrica

Lo iodio pesa per il 65% del peso molecolare della tiroxina (T4) e per il 59% della triiodotironina (T3). 15–20 mg di iodio sono concentrati nella tiroide e nei relativi ormoni, mentre il 70% dello iodio presente nel corpo umano è distribuito in altri tessuti ed in particolare nella mucosa dello stomaco e nelle ghiandole salivari. Lo iodio entra direttamente nelle cellule di questi tessuti grazie ad un iodio-trasportatore (NIS).[27].
Alcuni ricercatori hanno trovato una correlazione epidemiologica e biochimica tra carenza di iodio, gozzo e cancro gastrico[28][29][30][31].
Una diminuzione dell'incidenza del tasso di mortalità da cancro allo stomaco dopo l'attuazione dei iodio-profilassi efficace è stata anche riportata da ricercatori in Polonia.[32]
Manifestazioni
- Anoressia
- Senso di ripienezza gastrica
- Disfagia
- Vomito
- Anemia sideropenica
- Calo ponderale
Localizzazioni
Le metastasi si sviluppano preferenzialmente a carico di fegato, linfoghiandole sovraclaveari sinistre, ovaio e peritoneo.
Diagnosi e stadiazione
Posta essenzialmente tramite endoscopia e biopsia. Per la stadiazione viene utilizzata la TAC.
Terapia
La terapia del cancro allo stomaco si basa quasi sempre su gastrectomia subtotale (rimozione chirurgica di parte dello stomaco) o totale (asportazione intero organo), accompagnata da rimozione dei linfonodi adiacenti.
Nella gastrectomia sub totale, il medico collega artificialmente la porzione di stomaco residua all'esofago o all'intestino tenue, mentre successivamente ad una gastrectomia totale connette direttamente l'esofago all'intestino tenue. La prognosi dopo l'operazione è influenzata dal livello di invasione che aveva il tumore (stadiazione linfonodale).
L'adenocarcinoma gastrico è relativamente radioresistente e richiede dosi troppo elevate per essere sopportate dai tessuti sani circostanti (es. midollo osseo). È ancora oggi in studio la reale efficacia di una chemioterapia pre-operatoria o post-operatoria.
Prognosi
La prognosi del cancro dello stomaco è spesso infausta per via delle frequenti metastasi riscontrabili al momento della scoperta e per la generale età avanzata di chi ne soffre (l'età media alla diagnosi è tra i 70 ei 75 anni).[33] Il tasso di sopravvivenza a 5 anni per il tumore dello stomaco è ritenuto essere inferiore al 10%.[34]
Note
- ^ Statistics and outlook for stomach cancer, su cancerresearchuk.org, Cancer Research UK. URL consultato il 19 February 2014.
- ^ Guidance on Commissioning Cancer Services Improving Outcomes in Upper Gastro-intestinal Cancers (PDF), su dh.gov.uk, NHS, Jan 2001.
- ^ Lee YY, Derakhshan MH, Environmental and lifestyle risk factors of gastric cancer, in Arch Iran Med., vol. 16, n. 6, Jun 2013, pp. 358–65.
- ^ Proceedings of the fourth Global Vaccine Research Forum (PDF), in Initiative for Vaccine Research team of the Department of Immunization, Vaccines and Biologicals, WHO, April 2004. URL consultato l'11 maggio 2009.«Epidemiology of Helicobacter pylori and gastric cancer…»
- ^ a b c d e González CA, Sala N, Rokkas T, Gastric cancer: epidemiologic aspects, in Helicobacter, vol. 18, Supplement 1, 2013, pp. 34–38, DOI:10.1111/hel.12082.
- ^ Hatakeyama, M. & Higashi, H, Helicobacter pylori CagA: a new paradigm for bacterial carcinogenesis, in Cancer Science, vol. 96, n. 12, 2005, pp. 835–843, DOI:10.1111/j.1349-7006.2005.00130.x.
- ^ a b What Are The Risk Factors For Stomach Cancer(Website), su cancer.org, American Cancer Society. URL consultato il 31 marzo 2010.
- ^ Nomura A, Grove JS, Stemmermann GN, Severson RK, Cigarette smoking and stomach cancer, in Cancer Research, vol. 50, n. 21, 1990, p. 7084.
- ^ Trédaniel J, Boffetta P, Buiatti E, Saracci R, Hirsch A, <565::AID-IJC3>3.0.CO;2-O Tobacco smoking and gastric cancer: Review and meta-analysis, in International Journal of Cancer, vol. 72, n. 4, August 1997, pp. 565–73, DOI:10.1002/(SICI)1097-0215(19970807)72:4<565::AID-IJC3>3.0.CO;2-O.
- ^ a b Thrumurthy SG, Chaudry MA, Hochhauser D, Ferrier K, Mughal M, The diagnosis and management of gastric cancer, in British Medical Journal, vol. 347, n. 16, 2013, pp. 1695–6, DOI:10.1136/bmj.f6367.
- ^ Jakszyn P, González CA, Nitrosamine and related food intake and gastric and oesophageal cancer risk: A systematic review of the epidemiological evidence (PDF), in World J Gastroenterol, vol. 12, n. 27, 2006, pp. 4296–4303.
- ^ Buckland G, Agudo A, Luján L, et al., Adherence to a Mediterranean diet and risk of gastric adenocarcinoma within the European Prospective Investigation into Cancer and Nutrition (EPIC) cohort study, in Am. J. Clin. Nutr., vol. 91, n. 2, February 2010, pp. 381–90, DOI:10.3945/ajcn.2009.28209.
- ^ a b S. Venturi, Donati, F.M.; Venturi, A.; Venturi, M.;, Role of iodine in evolution and carcinogenesis of thyroid, breast and stomach.= Adv Clin Path., vol. 4, n. 4, 2000, pp. 11-17, PMC 2452979, PMID 10936894. Errore nelle note: Tag
<ref>non valido; il nome "stod1" è stato definito più volte con contenuti diversi - ^ M. Josefssson, 22. Sodium Iodide Symporter (NIS) in Gastric Mucosa: Gastric Iodide Secretion, in Comprehensive Handbook of Iodine: Nutritional, Biochemical, Pathological and Therapeutic Aspects, Elsevier, 2009, pp. 215–220, ISBN 978-0-12-374135-6.
- ^ Venturi, Sebastiano, Evolutionary Significance of Iodine, in Current Chemical Biology-, vol. 5, n. 3, 2011, pp. 155–162, DOI:10.2174/187231311796765012.
- ^ Evangelos Chandanos, Estrogen in the development of esophageal and gastric adenocarcinoma (PDF), Karolinska Institutet, December 2007, ISBN 978-91-7357-370-2.
- ^ Chandanos E, Lagergren J. Oestrogen and the enigmatic male predominance of gastric cancer. Eur J Cancer. 2008 Nov;44(16):2397-403.
- ^ Qin J, Liu M, Ding Q, et al., The direct effect of estrogen on cell viability and apoptosis in human gastric cancer cells, in Mol. Cell. Biochem., vol. 395, n. 1-2, October 2014, pp. 99–107, DOI:10.1007/s11010-014-2115-2.
- ^ Lee H-J, Yang H-K, Ahn Y-O, Gastric cancer in Korea, in Gastric Cancer, vol. 5, n. 3, 2002, pp. 177–82, DOI:10.1007/s101200200031.
- ^ a b Crew K, Neugut A, Epidemiology of gastric cancer, in World Journal of Gastroenterology, vol. 12, n. 3, January 2006, pp. 354–62.
- ^ Hampel Howard, Abraham Neena S., and El-Serag Hashem B., Meta-Analysis: obesity and the risk for gastroesophageal reflux disease and its complications, in Annal of Internal Medicine, vol. 143, n. 3, August 2005, pp. 199–211.
- ^ a b c d e Hereditary Diffuse Cancer, su nostomachforcancer.org. URL consultato il 21 Oct 2014.
- ^ Tseng C-H, Tseng F-H, Diabetes and gastric cancer: The potential links, in World J Gastroenterol, vol. 20, n. 7, 2014, pp. 1701–11, DOI:10.3748/wjg.v20.i7.1701.
- ^ Crosby DA, Donohoe CL, Fitzgerald L, Muldoon C, Hayes B, O’Toole D, Reynolds JV, Gastric Neuroendocrine Tumours, in Digestive Surgery, vol. 29, n. 4, 2004, pp. 331–348, DOI:10.1159/000342988.
- ^ Kim J, Cheong JH, Chen J, Hyung WJ, Choi SH, Noh SH, Menetrier's Disease in Korea: Report of Two Cases and Review of Cases in a Gastric Cancer Prevalent Region (PDF), in Yonsei Medical Journal, vol. 45, n. 3, 2004, pp. 555–560.
- ^ Tsukamoto T, Mizoshita T, Tatematsu M, Gastric-and-intestinal mixed-type intestinal metaplasia: aberrant expression of transcription factors and stem cell intestinalization, in Gastric cancer, vol. 9, n. 3, 2006, pp. 156–166, DOI:10.1007/s10120-006-0375-6.
- ^ M. Paroder-Belenitsky, MJ. Maestas; O. Dohán; JP. Nicola; A. Reyna-Neyra; A. Follenzi; E. Dadachova; S. Eskandari; LM. Amzel; N. Carrasco, Mechanism of anion selectivity and stoichiometry of the Na+/I- symporter (NIS)., in Proc Natl Acad Sci U S A, vol. 108, n. 44, novembre 2011, pp. 17933-8, DOI:10.1073/pnas.1108278108, PMID 22011571.
- ^ M. Josefssson e E. Ekblad, 22. Sodium Iodide Symporter (NIS) in Gastric Mucosa: Gastric Iodide Secretion, in Victor R. Preedy, Gerard N. Burrow e Ronald Watson (a cura di), Comprehensive Handbook of Iodine: Nutritional, Biochemical, Pathological and Therapeutic Aspects, Elsevier, 2009, pp. 215–220, ISBN 978-0-12-374135-6.
- ^ Abnet CC, Fan JH, Kamangar F, Sun XD, Taylor PR, Ren JS, Mark SD, Zhao P, Fraumeni JF Jr, Qiao YL, Dawsey SM, Self-reported goiter is associated with a significantly increased risk of gastric noncardia adenocarcinoma in a large population-based Chinese cohort, in International Journal of Cancer, vol. 119, n. 6, 2006, pp. 1508–1510, DOI:10.1002/ijc.21993, PMID 16642482.
- ^ R. Behrouzian e N. Aghdami, Urinary iodine/creatinine ratio in patients with stomach cancer in Urmia, Islamic Republic of Iran, in East Mediterr Health J., vol. 10, n. 6, 2004, pp. 921–924, PMID 16335780.
- ^ Venturi, Sebastiano, Evolutionary Significance of Iodine, in Current Chemical Biology-, vol. 5, n. 3, 2011, pp. 155–162, DOI:10.2174/187231311796765012, ISSN 1872-3136.
- ^ Golkowski F, Szybinski Z, Rachtan J, Sokolowski A, Buziak-Bereza M, Trofimiuk M, Hubalewska-Dydejczyk A, Przybylik-Mazurek E, Huszno B., Iodine prophylaxis—the protective factor against stomach cancer in iodine deficient areas, in Eur J Nutr., vol. 46, n. 5, 2007, pp. 251–6, DOI:10.1007/s00394-007-0657-8, PMID 17497074.
- ^ Cabebe, EC; Mehta, VK; Fisher, G, Jr, Gastric Cancer, in Medscape Reference, WebMD, 21 January 2014. URL consultato il 4 April 2014.
- ^ M Orditura, Galizia, G; Sforza, V; Gambardella, V; Fabozzi, A; Laterza, MM; Andreozzi, F; Ventriglia, J; Savastano, B; Mabilia, A; Lieto, E; Ciardiello, F; De Vita, F, Treatment of gastric cancer. (PDF), in World Journal of Gastroenterology, vol. 20, n. 7, February 2014, pp. 1635–49, DOI:10.3748/wjg.v20.i7.1635.
Voci correlate
Altri progetti
 Wikimedia Commons contiene immagini o altri file su tumore dello stomaco
Wikimedia Commons contiene immagini o altri file su tumore dello stomaco