Iodio-131
| Iodio-131 | |
|---|---|
| Generalità | |
| Simbolo | 131I |
| Protoni | 53 |
| Neutroni | 78 |
| Peso atomico | 130,9061246 u |
| Abbondanza isotopica | tracce |
| Proprietà fisiche | |
| Emivita | 8,0197 giorni |
| Decadimento | β− |
Lo iodio-131 (131I), noto in medicina nucleare come radioiodio (anche se si conoscono molti altri isotopi radioattivi di questo elemento), è un radioisotopo importante dello iodio. La sua emivita di decadimento radioattivo è di circa 8 giorni. I suoi utilizzi sono principalmente nell'ambito medico e farmaceutico. Gioca un ruolo anche come un pericolo radioattivo tra i maggiori tra quelli presenti nei prodotti della fissione nucleare (scorie radioattive) e costituisce uno dei principali fattori di rischio per la salute risultante dalle esplosioni nucleari endo-atmosferiche negli anni cinquanta, oltre che dall'inquinamento atmosferico risultante dal disastro di Černobyl'. Questo perché lo iodio-131 è uno dei prodotti principali della fissione dell'uranio, del plutonio e indirettamente del torio, ammontando a circa il 3% del totale dei prodotti di fissione.
A causa della sua modalità di decadimento beta, lo iodio-131 è estremamente tossico in caso di contaminazione interna o cutanea andando a danneggiare le cellule che riesce a penetrare, la radiazione beta riesce a percorrere fino a qualche mm nel tessuto biologico. Inoltre seguendo il metabolismo dello Iodio, a seguito di contaminazione interna andrà a fissarsi nella tiroide. Per questa ragione, alte dosi di questo isotopo sono spesso paradossalmente meno pericolose rispetto a quelle basse, dal momento che tendono a uccidere i tessuti tiroidei che altrimenti andrebbero incontro a mutazione e successiva promozione cancerogena come risultato della radiazione. Dunque attualmente si impiega lo iodio-131 in dosi piene evitando le piccole dosi nell'uso medico e progressivamente viene usato soltanto in dosi terapeutiche alte e massimali come mezzo per uccidere i tessuti bersaglio. Questo è noto come "uso terapeutico".
Lo iodio-131 può essere "visto" dalle tecniche di visualizzazione della medicina nucleare (ad esempio la gamma camera) quando viene somministrato per uso terapeutico dal momento che circa il 10% della sua energia e radiazione viene emesso come raggi gamma. Comunque, dal momento che il 90% della radiazione (raggi beta) causa danno tissutale senza contribuire alla capacità di rilevare e visualizzare l'isotopo, si preferisce usare altri radioisotopi dello iodio meno tossici, quando si richiede soltanto l'imaging nucleare.
Altri radioisotopi dello iodio sono spesso creati con tecniche costose, ad esempio con l'irradiazione nel reattore nucleare di costose capsule di gas xeno pressurizzato.
Si pensa che dosi molto piccole di iodio-131 ricevute accidentalmente, molto inferiori a quelle usate nel trattamento medico, siano la maggiore cause dell'incremento dei tumori alla tiroide dopo contaminazione nucleare accidentale. Questi cancri avvengono per il danno residuale ai tessuti causato dalla radiazione emessa dall'isotopo non naturale iodio-131, e spesso appaiono anni dopo l'esposizione, molto dopo il decadimento quasi totale dello iodio-131.
Produzione dello iodio-131[modifica | modifica wikitesto]
La maggior parte della produzione dello iodio-131 avviene per attivazione neutronica, ossia per irraggiamento con neutroni di un bersaglio di tellurio naturale in un reattore nucleare. L'irradiazione del tellurio naturale produce quasi esclusivamente iodio-131 come unico radionuclide con una emivita maggiore di qualche ora, dal momento che altri e più leggeri isotopi del tellurio diventano isotopi stabili più pesanti, oppure iodio stabile o gas xeno. Comunque il nuclide più pesante del tellurio che si trova in natura, il tellurio-130 (34% del tellurio naturale) assorbe un neutrone ed emette un raggio beta per diventare tellurio-131, che decade con una emivita di 25 minuti per diventare iodio-131.
Un composto di tellurio può essere irradiato quando il tellurio è legato come un ossido a una colonna di scambio ionico, e in seguito lo iodio-131 (alogeno molto elettronegativo) che si forma viene diluito in una soluzione alcalina.[1] Più comunemente, il tellurio elementare in polvere viene irradiato e in seguito lo iodio-131 viene separato da esso per distillazione secca dello iodio, che ha una pressione di vapore molto inferiore. L'elemento viene dissolto in una soluzione lievemente alcalina nella maniera standard, per produrre iodio-131 come ioduro e ipoiodito (che presto viene ridotto a ioduro).[2]
Decadimento radioattivo[modifica | modifica wikitesto]
Lo iodio-131 (131I) decade con un'emivita di 8,02 giorni con emissione di particelle beta e di raggi gamma. Questo nuclide dell'atomo di iodio ha 78 neutroni nel nucleo, mentre il nuclide stabile iodio-127 (127I) ha 74 neutroni. Col decadimento, 131I si trasforma nello xeno-131 (131Xe):
13153I → β + 13154Xe
Le emissioni primarie del decadimento del 131I sono raggi gamma da 364 keV (81% d'abbondanza) e particelle beta con un'energia massima di 606 keV (89% d'abbondanza).[3]
Le particelle beta, a causa della loro elevata energia media (190 keV; 606 kev è il massimo, ma è rilevabile un tipico spettro di decadimento-beta) hanno una penetrazione nei tessuti da 0,6 mm a 2 mm.[4]
Lo iodio-131 è un prodotto di fissione con una resa del 2,878% dell'uranio-235,[5] e può essere rilasciato nelle esplosioni nucleari e negli incidenti nucleari. Nonostante tutto, la corta emivita implica che non si trova in quantità significative nel combustibile nucleare esaurito, a differenza dello iodio-129 che ha una emivita pari a miliardi di volte quella dello iodio-131.
Effetti dell'esposizione allo iodio-131[modifica | modifica wikitesto]
Lo iodio contenuto negli alimenti viene assorbito dal corpo e in seguito è concentrato preferenzialmente nella tiroide dove è indispensabile per il corretto funzionamento della ghiandola e per la produzione dell'ormone tiroxina. Quando lo 131I è presente in alti livelli nell'ambiente come risultato del fallout radioattivo, può essere assorbito attraverso il cibo contaminato, e si accumulerà nella tiroide. Mentre decade, può causare danno alla tiroide. Il principale rischio dell'esposizione a 131I è un'aumentata incidenza (probabilistica) di cancro alla tiroide radiogenico nel proseguimento della vita. Altri rischi sono la possibilità di tumefazioni non cancerose e di tiroidite.
Il rischio successivo di cancro alla tiroide sembra diminuire all'aumentare dell'età al tempo dell'esposizione alla contaminazione con 131I. La maggior parte delle stime di rischio sono basate su studi nei quali l'esposizione alle radiazioni si verificò per bambini o adolescenti. Quando vengono esposti gli adulti diventa difficile per gli epidemiologi rilevare una differenza statisticamente significativa nei tassi di malattia alla tiroide rispetto a quello di un gruppo di età simile non esposto al radioiodio.
Il rischio può essere mitigato assumendo supplementi allo iodio, incrementando la quantità totale di iodio nel corpo e dunque riducendo l'assorbimento e la ritenzione nei tessuti e abbassando così la proporzione relativa dello iodio radioattivo. Sfortunatamente questi supplementi non vennero distribuiti alla popolazione che viveva nei pressi della centrale nucleare di Černobyl' in Bielorussia e Ucraina,[6] anche se sono stati ampiamente distribuiti ai bambini in Polonia.
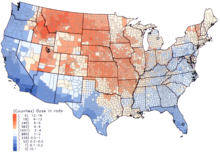
Negli Stati Uniti, le dosi di 131I (derivate dal fallout nucleare delle esplosioni nucleari nel Nevada) si verificarono durante gli anni cinquanta e i primi anni sessanta, e vennero assorbite da bambini che consumavano latte fresco e i suoi derivati, contaminati come risultato dei test atmosferici di armi nucleari.[7] Il National Cancer Institute nordamericano fornisce informazioni addizionali sugli effetti avversi alla salute risultanti dall'esposizione a 131I nel fallout,[8] come anche le stime di esposizione individualizzate, per quelli nati prima del 1971, per ognuna delle 3 070 contee negli Stati Uniti. I calcoli sono presi da dati riguardanti il fallout dai test di armi nucleari condotti nel Nevada Test Site.[9]
Terapia e prevenzione[modifica | modifica wikitesto]
Un comune metodo profilattico per la prevenzione dell'esposizione allo iodio-131 è quella di saturare la tiroide con l'isotopo di iodio più comune in natura, lo iodio-127 (non radioattivo), somministrandolo come ioduro (lo iodio elementare non può essere usato a questo scopo, dal momento che è tossico per ingestione in grosse quantità). Lo ioduro di potassio viene somministrato per la prevenzione dell'assorbimento del radioiodio da parte della tiroide, dopo un incidente nucleare: esso previene che la tiroide assorba lo iodio-131 radioattivo, e dunque evita l'avvelenamento radioattivo causato al corpo dal radioiodio.[10] Questo metodo terapeutico viene per la maggior parte eseguito somministrando ioduro di potassio alle persone a rischio. La dose per gli adulti è di 130 mg di ioduro di potassio al giorno, fornita in unica dose giornaliera, oppure divisa in due porzioni (65 mg due volte al giorno).
Utilizzi medici e farmaceutici[modifica | modifica wikitesto]
Viene utilizzato in medicina nucleare terapeuticamente e può essere visualizzato con scanner diagnostici quando viene somministrato come terapia. L'utilizzo dell'isotopo 131I come sale di ioduro sfrutta il meccanismo di assorbimento dello iodio grazie alle cellule normali della ghiandola tiroide. Esempi del suo utilizzo nella terapia radiante sono quelli dove si cerca la distruzione del tessuto dopo l'assorbimento dello iodio da parte del tessuto.
Gli utilizzi principali dell'isotopo 131I includono il trattamento della tireotossicosi (ipertiroidismo) e di alcuni tipi di cancro alla tiroide che assorbono iodio. L'isotopo 131I viene dunque usato come radioterapia tramite radioisotopi nella cura dell'ipertiroidismo provocato dalla sindrome di Graves, e a volte per trattare noduli tiroidei iperattivi (tessuto tiroideo che produce troppi ormoni, senza essere diventato un tumore maligno). L'utilizzo terapeutico del radioiodio per trattare l'ipertiroidismo nella malattia di Graves venne riferito per la prima volta da Saul Hertz nel 1941.
L'isotopo 131I viene usato anche come un'etichetta radioattiva per alcuni tipi di radiofarmaco che possono essere impiegati in terapia, per esempio la 131I-metaiodobenzylguanidine (131I-MIBG) per l'imaging e la terapia del feocromocitoma e del neuroblastoma. In tutti questi usi terapeutici, l'isotopo 131I distrugge i tessuti bersaglio per mezzo della radiazione beta (a corto raggio). Circa il 90% del danno radioattivo che esplica sui tessuti è dovuto alla radiazione beta, e il resto è causato dalla radiazione gamma (a distanze maggiori dal radioisotopo). Può essere visto nelle scansioni diagnostiche dopo il suo utilizzo come radioterapico, perché è anche un emettitore gamma.
A causa della carcinogenicità della radiazione beta sulla tiroide causata anche da piccole dosi, lo iodio-131 è raramente utilizzato primariamente o solamente per la diagnosi (anche se nel passato questo avveniva più comunemente a causa della relativa facilità di produzione di questo isotopo e al suo basso costo). Invece lo iodio-123 che è un emettitore di raggi gamma molto più puro è usato nei test diagnostici (scansione della tiroide nella medicina nucleare). Lo iodio-125 ha una emivita più lunga e viene occasionalmente usato quando è necessaria una emivita più lunga del radioiodio per la diagnosi, e nel trattamento brachiterapico (gli isotopi vengono confinati in piccole capsule di metallo simili a semi), mentre la radiazione gamma di bassa energia, senza una componente beta, rende utile l'impiego dello iodio-125. Gli altri radioisotopi dello iodio non vengono mai usati nella brachi-terapia.
A causa dell'utilizzo dello 131I come isotopo medico molte spedizioni di routine di biosolidi vengono bloccate e rimandate indietro alla frontiera tra Canada e Stati Uniti.[11] Spesso, in modo abusivo e delinquenziale, il materiale radioattivo nelle deiezioni umane viene scaricato direttamente da centri medici, oppure vengono espulsi (con gli escrementi o con l'urina) dai pazienti dopo un trattamento.
Isolamento post-terapeutico[modifica | modifica wikitesto]
I pazienti riceventi il trattamento con l'isotopo iodio-131 vengono avvertiti di evitare rapporti sessuali per un mese (oppure per meno tempo, dipendendo dalla dose somministrata) e alle donne viene detto di evitare ogni gravidanza per i sei mesi successivi. «Questo è dovuto a rischi teorici di sviluppare danni di ogni genere al feto (da aborto spontaneo a malformazione), anche se la quantità di radioattività può essere piccola e non esiste finora un'evidente prova medica di rischi attuali dovuti alla terapia con radioiodio. Questa precauzione dovrebbe eliminare essenzialmente l'esposizione diretta alla radioattività e soprattutto riduce la possibilità di concepimento con sperma che può teoricamente essere stato danneggiato dall'esposizione al radioiodio.»[12] Queste linee guida variano da ospedale a ospedale e dipenderanno anche dalla dose di radiazione somministrata. Alcuni consigliano di non abbracciare o di tenere in braccio bambini quando la radiazione è ancora alta, e si raccomanda di tenere una distanza da uno a due metri.[13]
Lo iodio-131 sarà a mano a mano eliminato dal corpo anche per via del suo decadimento radioattivo. Durante il corso del suo decadimento, piccole quantità vengono eliminate attraverso il sudore e la rimozione dei rifiuti (urinazione). Per questa ragione potrebbe essere consigliabile di pulire toilette, lavelli, lenzuola dei letti con regolarità e vestiti usati dalla persona che ha ricevuto il trattamento. Questo dovrebbe aiutare a minimizzare l'esposizione accidentale causata a membri della famiglia, specialmente bambini. L'utilizzo di sostanze decontaminanti specialmente destinate allo iodio radioattivo può essere consigliato. Due prodotti comuni usati da alcune istituzioni sono il "Bind-It Decontaminant" (Laboratory Technologies, Inc.) e "I-Bind". Bisogna evitare i prodotti di decontaminazione radioattiva generici dal momento che questi possono essere sparsi o venire volatilizzati.
Attualmente molti aeroporti hanno sensori di radiazioni per poter rilevare il contrabbando di materiali radioattivi (impiegabili ad esempio nel terrorismo nucleare e nella fabbricazione della bomba sporca). I pazienti devono essere avvertiti che se scelgono di viaggiare per via aerea, potrebbero attivare i sensori di radiazione anche fino a 95 giorni dopo la terapia con 131I.[14]
Note[modifica | modifica wikitesto]
- ^ Sankha Chattopadhyay e Sujata Saha Das, Recovery of 131I from alkaline solution of n-irradiated tellurium target using a tiny Dowex-1 column, in Applied Radiation and Isotopes, vol. 68, n. 10, 2010, p. 1967, DOI:10.1016/j.apradiso.2010.04.033, PMID 20471848.
- ^ I-131 Fact Sheet (PDF), su impavidus.me. URL consultato il 27 dicembre 2021 (archiviato dall'url originale il 27 dicembre 2021). vedere questa pagina per le moderne tecniche di produzione del I-131
- ^ Nuclide Safety Data Sheet (PDF), su hpschapters.org. URL consultato il 26 ottobre 2010.
- ^ Mario Skugor, Thyroid Disorders (A Clevland Clinic Guide), Cleveland Clinic Press, 2006, p. 82, ISBN 978-1-59624-021-6.
- ^ Nuclear Data for Safeguards, Table C-3, Cumulative Fission Yields, su www-nds.iaea.org, International Atomic Energy Agency. URL consultato il 14 marzo 2011. (thermal neutron fission)
- ^ (EN) ecolo.org (DOC).
- ^ Steven Simon, André Bouville e Charles Land, Fallout from Nuclear Weapons Tests and Cancer Risks, in American Scientist, vol. 94, 2006, p. 48, DOI:10.1511/2006.1.48.
- ^ Radioactive I-131 from Fallout, su cancer.gov, National Cancer Institute. URL consultato il 14 novembre 2007.
- ^ Individual Dose and Risk Calculator for Nevada Test Site fallout, su ntsi131.nci.nih.gov, National Cancer Institute, 10/01/07. URL consultato il 14 novembre 2007 (archiviato dall'url originale il 18 ottobre 2007).
- ^ OMS - Iodoprofilassi e emergenze nucleari e radiologiche
- ^ Medical isotopes the likely cause of radiation in Ottawa waste, su cbc.ca, CBCnews, 04/02/09. URL consultato il 9 febbraio 2009.
- ^ Radioiodine Therapy: Information for Patients (PDF), su kumc.edu, AACE, 2004 (archiviato dall'url originale il 10 settembre 2008).
- ^ Instructions for Receiving Radioactive Iodine Therapy after a Thyroid Cancer Survey, su uwmedicine.washington.edu, University of Washington Medical Center. URL consultato il 12 aprile 2009 (archiviato dall'url originale il 28 febbraio 2009).
- ^ Jane Sutton, Radioactive patients, reuters, 29 gennaio 2007. URL consultato il 15 maggio 2009.
Voci correlate[modifica | modifica wikitesto]
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) ANL factsheet (PDF), su ead.anl.gov. URL consultato il 20 marzo 2011 (archiviato dall'url originale il 14 giugno 2003).
- (EN) Patient brochure on radioactive iodine treatment (PDF), su thyroid.org, American Thyroid Association. URL consultato il 20 marzo 2011 (archiviato dall'url originale il 25 febbraio 2009).
- (EN) The radiology information resource for patients: Radioiodine (I-131) Therapy, su radiologyinfo.org, RadiologyInfo.
- (EN) Case Studies in Environmental Medicine: Radiation Exposure from Iodine 131, su atsdr.cdc.gov.
- (EN) Sensitivity of Personal Homeland Security Radiation Detectors to Medical Radionuclides and Implications for Counseling of Nuclear Medicine Patients, su rsna2004.rsna.org (archiviato dall'url originale il 23 dicembre 2005).
- (EN) Iodine, Radioactive, su toxnet.nlm.nih.gov, NLM Hazardous Substances Databank.