Cloruro di ossalile
| Cloruro di ossalile | |
|---|---|
 | |
 | |
| Caratteristiche generali | |
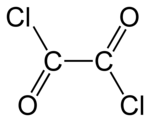
| Formula bruta o molecolare | C2O2Cl2 |
| Massa molecolare (u) | 126,92 |
| Aspetto | liquido incolore, odore penetrante |
| Numero CAS | |
| Numero EINECS | 201-200-2 |
| PubChem | 65578 |
| SMILES | C(=O)(C(=O)Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1.4785 |
| Indice di rifrazione | 1,429 |
| Solubilità in acqua | Reagisce |
| Temperatura di fusione | −16 °C (257 K) |
| Temperatura di ebollizione | 63-64 °C (336-337 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| Frasi H | 314 - 331 - 335 [1] |
| Consigli P | 261 - 280 - 305+351+338 - 310 [1] |
Il cloruro di ossalile è un composto chimico appartenente alla famiglia degli alogenuri acilici, rappresentato dalla formula (COCl)2. È incolore ed è caratterizzato da un odore pungente. È utilizzato come reagente nella sintesi organica.[2] Può essere preparato attraverso il trattamento di acido ossalico con pentacloruro di fosforo.[3] Calcoli quantomeccanici e indagini sperimentali indicano che il cloruro di ossalile in fase gassosa è presente essenzialmente nella conformazione anti, mentre la geometria cis è uno stato di transizione[4].
Reattività[modifica | modifica wikitesto]
Il cloruro di ossalile reagisce con l'acqua producendo solo prodotti gassosi: cloruro di idrogeno (acido cloridrico), anidride carbonica e monossido di carbonio.
- (COCl)2 + H2O → 2 HCl + CO2 + CO
Questo comportamento differisce da quello degli altri cloruri acilici che per idrolisi producono cloruro di idrogeno e il rispettivo acido carbossilico.
Applicazioni nelle sintesi organiche[modifica | modifica wikitesto]
Sintesi di cloruri acilici[modifica | modifica wikitesto]
Questa sintesi è utilizzata principalmente nella sintesi organica per la preparazione di cloruri acilici a partire dai corrispondenti acidi carbossili utilizzando come catalizzatore la dimetilformammide . Come per il cloruro di tionile, SOCl2, la reazione è favorita dalla produzione di composti che, a pressione e temperatura normali, sono in stato gassoso:
Paragonato al cloruro di tionile, il cloruro di ossalile tende ad essere un reattivo meno energico e meno selettivo. Essendo anche più costoso del cloruro di tionile viene utilizzato su scala ridotta.
La reazione comporta la conversione del DMF in un immidoil cloruro, analogamente al primo stadio della reazione di Vilsmeier-Haack. L'immidoil cloruro è il vero agente clorurante.
Formilazione di areni[modifica | modifica wikitesto]
Il cloruro di ossalile reagisce con i composti aromatici in presenza di cloruro di alluminio per produrre il corrispondente cloruro di acile attraverso la acilazione di Friedel-Crafts. L'acido ottenuto più essere idrolizzato in acqua per formare il corrispondente acido carbossilico.
Preparazione di diesteri dell'ossalato[modifica | modifica wikitesto]
Il cloruro di ossalile può reagire con alcoli per dare un estere:
- 2 RCH2OH + (COCl)2 → RCH2OC(O)C(O)OCH2R + 2 HCl
Solitamente la reazione viene condotta in presenza di una base come per esempio la piridina. Il diestere che si ottiene dal fenolo è chiamato difenil ossalato ed è l'elemento attivo del Lightstick.
Ossidazione degli alcoli[modifica | modifica wikitesto]
Il trattamento con una soluzione di DMSO e cloruro di ossalile seguito da trattamento con trietilammina, converte gli alcoli nei corrispondenti aldeidi e chetoni, attraverso il processo conosciuto come Ossidazione di Swern.
Precauzioni[modifica | modifica wikitesto]
Come tutti gli alogenuri acilici, il cloruro di ossalile reagisce con l'acqua liberando HCl. I suoi effetti sono comparabili a quelli del fosgene.
Nel marzo 2000, Airbus A330 della Malaysia Airlines fu irreparabilmente danneggiato dopo una falsa dichiarazione del carico: nella stiva era stato caricato del cloruro di ossalile.[5]
Altre reazioni[modifica | modifica wikitesto]
Nella prima sintesi del diossan tetrachetone è stato riportato l'utilizzo di ossalil cloruro.
Note[modifica | modifica wikitesto]
- ^ a b Sigma-Aldrich, Oxalyl chloride, su sigmaaldrich.com. URL consultato il 6 ottobre 2018.
- ^ Salmon, R. "Oxalyl Chloride" in Encyclopedia of Reagents for Organic Synthesis 2001, John Wiley & Sons, New York, DOI: 10.1002/047084289X.ro015.
- ^ Vogel, A.; Steffan, G.; Mannes, K.; Trescher, V. "Oxalyl chloride" DE 78-2840435 19780916.Chemical Abstracts Number 93:94818
- ^ Donald D. Danielson, Lise Hedberg e Kenneth Hedberg, Conformational Analysis. 21. The Torsional Problem in Oxalyl Chloride. An ab Initio and Electron Diffraction Investigation of the Structures of the Conformers and Their Energy and Entropy Differences, in The Journal of Physical Chemistry, vol. 99, n. 23, 1º giugno 1995, pp. 9374-9379, DOI:10.1021/j100023a012. URL consultato il 3 novembre 2015.
- ^ Firm told to pay $65 mln for ruining plane, Reuters, 6 dicembre 2007. URL consultato il 6 dicembre 2007.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Cloruro di ossalile
Wikimedia Commons contiene immagini o altri file su Cloruro di ossalile
| Controllo di autorità | GND (DE) 4413482-4 |
|---|