Utente:Grasso Luigi/sanbox1/Epossidi
Un epossido, detto anche ossirano, è un etere ciclico in cui l'ossigeno è uno degli atomi di un anello a tre termini. Il gruppo funzionale è del tipo R1R2C(O)CR3R4 con gli R radicali alchilici o arenici. Vengono classificati come eteri, ma a differenza di essi presentano una reattività del tutto eccezionale e delle sintesi differenti. In generale, gli epossidi a basso peso molecolare sono incolori e non polari e spesso volatili. [1]
La reattività degli epossidi è causata dalla tensione angolare dell'anello a tre termini. Infatti l'ibridizzazione sp3 presuppone angoli di legame di 109°, contro i 60° formati dagli epossidi. Questo porta ad una facile apertura dell'anello.
Nomenclatura[modifica | modifica wikitesto]
Il più comune fra questi composti è detto comunemente ossido di etilene (IUPAC: 1,2-epossietano. IUPAC PREFERITO: ossirano).
Abbiamo almeno tre metodi per nominarli:
- La nomenclatura IUPAC (n,n+1-epossi ... -ano)
- in questo sistema l'atomo di ossigeno è considerato un sostituente col nome epossi-, preceduto dalla posizione degli atomi di carbonio sopra cui si trova nel ramo principale (C-1,C-2,...C-n,C-(n+1),...C-t) e seguito dal nome dell'alcano base o dai suoi isomeri.
- La nomenclatura IUPAC preferita (2 ... -il 3 ... -il ossirano; 2,2 ... -il ossirano)
- questo metodo tiene conto del nome ossirano preceduto dai numeri posizione atomi del gruppo (O-1,C-2,C-3) e dei radicali alchilici presenti.
- La nomenclatura comune (ossido di ... -ene)
- viene derivata dell'ossido di etilene, che è l'epossido base, e tiene conto dell'alchene di partenza seguito da ossido o preceduto da ossido di.
Ecco i primi eteri ciclici derivati dagli alcani che comprendono gli epossidi più semplici:
| Formula | Nome IUPAC | Preferito IUPAC | Nome comune | Stato IUPAC | Struttura 2D |
|---|---|---|---|---|---|
| CH2(O)CH2 | 1,2-epossietano | ossirano | ossido di etilene |  | |
| CH3CH(O)CH2 | 1,2-epossipropano | metilossirano | ossido di propilene |  | |
| CH3CH(O)CH2 | 1,3-epossipropano | ossoetano | ossido di trimetilene |  | |
| CH2(O)CHCH2CH3 | 1,2-epossibutano | etilossirano | ossido di etil-etilene |  | |
| CH3CH(O)CHCH3 | 2,3-epossibutano | 2,3-dimetilossirano | ossido di 2,3-butilene |  | |
| C2H6C(O)CH2 | 1,2-epossi 2-metilpropano | 2,2-dimetilossirano | ossido di isobutilene |  | |
| C2H6C(O)CH2 | 1,3-epossisobutano | 3-metilossetano | ossido di 1,3-isobutilene |  | |
| C2H6C(O)CH2 | 1,3-epossibutano | 2-metilossetano | ossido di 1,3-butilene |  | |
| C2H6C(O)CH2 | 1,4-epossibutano | ossolano | ossido di 1,4-butilene |  |
Le righe colorate in azzurro indicano l'alcano, mentre quelle in bianco gli isomeri di struttura derivati.
Se l'epossido fa parte di un altro sistema ciclico si utilizza sempre il prefisso epossi-. Facciamo qualche esempio:
-
Diepossi-butano
-
1,2-epossi-1-metilciclobutano
-
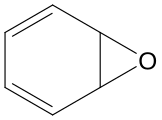
5,6-Epossi-cicloesa-1,3-diene
-
(3R)-4,6-difenil-5,6-epossi-es-1-en-3-olo
Sintesi[modifica | modifica wikitesto]
Gli epossidi dominanti nell'industrua sono l'ossido di etilene e l'ossido di propilene, le produzioni sono rispettivamente circa 15 e 3 milioni tonnelate/anno. [2]
- Ossidazione catalitica di alcheni:
CH2=CH2 + ½ O2 CH2-O-CH2
- Epossidazione di alcheni:
Si utilizzano acidi perossicarbossilici, ovvero acidi carbossilici di formula -COOOH anziché -COOH. È il metodo di maggior impiego nelle sintesi fatte in laboratorio. Il reagente più comunemente impiegato è l'acido meta-cloroperossibenzoico.
R-CH=CH2 R-CH--CH2
\ /
O
L'epossidazione di Sharpless permette di formare un epossido con alta enantioselettività partendo da un alcool allilico.
- Sostituzione nucleofila interna delle aloidrine:
X
|
R-CH-CH2 + NaOH → R-CH--CH2 + NaX + H2O
| \ /
OH O
In questa reazione X può essere un atomo di cloro o un atomo di bromo; in alternativa ad NaOH è anche possibile utilizzare K2CO3
- Sintesi dell'ossido di etilene:
2CH2=CH2 + O2 2 CH2-CH2
\ /
O
Questa sintesi non funziona con altri alcheni, però è l'unica ad essere stata portata su scala industriale.
- Sintesi di Corey-Chaykovsky:
Reazioni di ilidi dello zolfo con composti carbonilici.
Reazioni[modifica | modifica wikitesto]
- Addizione di acqua, formazione di glicoli
H2C-CH2 + H2O--> H+--> HO-CH2-CH2-OH \ / O
(glicole etilenico)
- Addizione di un gruppo amminico primario
H2C-CH2 + NH3 --> HO-CH2-CH2-NH2 \ / O
- Apertura dell'anello per reazione con nucleofili:
R-CH-CH2 + CH3O-Na+ --> R-CH-CH2-OCH3
\ / |
O O-Na+
Si tratta, più precisamente, di una reazione di sostituzione nucleofila 2 interna alla molecola.
- Apertura dell'anello mediante catalisi acida:
H+ CH2-CH2 + H2O --> HO-CH2-CH2-OH \ / O
Il prodotto dell'apertura dell'anello mediante catalisi acida per l'ossido di etilene è il glicole etilenico, prodotto interessante per utilizzi di vario genere.
- Riduzione:
R R
| |
R'-C-CH2 + LiAlH4 --> R'-C-CH3
\ / |
O OH
La riduzione di un epossido con tetraidroalluminato di litio o idruro di alluminio produce l'alcool corrispondente.[3] Questo processo di riduzione risulta dall'aggiunta nucleofila dell'idruro (H−).
- Reazione con i reattivi di Grignard:
H3O+ CH2-CH2 + R-Mg-X --> R-CH2-CH2-O-MgX+ ---> R-CH2-CH2-OH \ / O
Altre reazioni[modifica | modifica wikitesto]
- La scissione riduttiva degli epossidi produce β-litioalcossidi.[4]
- La riduzione con esacloruro di tungsteno e n-butillitio produce l'alcheno [5]
- Gli epossidi subiscono reazioni di espansione dell'anello, che consistono nell'inserimento di anidride carbonica per dare i carbonati ciclici.
- Quando trattati con tiourea, gli epossidi si convertono a episolfuri, e vengono detti tiirani.
Applicazioni[modifica | modifica wikitesto]
 |
 |
 |
 |
 |
 |
L'ossido di etilene viene utilizzato per produrre detergenti e tensioattivi tramite etossilazione. La sua idrolisi forma il glicol etilene. Viene anche utilizzato per la sterilizzazione di strumenti medici e materiali.
La reazione degli epossidi con ammine sta alla base per formare le resine epossidiche come colle e materiali strutturali. Una tipica ammina-indurente è la trietilenetetramina (TETA).
Sicurezza[modifica | modifica wikitesto]
Gli epossidi sono agenti alchilanti, rendendone molti altamente tossici.[6]
Voci correlate[modifica | modifica wikitesto]
Note[modifica | modifica wikitesto]
- ^ (EN) Guenter Sienel; Robert Rieth; Kenneth T. Rowbottom, Epoxides, in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, 2000, DOI:10.1002/14356007.a09_531.
- ^ (EN) Siegfried Rebsdat;Dieter Mayer, Ethylene Oxide, in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, 2005, DOI:10.1002/14356007.a10_117.
- ^ (EN) Bruce Rickborn; Wallace E. Lamke, Reduction of epoxides. II. The lithium aluminum hydride and mixed hydride reduction of 3-methylcyclohexene oxide, in J. Org. Chem., vol. 32, n. 3, 1967, pp. 537-539, DOI:10.1021/jo01278a005.
- ^ (EN) B. Mudryk; T. Cohen, 1,3-Diols From Lithium Β-lithioalkoxides Generated By The Reductive Lithiation Of Epoxides: 2,5-dimethyl-2,4-hexanediol, in Org. Synth., vol. 72, 1995, pp. 173, DOI:10.15227/orgsyn.072.0173.
- ^ (EN) K. Barry Sharpless, Martha A. Umbreit, Marjorie T. Nieh, Thomas C. Flood, Lower valent tungsten halides. New class of reagents for deoxygenation of organic molecules, in J. Am. Chem. Soc., vol. 94, n. 18, 1972, pp. 6538–6540, DOI:10.1021/ja00773a045.
- ^ (EN) Christian Niederer; Renata Behra; Angela Harder; René P. Schwarzenbach; Beate I. Escher, Mechanistic approaches for evaluating the toxicity of reactive organochlorines and epoxides in green algae, in Environ. Toxicol. Chem., vol. 23, n. 3, 2004, pp. 697–704, DOI:10.1897/03-83, PMID 15285364.
Altri progetti[modifica | modifica wikitesto]
 Wikizionario contiene il lemma di dizionario «epossido»
Wikizionario contiene il lemma di dizionario «epossido»