Tionamidi
Le tionammidi (o tioammidi) sono una classe di composti organici solforati di struttura analoga alle ammidi, ma con il carbonile (>C=O) rimpiazzato dal tiocarbonile (>C=S)[1] e hanno quindi formula di struttura generale R1−C(=S)−NR2R3, dove R1, R2 e R3 sono atomi di idrogeno oppure alchili o arili, eventualmente a loro volta sostituiti. La presenza del gruppo amminico, tramite la coppia solitaria su N, entra in risonanza con quello tiocarbonilico stabilizzandolo e infatti le tionammidi sono composti generalmente stabili, a differenza di tioaldeidi e tiochetoni, soggetti a facile oligomerizzazione o polimerizzazione, ma anche in parte degli esteri degli acidi tioncarbossilici [RC(=S)OR'].[2][3]
Le tionammidi sono per molti versi simili alle ammidi ma mostrano un maggior carattere di legame multiplo nell legame C–N, il che comporta una barriera più alta per la rotazione attorno ad esso del gruppo amminico −NR2R3.[4] La più semplice tionammide è la tioformammide [H−C(=S)−NH2], sebbene non sia un composto sufficientemente ben caratterizzato.[5] Una tra le più note tionammidi è la tioacetammide, CH3−C(=S)−NH2, che viene usata principalmente come sorgente di ioni solfuro[6] e come prodotto di partenza per la sintesi di eterocicli solforati, in particolare tiazoli.[7] Dal punto di vista farmacologico le tionammidi e le affini tiouree inibiscono la funzione tiroidea.
Fa parte di questo gruppo anche l'erbicida clortiamide (2,6-Diclorotiobenzammide, C7H5Cl2NS).[8]
Struttura e proprietà[modifica | modifica wikitesto]
Le tionammidi, salvo per la eventuale presenza di sostituenti particolarmente ingombranti, sono molecole generalmente planari,[9] perché è planare il suo gruppo funzionale −C(=S)−N<. Le tionammidi, come anche le ammidi, sono ibridi di risonanza tra due forme limite:
- R−C(=S)−NR2 ↔ R−C(−S−)=+NR2
dove la seconda forma, che ha una separazione di carica di tipo sfavorevole (S è meno elettronegativo di N), dovrebbe avere meno peso nell'ibrido[10] ma, in ogni caso, la sua presenza comporta un certo carattere di doppio legame tra C e N.
Inoltre, le tionammidi con il gruppo -NH2 o -NHR in soluzione vanno soggette a un equilibrio di tautomeria prototropica, equilibrio che non è sostanzialmente diverso da quello della tautomeria cheto-enolica:
- R−C(=S)−NH2 (tionammide) ⇄ R−C(−SH)=NH (tiolimmide)
In fase gassosa la forma tionica è largamente prevalente su quella tiolica, la differenza di energia tra i tautomeri è grande, dell'ordine delle 10 kcal/mol (~40 kJ/mol).[11][12]In soluzione, almeno per le tioammidi più semplici si trova che l'equilibrio è fortemente spostato a sinistra, nonostante che un legame C=S, per la difficoltà degli atomi della terza riga a formare legami π, sia più debole di un legame C=N. Tuttavia, questo equilibrio è stato indagato e in effetti per la tioacetammide si è trovato che la costante K vale 10−8,6±0,2.[13]
Sintesi chimica[modifica | modifica wikitesto]
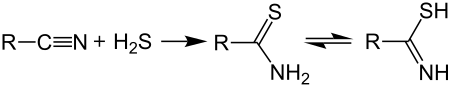
Il metodo più comune per la sintesi delle tionammidi si basa sulla reazione di un nitrile con idrogeno solforato sotto pressione:[14]
In presenza di trietilammina, la sintesi procede bene anche senza alzare molto la pressione. Tuttavia, questo metodo può essere utilizzato solo per ottenere tioammidi che hanno il gruppo -NH2 non sostituito. Per sintetizzare tioammidi N-sostituite, o N,N-disostituite, si parte dalle corrispondenti ammidi facendole reagire con il reagente di Lawesson[15] o il pentasolfuro di fosforo[16][17][18] in un solvente inerte, i quali reagenti effettuano la conversione del carbonile in tiocarbonile:
Usi medici[modifica | modifica wikitesto]
Diverse tionammidi e tiouree variamente sostituite sono una classe di farmaci usati per controllare la tireotossicosi. Alcune di esse sono il Mercaptometilimidazolo commercialmente tapazole, il carbimazolo commercialmente neomercazole, la tiourea e il propiltiouracile o propicyl. Vengono usati nei casi di ipertiroidismo in farmacologia umana e veterinaria.[19][20][21]
Sono molecole che inibiscono l'enzima Tiroide perossidasi nella tiroide, riducendo la sintesi di triiodotironina (T3) e tiroxina (T4), bloccando così l'assorbimento di iodotirosine dalla colloide. Bloccano anche il rilascio di iodio dall'ormone periferico. Gli effetti massimi si verificano solo dopo un mese, poiché l'esaurimento dell'ormone è causato dalla ridotta sintesi, cosa che è un processo lento.
Poiché le tioammidi possono penetrare nella barriera placentare, si consiglia cautela quando vengono utilizzate durante la gravidanza. Il 10% dei pazienti riporta eruzioni cutanee (come macule e papule), orticaria, dermatite, febbre e artralgia. Lo 0,03% di tutti i pazienti sviluppa agranulocitosi, anemia aplastica rari ma gravi effetti avversi.[22]
Hanno utilizzo in medicina umana: il metimazolo, carbimazolo (convertito in vivo in metimazolo) e propiltiouracile.
Effetti collaterali[modifica | modifica wikitesto]
Le tionamidi hanno effetti collaterali comuni, per la loro azione extratiroidea, quando usate per il trattamento delle tireotossicosi, quali:[21]
- Agranulocitosi
- Anemia aplastica
- Anosmia
- Colestasi
- Disgeusia
- Disosmia
- Epatopatie
- Gastrite
- Porpora
- ulcere gastriche
Inoltre, inibiscono la lattoperossidasi enzima antibatterico delle mucose.
Note[modifica | modifica wikitesto]
- ^ tiocarbonile in Vocabolario - Treccani, su treccani.it. URL consultato il 13 agosto 2023.
- ^ (EN) Patrick Metzner, Thiocarbonyl Compounds as Specific Tools for Organic Synthesis, collana Topics in Current Chemistry, Springer, 1999, pp. 127–181, DOI:10.1007/3-540-48956-8_2, ISBN 978-3-540-48956-6. URL consultato il 23 agosto 2023.
- ^ (EN) E. Campaigne, Thioketones, John Wiley & Sons, Ltd., 1º gennaio 1966, pp. 917–959, DOI:10.1002/9780470771051.ch17, ISBN 978-0-470-77105-1. URL consultato il 23 agosto 2023.
- ^ Kenneth B. Wiberg e Paul R. Rablen, Why Does Thioformamide Have a Larger Rotational Barrier Than Formamide?, in J. Am. Chem. Soc., vol. 117, n. 8, 1995, pp. 2201–2209, DOI:10.1021/ja00113a009.
- ^ (EN) Bastian Bernhardt, Friedemann Dressler e André K. Eckhardt, Characterization of the Simplest Thiolimine: The Higher Energy Tautomer of Thioformamide, in Chemistry – A European Journal, vol. 27, n. 22, 16 aprile 2021, pp. 6732–6739, DOI:10.1002/chem.202005188. URL consultato il 23 agosto 2023.
- ^ G. Gioia Lobbia e G. Novara, ANALISI QUALITATIVA E COMPLEMENTI DI CHIMICA, Bulgarini, 1988, pp. 444-447.
- ^ (EN) Peter Wipf e Srikanth Venkatraman, A New Thiazole Synthesis by Cyclocondensation of Thioamides and Alkynyl(Aryl)Iodonium Reagents, in The Journal of Organic Chemistry, vol. 61, n. 23, 15 novembre 1996, pp. 8004–8005, DOI:10.1021/jo961681c. URL consultato il 21 agosto 2023.
- ^ (EN) PubChem, Chlorthiamid, su pubchem.ncbi.nlm.nih.gov. URL consultato il 23 agosto 2023.
- ^ (EN) Jürgen Voss e Dirk Buddensiek, Sterically crowded thioamides: deviations from planarity as determined by X-ray structure analyses and quantum chemical calculations, in Structural Chemistry, 25 maggio 2023, DOI:10.1007/s11224-023-02189-x. URL consultato il 23 agosto 2023.
- ^ J. B. Hendrickson, D. J. Cram e G. S. Hammond, CHIMICA ORGANICA, traduzione di A. Fava, 2ª ed., Piccin, 1973, pp. 156-157.
- ^ Leszek Lapinski, Hanna Rostkowska e Artem Khvorostov, UV induced proton transfer in thioacetamide: first observation of thiol form of simple thioamide, in Physical Chemistry Chemical Physics, vol. 5, n. 8, 31 marzo 2003, pp. 1524–1529, DOI:10.1039/b300793f. URL consultato il 21 agosto 2023.
- ^ (EN) Stefan Dapprich e Gernot Frenking, The keto/enol tautomerism of selenoformamide and telluroformamide, in Chemical Physics Letters, vol. 205, n. 2-3, 1993-04, pp. 337–342, DOI:10.1016/0009-2614(93)89252-D. URL consultato il 23 agosto 2023.
- ^ G. Kjellin e J. Sandström, The Thione-Thiol Tautomerism in Simple Thioamides, in Acta Chemica Scandinavica, vol. 27, 1973, pp. 209-217, DOI:10.3891/acta.chem.scand.27-0209.
- ^ Alfons Schöberl und Annemarie Wagner in Houben-Weyl Methoden der Organischen Chemie, herausgegeben von Eugen Müller, Otto Bayer, Hans Meerweis und Karl Ziegler, Band 9, Schwefel-, Selen und Tellur-Verbindungen, Thieme Verlag, Stuttgart, 1955, dort S. 762–771.
- ^ R. Shabana, S. Scheibye, K. Clausen, S.O. Olesen e S.-O. Lawesson, Studies on organophosphorus compounds XXXI. Synthesis of thiolactams and thioimides, in Nouveau Journal de Chimie, vol. 1980, n. 4, 1980, pp. 47.
- ^ (EN) Organic chemistry, in Journal of the Chemical Society, Abstracts, vol. 34, n. 0, 1º gennaio 1878, pp. 392–440, DOI:10.1039/CA8783400392. URL consultato il 13 agosto 2023.
- ^ 2-METHYLMERCAPTO-N-METHYL-Δ2-PYRROLINE, in Organic Syntheses, vol. 48, 1968, pp. 97, DOI:10.15227/orgsyn.048.0097. URL consultato il 13 agosto 2023.
- ^ 2,4-DIMETHYLTHIAZOLE, in Organic Syntheses, vol. 25, 1945, pp. 35, DOI:10.15227/orgsyn.025.0035. URL consultato il 13 agosto 2023.
- ^ M.E. Peterson, J.N. Guterl, R. Nichols e M. Rishniw, Evaluation of Serum Thyroid‐Stimulating Hormone Concentration as a Diagnostic Test for Hyperthyroidism in Cats, in Journal of Veterinary Internal Medicine, vol. 29, n. 5, Wiley, 20 luglio 2015, pp. 1327–1334, DOI:10.1111/jvim.13585, ISSN 0891-6640.
- ^ Behrend EN, Update on drugs used to treat endocrine diseases in small animals, in Vet Clin North Am Small Anim Pract, vol. 36, n. 5, settembre 2006, pp. 1087–105, vii, DOI:10.1016/j.cvsm.2006.05.007, PMID 16984828.
- ^ a b Dottore Vincenzo Piazza - Specialista Endocrinologo - Effetti extratiroidei delle tionamidi con attività antitiroidea, su vincenzopiazza.it.
- ^ Sitar DS, Metabolism of thioamide antithyroid drugs, in Drug Metab Rev, vol. 22, n. 5, 1990, pp. 477–502, DOI:10.3109/03602539008991448, PMID 1706656.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su tionamidi
Wikimedia Commons contiene immagini o altri file su tionamidi
Collegamenti esterni[modifica | modifica wikitesto]
- Mahanta N, Szantai-Kis DM, Petersson EJ, Mitchell DA, Biosynthesis and Chemical Applications of Thioamides, in ACS Chem Biol, vol. 14, n. 2, febbraio 2019, pp. 142–163, DOI:10.1021/acschembio.8b01022, PMC 6404778, PMID 30698414.
- Sitar DS, Metabolism of thioamide antithyroid drugs, in Drug Metab Rev, vol. 22, n. 5, 1990, pp. 477–502, DOI:10.3109/03602539008991448, PMID 1706656.
- Ethionamide - Drugs and Lactation Database (LactMed®) - NCBI Bookshelf, su ncbi.nlm.nih.gov.