Pentasolfuro di fosforo
| Pentasolfuro di fosforo | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| decasolfuro di tetrafosforo | |
| Nomi alternativi | |
| pentasolfuro di difosforo, anidride tiofosforica, persolfuro di fosforo | |
| Caratteristiche generali | |
| Formula bruta o molecolare | P4S10 |
| Massa molecolare (u) | 444,555 |
| Aspetto | solido giallo |
| Numero CAS | |
| Numero EINECS | 215-242-4 |
| PubChem | 14817 |
| SMILES | P12(=S)SP3(=S)SP(=S)(S1)SP(=S)(S2)S3 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2,09 |
| Solubilità in acqua | reagisce |
| Temperatura di fusione | 288 °C (561 K) |
| ΔfusH0 (kJ·mol−1) | 41 |
| Temperatura di ebollizione | 514 °C (787 K) |
| ΔebH0 (kJ·mol−1) | 178 |
| Tensione di vapore (Pa) a 20 °C K | < 1 hPa |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −309 |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 750 (topo, orale) |
| Indicazioni di sicurezza | |
| Punto di fiamma | > 260 °C |
| Temperatura di autoignizione | ≈300 °C |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 228 - 260 - 302 - 332 - 400 - EUH029 |
| Consigli P | 210 - 260 - 231+232 - 273 - 370+378 - 422 [1] |
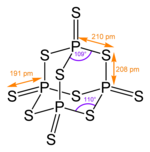
Il pentasolfuro di fosforo è il composto inorganico di formula minima P2S5. In realtà è formato da molecole P4S10 e il nome più corretto è decasolfuro di tetrafosforo. È uno dei due solfuri di fosforo di importanza commerciale, ed è un solido giallo, ma quando non è puro il colore del composto può essere verdino o grigio. La molecola ha una forma quasi identica a quella dell'anidride fosforica (P4O10), ed è basata su una struttura tetraedrica simile a quella dell'adamantano.
Sintesi[modifica | modifica wikitesto]
La prima sintesi del decasolfuro di tetrafosforo fu descritta nel 1843 da Berzelius,[2] che fece reagire fosforo bianco (P4) con zolfo a temperatura oltre i 300 °C. Questa stessa procedura è ancora valida. Alternativamente si può formare il decasolfuro di tetrafosforo facendo reagire zolfo elementare o pirite (FeS2) con ferrofosforo, una forma impura di FeP2, sottoprodotto della produzione del fosforo bianco dalle rocce fosfatiche:
Reattività[modifica | modifica wikitesto]
Il decasolfuro di tetrafosforo è un composto stabile, ma reagisce a contatto con acqua, acidi, basi e alcoli. A contatto con l'umidità atmosferica si idrolizza formando solfuro di idrogeno (H2S) che conferisce al decasolfuro di tetrafosforo un odore di uova marce. Per idrolisi si forma anche acido fosforico:
A contatto con l'acqua reagisce violentemente liberando acidi fosforici e solfuro di idrogeno (tossico e infiammabile). Altri nucleofili lievi reagiscono col decasolfuro di tetrafosforo, inclusi alcoli e ammine. Composti aromatici come anisolo, ferrocene e 1-metossinaftalene reagiscono per formare 1,3,2,4-ditiadifosfetano 2,4-disolfuri come reagente di Lawesson[3]
In chimica organica è usato come agente solforante. Reazioni di questo tipo richiedono condizioni di riflusso in solventi come benzene, diossano o acetonitrile, dove P4S10 si dissocia formando P2S5. Quest'ultimo può essere intrappolato ad esempio formando un complesso con la piridina. I chetoni sono convertiti in tiochetoni. L'atomo di ossigeno può essere sostituito dallo zolfo anche in esteri, immidi e lattoni. Dalle ammidi si ottengono tioammidi. Da 1,4-dichetoni si ottiene tiofene. Rispetto al più noto reagente di Lawesson, con P4S10 si ottengono rese minori.[4]
Usi[modifica | modifica wikitesto]
Nel 2006 sono state prodotte più di 22000 tonnellate di decasolfuro di tetrafosforo solo negli Stati Uniti.[5] Il composto è usato principalmente come materiale di partenza per preparare additivi per lubrificanti come il ditiofosfato di zinco. Viene usato inoltre nella produzione di insetticidi organofosfati, come il parathion e il malathion.[6] Si usa anche come componente di alcuni elettroliti solidi (ad esempio Li2S-P2S5) in alcuni tipi di batterie al litio. Un uso minore è come agente di flottazione.
Note[modifica | modifica wikitesto]
- ^ scheda del composto su IFA-GESTIS
- ^ (DE) Demselben, Ueber die Verbindungen des Phosphors mit Schwefel, in Justus Liebigs Annalen der Chemie, vol. 46, n. 3, 1843, pp. 251-281, DOI:10.1002/jlac.18430460303. URL consultato il 25 novembre 2010.
- ^ (EN) T. Ozturk, E. Ertas e O. Mert, A Berzelius Reagent, Phosphorus Decasulfide (P4S10), in Organic Syntheses, in Chemical Reviews, vol. 110, n. 6, 2010, pp. 3419–3478, DOI:10.1021/cr900243d, PMID 20429553.
- ^ (EN) T. Ozturk, E. Ertas e O. Mert, A Berzelius reagent, phosphorus decasulfide (P4S10), in organic syntheses, in Chem. Rev., vol. 110, n. 6, 2010, pp. 3419–3478, DOI:10.1021/cr900243d. URL consultato il 25 novembre 2010.
- ^ (EN) Inventory Update Reporting della U.S. Environmental Protection Agency, su epa.gov. URL consultato il 25 novembre 2010.
- ^ (EN) Phosphorus Compounds, Inorganic, in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, 2000, DOI:10.1002/14356007.a19_527.
Bibliografia[modifica | modifica wikitesto]
- (EN) Greenwood, N.N. e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Pentasolfuro di fosforo
Wikimedia Commons contiene immagini o altri file su Pentasolfuro di fosforo


