Tiofene
| Tiofene | |
|---|---|
 | |
| Nome IUPAC | |
| Tiofene | |
| Nomi alternativi | |
| Tiofurano Tiaciclopentadiene Tiolo | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H4S |
| Massa molecolare (u) | 84,14 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 203-729-4 |
| PubChem | 8030 |
| SMILES | C1=CSC=C1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,05 |
| Solubilità in acqua | immiscibile con l'acqua, solubile in solventi organici apolari |
| Temperatura di fusione | −38 °C (235,15 K) |
| Temperatura di ebollizione | 84 °C (357,15 K) |
| Tensione di vapore (Pa) a 293,15 K | 80 hPa |
| Indicazioni di sicurezza | |
| Punto di fiamma | −9 °C (264,15 K) |
| Limiti di esplosione | 12,5% |
| Temperatura di autoignizione | 395 °C (668,15 K) |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 225 - 302 - 319 - 412 |
| Consigli P | 210 - 260 - 262 - 273 - 305+351+338 - 403+235 [1] |
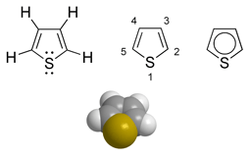
Il tiofene è un composto eterociclico aromatico formato da quattro atomi di idrogeno e uno di zolfo legati in una struttura ad anello penta-atomico. Furano e pirrolo sono esempi comuni di analoghi strutturali in cui l'atomo di zolfo è rispettivamente sostituito da un atomo di ossigeno e da uno di azoto legato a un idrogeno.
Il tiofene fu originariamente scoperto da Viktor Meyer nel 1883, come contaminante del benzene.[2] Tra i suoi principali derivati degni di menzione sono il benzotiofene, nel quale un anello benzenico è fuso al tiofene, e il dibenzotiofene con due anelli benzenici fusi.
Struttura
[modifica | modifica wikitesto]Il tiofene è una sostanza molecolare e la simmetria della molecola appartiene al gruppo puntuale C2v.[3] Attraverso indagini spettroscopiche rotazionali nella regione delle microonde è stato possibile desumere le caratteristiche salienti della molecola del tiofene. Nello scheletro dell'anello, il legame S-C(2) ha una lunghezza di 171,4 pm, quello C(2)-C(3) di 137,0 pm e quello C(3)-C(4) di 142,3 pm; l'angolo su S è di 92,2°, quello su C(2) di 111,5° e quello su C(3) di 112,5°.[4] La molecola mostra una certa polarità, il momento dipolare ammonta a 0,56 D,[5] valore decisamente minore in confronto a quello del suo analogo saturo, il tetraidrotiofene (1,89 D).[6]
Proprietà chimiche
[modifica | modifica wikitesto]A temperatura ambiente il tiofene si presenta come un liquido incolore dall'odore gradevole simile al benzene, composto col quale condivide l'aromaticità e le conseguenti proprietà chimiche.
Il tiofene è un composto aromatico, anche se calcoli teorici indicano una aromaticità minore rispetto a quella del benzene, perché attraverso gli orbitali p dei cinque atomi dell'anello vengono condivisi 6 elettroni: uno da ciascun atomo di carbonio e due dallo zolfo, rispettando così la regola di Hückel. La partecipazione di un doppietto solitario dello zolfo alla formazione della nuvola aromatica π è fondamentale nel determinare il carattere di aromaticità del composto. In conseguenza di tale caratteristica il tiofene è suscettibile di attacco elettrofilo sui carboni dell'anello, dando le tipiche sostituzioni elettrofile aromatiche, quali alogenazioni, nitrazioni e le reazioni di Friedel-Crafts e le solfonazioni. In particolare, quest'ultima viene sfruttata per separarlo dal benzene con cui spesso si trova in miscela nel petrolio grezzo: trattando una miscela benzene/tiofene con acido solforico si ottiene la solfonazione del solo tiofene, il cui derivato (un acido solfonico) è idrosolubile e può essere separato per estrazione con solvente. La separazione per semplice distillazione risulterebbe difficile a causa della piccola differenza di temperature di ebollizione, che è di circa 4 °C. Il tiofene, sebbene sia (formalmente) un tioetere, non viene alchilato sull'atomo di zolfo da alogenuri alchilici, a differenza del tetraidrotiofene, anch'esso tioetere, che però aromatico non è.
Sintesi e fonti
[modifica | modifica wikitesto]Tiofene e derivati vengono classicamente ottenuti attraverso la sintesi di Paal-Knorr per reazione di 1,4-dichetoni con agenti solforanti quali il reagente di Lawesson o il pentasolfuro di fosforo (formula molecolare P4S10). Specifici tiofeni si possono poi sintetizzare sfruttando la reazione di Gewald, che sfrutta zolfo elementare:
Il tiofene e i suoi derivati sono presenti nel petrolio, in concentrazioni variabili tra 1-3% e si possono ottenere anche dal carbone. Costituiscono dei prodotti indesiderati e vengono eliminati tramite il processo di idrodesolforazione, con la scissione in idrocarburi e solfuro di idrogeno.
Usi
[modifica | modifica wikitesto]I tiofeni sono importanti composti eterociclici utilizzati nella sintesi di farmaci e prodotti fitosanitari.[7] Sono inoltre utili intermedi di sintesi, dei quali viene sfruttata la reattività in reazioni che coinvolgono elettrofili. Per desolforazione con nichel Raney si ottengono butani 1,4-disostituiti. La polimerizzazione di unità monomere di tiofene produce il politiofene, materiale plastico che può essere utilizzato come polimero conduttore.
Il tiofene viene anche utilizzato per la denaturazione dell'etanolo, composto con il quale forma un azeotropo.
Note
[modifica | modifica wikitesto]- ^ scheda del tiofene su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ Viktor Meyer, Ueber den Begleiter des Benzols im Steinkohlenteer, in Berichte der Deutschen chemischen Gesellschaft, vol. 16, 1883, pp. 1465–1478, DOI:10.1002/cber.188301601324.
- ^ CCCBDB list all species by point group, su cccbdb.nist.gov. URL consultato il 13 giugno 2022.
- ^ (EN) Børge Bak, Daniel Christensen e Lise Hansen-Nygaard, The structure of thiophene, in Journal of Molecular Spectroscopy, vol. 7, n. 1-6, 1961-01, pp. 58–63, DOI:10.1016/0022-2852(61)90341-1. URL consultato il 13 giugno 2022.
- ^ thiophene, su www.stenutz.eu. URL consultato il 13 giugno 2022.
- ^ thiolane, su www.stenutz.eu. URL consultato il 13 giugno 2022.
- ^ Jonathan Swanston “Thiophene” in Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2006. DOI: 10.1002/14356007.a26 793.pub2.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «tiofene»
Wikizionario contiene il lemma di dizionario «tiofene» Wikimedia Commons contiene immagini o altri file su tiofene
Wikimedia Commons contiene immagini o altri file su tiofene
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) thiophene, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | NDL (EN, JA) 00573066 |
|---|
