Acido teflico
| Acido teflico | |
|---|---|
 | |
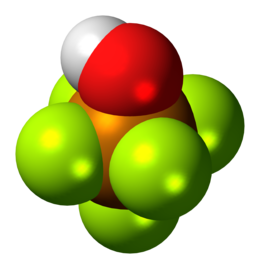 | |
| Nome IUPAC | |
| Acido pentafluoroortotellurico | |
| Nomi alternativi | |
| Acido teflico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | HTeOF5 |
| Massa molecolare (u) | 239,60 |
| Aspetto | solido incolore |
| Numero CAS | |
| Numero EINECS | 633-471-1 |
| PubChem | 15243876 |
| SMILES | F[Te](F)(F)(F)(F)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2,5 g/cm3 |
| Temperatura di fusione | 39,1 °C |
| Temperatura di ebollizione | 59,7 °C |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
| Frasi R | 34 |
| Frasi S | 26-27-36/37/39-45 |
L'acido teflico (nome sistematico acido pentafluoroortotellurico) è un acido forte del tellurio esavalente (TeVI), di formula HTeOF5[1] e formula semistrutturale F5Te-OH. La sua base coniugata, lo ione teflato F5TeO–, è un anione molto debolmente coordinante[2] e i suoi addotti con forti acidi diLewis, come B(OTeF5)3, Al(OTeF5)3, As(OTeF5)5 o Sb(OTeF5)5 , sono anioni ancora meno coordinanti. In quanto tale, lo ione teflato riveste particolare interesse in questo ambito di ricerca chimica.[3][4][5]
A temperatura ambiente l'acido teflico si presenta come un solido cristallino incolore bassofondente (39,1 °C), che bolle a 59,7 °C.[6] La struttura molecolare è ottaedrica distorta, può pensarsi derivata da quella dell'esafluoruro tellurico TeF6 (simmetria Oh) per sostituzione di un atomo di fluoro con un gruppo ossidrilico OH. In tal modo la simmetria, ignorando l'atomo di idrogeno, si riduce approssimativamente a C4v. Il legame Te–O, che misura 187 pm, è leggermente più corto di quello presente nell'acido ortotellurico Te(OH)6 (191 pm).[6]
Sintesi e reazioni[modifica | modifica wikitesto]
L'acido teflico può essere preparato facendo reagire tellurato acido di bario con acido fluorosolforico:[7]
È anche il primo dei prodotti che si formano nell'idrolisi dell'esafluoruro di tellurio:
L'acido teflico reagisce a bassa temperatura con l'idrogenodifluoruro di tetrafluoroammonio in HF liquido per dare un "ipofluorito",[8] F–O–TeF5:[9]
- HOTeF5 + [NF4]+[HF2]–·nHF → NF3 + (2+n) HF + FOTeF5
Similmente, si può ottenere Cl–O–TeF5 facendo reagire l'acido teflico con ClF:[10]
- HOTeF5 + ClF → HF + ClOTeF5
Questo è ottenibile anche usando ClOSO2F al posto di ClF:[10]
- HOTeF5 + ClOSO2F → HF + ClOTeF5
Composti[modifica | modifica wikitesto]


Dell'acido teflico esistono svariati sali[11] Mn+(–OTeF5)n e molti esteri del tipo RFTeOF5,[12] detti teflati;[13] altri composti hanno la struttura di anidride, come O(TeF5)2, o di anidride mista, come B(OTeF5)3. Quest'ultima, che è un acido di Lewis molto più forte del trifluoruro di boro, sottoposta a pirolisi, fornisce il composto dimerico (TeF4O)2:[7]
La resistenza di questo anione all'ossidazione ha permesso di sintetizzare specie chimiche improbabili come gli anioni esakisteflato di As, Sb e Bi di formula generale [MV(OTeF5)6]– e anche, attraverso di essi, di ottenere il catione di gas nobile presente nel "sale" [Xe(OTeF5)]+[Sb(OTeF5)6]–.[14]
Note[modifica | modifica wikitesto]
- ^ La formula può trovarsi scritta in vari modi. Questo caso segue la nomenclatura ufficiale (si veda Nomenclatura chimica#Leggere e scrivere le formule).
- ^ (EN) Wolfgang Beck e Karlheinz Suenkel, Metal complexes of weakly coordinating anions. Precursors of strong cationic organometallic Lewis acids, in Chemical Reviews, vol. 88, n. 7, 1988-11, pp. 1405–1421, DOI:10.1021/cr00089a017. URL consultato il 10 febbraio 2022.
- ^ (EN) Konrad Seppelt, ?Noncoordinating? Anions, II, in Angewandte Chemie International Edition in English, vol. 32, n. 7, 1993-07, pp. 1025–1027, DOI:10.1002/anie.199310251. URL consultato il 10 febbraio 2022.
- ^ Steven H. Strauss, The search for larger and more weakly coordinating anions, in Chemical Reviews, vol. 93, n. 3, 1º maggio 1993, pp. 927–942, DOI:10.1021/cr00019a005. URL consultato il 10 febbraio 2022.
- ^ (EN) Ingo Krossing e Ines Raabe, Noncoordinating Anions—Fact or Fiction? A Survey of Likely Candidates, in Angewandte Chemie International Edition, vol. 43, n. 16, 13 aprile 2004, pp. 2066–2090, DOI:10.1002/anie.200300620. URL consultato il 10 febbraio 2022.
- ^ a b (EN) S. Herbers, D. A. Obenchain e P. Kraus, Blurring out hydrogen: The dynamical structure of teflic acid, in The Journal of Chemical Physics, vol. 148, n. 19, 21 maggio 2018, pp. 194307, DOI:10.1063/1.5027487. URL consultato il 10 febbraio 2022.
- ^ a b Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth - Heinemann, 1997, p. 778, ISBN 0-7506-3365-4.
- ^ (EN) Carl J. Schack, William W. Wilson e Karl O. Christe, Synthesis and characterization of tellurium fluoride hypofluorite (TeF5OF), in Inorganic Chemistry, vol. 22, n. 1, 1983-01, pp. 18–21, DOI:10.1021/ic00143a005. URL consultato il 10 febbraio 2022.
- ^ a b (EN) Carl J. Schack e Karl O. Christe, New syntheses of pentafluorotellurium hypochlorite, in Journal of Fluorine Chemistry, vol. 21, n. 3, 1982-11, pp. 393–396, DOI:10.1016/S0022-1139(00)81525-0. URL consultato il 10 febbraio 2022.
- ^ (EN) Jayantha Amarasekera, The Chemistry of Highly Electronegative OTeF5 Group (PDF), su chemistry.illinois.edu, 6 Maggio 1986, pp. 43-46.
- ^ (EN) Karl O. Christe, Research in Inorganic Fluorine Chemistry (PDF), su researchgate.net, 31 Marzo 1991.
- ^ Che non vanno confusi con i tereftalati, i sali dell'acido tereftalico o con i triflati, i sali dell'acido triflico.
- ^ Mercier, H. P.A.; Sanders, J. C. P.; Schrobilgen, G. J. "The Hexakis(pentafluorooxotellurato)pnictate(V) Anions, M(OTeF5)6- (M = As, Sb, Bi): A Series of Very Weakly Coordinating Anions" Journal of the American Chemical Society, volume 116, 2921, (1994). DOI: 10.1021/ja00086a025.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su acido teflico
Wikimedia Commons contiene immagini o altri file su acido teflico
Collegamenti esterni[modifica | modifica wikitesto]
- Dati su Sigma-Aldrich, su sigmaaldrich.com.
- Teflato di piridinio, su sigmaaldrich.com.


