Acido tellurico
| Acido tellurico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Acido esaossotellurico(VI) | |
| Nomi alternativi | |
| Acido ortotellurico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | Te(OH)6 |
| Massa molecolare (u) | 229,64 |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 232-267-6 |
| PubChem | 61609 |
| SMILES | O[Te](O)(O)(O)(O)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 3,07 |
| Costante di dissociazione acida a 291 K | 7,68 |
| Solubilità in acqua | 501 g/l a 30 °C |
| Temperatura di fusione | 409,15 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
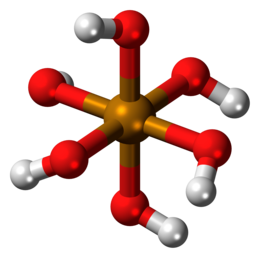
L'acido tellurico è un acido esaprotico debole di formula chimica Te(OH)6 formante sali detti tellurati. Si presenta come un solido cristallino bianco a struttura ottaedrica, che si mantiene anche in soluzione acquosa.[1] Ha due forme cristalline: romboedrica e monoclina, in cui la forma ottaedrica del complesso Te(OH)6 si mantiene.[2]
Sintesi[modifica | modifica wikitesto]
L'acido tellurico si forma per ossidazione di tellurio o diossido di tellurio con un agente ossidante, come perossido di idrogeno, triossido di cromo o perossido di sodio[3]
- TeO2 + H2O2 + 2H2O → Te(OH)6
La cristallizzazione dell'acido tellurico in soluzione acquosa a temperature inferiori a 10 °C produce Te(OH)6·4H2O:[3]. L'acido riduce però l'idrogeno dell'acqua in cui è contenuto, anche se la reazione è molto lenta.
- H6TeO6 + 2H+ + 2e- → TeO2 + 4H2O E
o= +1.02 V
Proprietà[modifica | modifica wikitesto]
L'acido anidro è stabile in aria fino a 100 °C, ma al di sopra di questa temperatura si disidrata per formare acido polimetatellurico, una polvere bianca igroscopica (con una compostizione approssimativa H2TeO4)10) ed acido allotellurico, una sostanza dalla struttura ancora sconosciuta (e composizione approssimativa H2TeO4)3(H2O)4).[4] I sali tipici dell'acido tellurico contengono gli anioni [Te(O)(OH)5]- e [Te(O)2(OH)4]2-; la presenza dello ione tellurio TeO42- è confermata dalla struttura di Rb6[TeO5][TeO4].[5] Riscaldando l'acido tellurico oltre i 300 °C, si produce l'α-triossido di tellurio (α-TeO3).
La reazione con il diazometano produce l'esametil estere, Te(OCH3)6.[4]
Note[modifica | modifica wikitesto]
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth–Heinemann. ISBN 0080379419.
- ^ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.), New York: Wiley-Interscience, ISBN 0-471-19957-5
- ^ a b Cotton, F. Albert, Wilkinson, Geoffrey, Murillo, A. Carlos, Bochmann, Manfred, Advanced Inorganic Chemistry (Ed. Wiley-Interscience), 1999. ISBN 0-471-19957-5
- ^ a b N.N. Greenwood, A. Earnshaw, Chemistry of the Elements (Second edition), (Ed. Butterwoth-Heinemann), 1997. ISBN 0080379419.
- ^ Catherine E. Housecroft, Alan G. Sharpe, Chapter 16 di Inorganic Chemistry, 3th Edition, (Ed. Pearson), 2008, pagina 526. ISBN 978-0-13-175553-6.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su acido tellurico
Wikimedia Commons contiene immagini o altri file su acido tellurico
| Controllo di autorità | GND (DE) 4184677-1 |
|---|