Etanercept: differenze tra le versioni
m Bot: correzione mesi |
m fix parametri in template cita using AWB |
||
| Riga 147: | Riga 147: | ||
=== Malattia infiammatoria cronica intestinale === |
=== Malattia infiammatoria cronica intestinale === |
||
Nei pazienti affetti da [[artrite giovanile idiopatica]] in cura con etanercept si sono verificati diversi casi di malattia infiammatoria intestinale ([[malattia di Crohn]], [[Rettocolite ulcerosa|pancoliti]]). L'analisi dei registri europei (dal 1999 al 2008) sembra evidenziare una correlazione tra l’insorgenza della malattia infiammatoria intestinale e l’uso di etanercept. In diversi studi su soggetti con artrite giovanile idiopatica l’incidenza della malattia è risultata più elevata,<ref name="pmid20472717">{{Cita pubblicazione | cognome = Dallocchio | nome = A. | coautori = D. Canioni; F. Ruemmele; A. Duquesne; JY. Scoazec; R. Bouvier; F. Paraf; J. Languepin; CH. Wouters; M. Guillot; P. Quartier | titolo = Occurrence of inflammatory bowel disease during treatment of juvenile idiopathic arthritis with etanercept: a French retrospective study. | rivista = Rheumatology (Oxford) | volume = 49 | numero = 9 | pagine = 1694-8 | mese |
Nei pazienti affetti da [[artrite giovanile idiopatica]] in cura con etanercept si sono verificati diversi casi di malattia infiammatoria intestinale ([[malattia di Crohn]], [[Rettocolite ulcerosa|pancoliti]]). L'analisi dei registri europei (dal 1999 al 2008) sembra evidenziare una correlazione tra l’insorgenza della malattia infiammatoria intestinale e l’uso di etanercept. In diversi studi su soggetti con artrite giovanile idiopatica l’incidenza della malattia è risultata più elevata,<ref name="pmid20472717">{{Cita pubblicazione | cognome = Dallocchio | nome = A. | coautori = D. Canioni; F. Ruemmele; A. Duquesne; JY. Scoazec; R. Bouvier; F. Paraf; J. Languepin; CH. Wouters; M. Guillot; P. Quartier | titolo = Occurrence of inflammatory bowel disease during treatment of juvenile idiopathic arthritis with etanercept: a French retrospective study. | rivista = Rheumatology (Oxford) | volume = 49 | numero = 9 | pagine = 1694-8 | mese=settembre| anno = 2010 | doi = 10.1093/rheumatology/keq136 | pmid = 20472717 }}</ref> fino a 43 volte superiore rispetto alla popolazione pediatrica generale<ref name="pmid21459936">{{Cita pubblicazione | cognome = van Dijken | nome = TD. | coautori = SJ. Vastert; VM. Gerloni; I. Pontikaki; K. Linnemann; H. Girschick; W. Armbrust; K. Minden; FH. Prince; FT. Kokke; EE. Nieuwenhuis | titolo = Development of inflammatory bowel disease in patients with juvenile idiopathic arthritis treated with etanercept. | rivista = J Rheumatol | volume = 38 | numero = 7 | pagine = 1441-6 | mese=luglio| anno = 2011 | doi = 10.3899/jrheum.100809 | pmid = 21459936 }}</ref> |
||
=== Infezioni sistemiche === |
=== Infezioni sistemiche === |
||
Il [[Tumor Necrosis Factor alfa]] ([[TNFalfa]]) ha un ruolo fondamentale nella risoluzione delle infezioni intracellulari, la sua inibizione potrebbe compromettere le [[difese immunitarie]] dell’ospite. La sua soppressione può mascherare i sintomi di un’infezione e renderne più difficoltosa la diagnosi e il successivo trattamento. Nel corso di terapia con etanercept i pazienti devono essere monitorati per il rischio di sviluppare [[infezioni]], in particolare quelli con [[anamnesi (medicina)|anamnesi]] di infezioni ricorrenti e coloro che vivono in zone in cui infezioni quali [[istoplasmosi]] e [[coccidiomicosi]] sono comuni. In alcuni casi le infezioni sviluppatesi durante la terapia con etanercept hanno avuto esito fatale. In pazienti trattati con etanercept sono state segnalate [[tubercolosi]] (tubercolosi miliari, tubercolosi con localizzazione extrapolmonare), [[sepsi]],<ref name="pmid11393506">{{Cita pubblicazione | cognome = Baghai | nome = M. | coautori = DR. Osmon; DM. Wolk; LE. Wold; GJ. Haidukewych; EL. Matteson | titolo = Fatal sepsis in a patient with rheumatoid arthritis treated with etanercept. | rivista = Mayo Clin Proc | volume = 76 | numero = 6 | pagine = 653-6 | mese = Giu | anno = 2001 | doi = 10.4065/76.6.653 | |
Il [[Tumor Necrosis Factor alfa]] ([[TNFalfa]]) ha un ruolo fondamentale nella risoluzione delle infezioni intracellulari, la sua inibizione potrebbe compromettere le [[difese immunitarie]] dell’ospite. La sua soppressione può mascherare i sintomi di un’infezione e renderne più difficoltosa la diagnosi e il successivo trattamento. Nel corso di terapia con etanercept i pazienti devono essere monitorati per il rischio di sviluppare [[infezioni]], in particolare quelli con [[anamnesi (medicina)|anamnesi]] di infezioni ricorrenti e coloro che vivono in zone in cui infezioni quali [[istoplasmosi]] e [[coccidiomicosi]] sono comuni. In alcuni casi le infezioni sviluppatesi durante la terapia con etanercept hanno avuto esito fatale. In pazienti trattati con etanercept sono state segnalate [[tubercolosi]] (tubercolosi miliari, tubercolosi con localizzazione extrapolmonare), [[sepsi]],<ref name="pmid11393506">{{Cita pubblicazione | cognome = Baghai | nome = M. | coautori = DR. Osmon; DM. Wolk; LE. Wold; GJ. Haidukewych; EL. Matteson | titolo = Fatal sepsis in a patient with rheumatoid arthritis treated with etanercept. | rivista = Mayo Clin Proc | volume = 76 | numero = 6 | pagine = 653-6 | mese = Giu | anno = 2001 | doi = 10.4065/76.6.653 | pmid = 11393506 }}</ref><ref name="pmid17043483">{{Cita pubblicazione | cognome = Kling | nome = A. | coautori = T. Mjörndal; S. Rantapää-Dahlqvist | titolo = Sepsis as a possible adverse drug reaction in patients with rheumatoid arthritis treated with TNFalpha antagonists. | rivista = J Clin Rheumatol | volume = 10 | numero = 3 | pagine = 119-22 | mese=giugno| anno = 2004 | doi = 10.1097/01.rhu.0000128734.07926.8e | pmid = 17043483 }}</ref><ref name="pmid18397693">{{Cita pubblicazione | cognome = Nuñez-Cornejo | nome = C. | coautori = J. Borrás-Blasco; A. Gracia-Perez; JD. Rosique-Robles; V. Lopez-Camps; E. Casterã; FJ. Abad | titolo = Septic shock and community-acquired pneumonia associated with etanercept therapy. | rivista = Int J Clin Pharmacol Ther | volume = 46 | numero = 4 | pagine = 193-7 | mese=aprile| anno = 2008 | pmid = 18397693 }}</ref><ref name="pmid22742581">{{Cita pubblicazione | cognome = Ikumi | nome = N. | coautori = Y. Matsukawa; Y. Kuwana; H. Kodaira; T. Tanaka; N. Maruyama; S. Nozawa; A. Horikoshi; J. Takeuchi | titolo = Staphylococcus aureus sepsis after etanercept induction in a hemodialysis patient. | rivista = Hemodial Int | volume = 17 | numero = 1 | pagine = 133-5 | mese=gennaio| anno = 2013 | doi = 10.1111/j.1542-4758.2012.00723.x | pmid = 22742581 }}</ref> [[aspergillosi]],<ref name="Lassoued-">{{Cita pubblicazione | cognome = Lassoued | nome = S. | coautori = S. Sire; M. Farny; T. Billey; K. Lassoued | titolo = Pulmonary aspergillosis in a patient with rheumatoid arthritis treated by etanercept. | rivista = Clin Exp Rheumatol | volume = 22 | numero = 2 | pagine = 267-8 | pmid = 15083902 }}</ref><ref name="pmid20704604">{{Cita pubblicazione | cognome = Lee | nome = EJ. |coautori= R. Song; JN. Park; YA. Lee; JS. Son; SJ. Hong; HI. Yang; SH. Lee | titolo = Chronic necrotizing pulmonary aspergillosis in a patient treated with a tumor necrosis factor-alpha inhibitor. | rivista = Int J Rheum Dis | volume = 13 | numero = 3 | pagine = e16-9 | mese=agosto| anno = 2010 | doi = 10.1111/j.1756-185X.2010.01528.x | pmid = 20704604 }}</ref> [[pneumocistosi]], [[istoplasmosi]].<ref name="pmid12384912">{{Cita pubblicazione | cognome = Lee | nome = JH. | coautori = NR. Slifman; SK. Gershon; ET. Edwards; WD. Schwieterman; JN. Siegel; RP. Wise; SL. Brown; JN. Udall; MM. Braun | titolo = Life-threatening histoplasmosis complicating immunotherapy with tumor necrosis factor alpha antagonists infliximab and etanercept. | rivista = Arthritis Rheum | volume = 46 | numero = 10 | pagine = 2565-70 | mese=ottobre| anno = 2002 | doi = 10.1002/art.10583 | pmid = 12384912 }}</ref><ref name="pmid12571839">{{Cita pubblicazione | cognome = Slifman | nome = NR. | coautori = SK. Gershon; JH. Lee; ET. Edwards; MM. Braun | titolo = Listeria monocytogenes infection as a complication of treatment with tumor necrosis factor alpha-neutralizing agents. | rivista = Arthritis Rheum | volume = 48 | numero = 2 | pagine = 319-24 | mese=febbraio| anno = 2003 | doi = 10.1002/art.10758 | pmid = 12571839 }}</ref><ref name="pmid14699483">{{Cita pubblicazione | cognome = Colombel | nome = JF. | coautori = EV. Loftus; WJ. Tremaine; LJ. Egan; WS. Harmsen; CD. Schleck; AR. Zinsmeister; WJ. Sandborn | titolo = The safety profile of infliximab in patients with Crohn's disease: the Mayo clinic experience in 500 patients. | rivista = Gastroenterology | volume = 126 | numero = 1 | pagine = 19-31 | mese=gennaio| anno = 2004 | pmid = 14699483 }}</ref><ref name="pmid19444717">{{Cita pubblicazione | cognome = Bourré-Tessier | nome = J. | coautori = C. Fortin; A. Belisle; E. Desmarais; D. Choquette; JL. Senécal | titolo = Disseminated Histoplasma capsulatum infection presenting with panniculitis and focal myositis in rheumatoid arthritis treated with etanercept. | rivista = Scand J Rheumatol | volume = 38 | numero = 4 | pagine = 311-6 | anno = 2009 | doi = 10.1080/03009740902776935 | pmid = 19444717 }}</ref> |
||
=== Infezione tubercolare latente === |
=== Infezione tubercolare latente === |
||
La riattivazione di un'infezione latente da [[Mycobacterium tuberculosis]] è una tipica complicanza dei trattamenti con gli inibitori del TNFalfa, meno frequente con etanercept rispetto a [[infliximab]] e [[adalimumab]].(Tubach et al., 2009). Per questo motivo prima di iniziare il trattamento con etanercept si deve escludere la presenza di tubercolosi in fase attiva mediante anamnesi accurata del paziente, test cutaneo con tubercolina e radiografia del torace. |
La riattivazione di un'infezione latente da [[Mycobacterium tuberculosis]] è una tipica complicanza dei trattamenti con gli inibitori del TNFalfa, meno frequente con etanercept rispetto a [[infliximab]] e [[adalimumab]].(Tubach et al., 2009). Per questo motivo prima di iniziare il trattamento con etanercept si deve escludere la presenza di tubercolosi in fase attiva mediante anamnesi accurata del paziente, test cutaneo con tubercolina e radiografia del torace. |
||
=== Infezione da virus Herpes zoster === |
=== Infezione da virus Herpes zoster === |
||
La somministrazione di etanercept è stata associata a riattivazione dell’infezione da [[Herpes zoster]] in pazienti con [[artrite reumatoide]].<ref name="pmid19224750">{{Cita pubblicazione | cognome = Strangfeld | nome = A. | coautori = J. Listing; P. Herzer; A. Liebhaber; K. Rockwitz; C. Richter; A. Zink | titolo = Risk of herpes zoster in patients with rheumatoid arthritis treated with anti-TNF-alpha agents. | rivista = JAMA | volume = 301 | numero = 7 | pagine = 737-44 | mese |
La somministrazione di etanercept è stata associata a riattivazione dell’infezione da [[Herpes zoster]] in pazienti con [[artrite reumatoide]].<ref name="pmid19224750">{{Cita pubblicazione | cognome = Strangfeld | nome = A. | coautori = J. Listing; P. Herzer; A. Liebhaber; K. Rockwitz; C. Richter; A. Zink | titolo = Risk of herpes zoster in patients with rheumatoid arthritis treated with anti-TNF-alpha agents. | rivista = JAMA | volume = 301 | numero = 7 | pagine = 737-44 | mese=febbraio| anno = 2009 | doi = 10.1001/jama.2009.146 | pmid = 19224750 }}</ref> In caso di infezione o riattivazione dell’infezione, l’etanercept deve essere immediatamente sospeso e il paziente sottoposto a terapia antivirale. |
||
=== Neoplasie maligne e disordini linfoproliferativi === |
=== Neoplasie maligne e disordini linfoproliferativi === |
||
Nei trial clinici in pazienti trattati con inibitori del TNF-alfa, l’incidenza di neoplasie maligne, ed in particolare di [[linfoma]], è risultata maggiore rispetto al gruppo di controllo. |
Nei trial clinici in pazienti trattati con inibitori del TNF-alfa, l’incidenza di neoplasie maligne, ed in particolare di [[linfoma]], è risultata maggiore rispetto al gruppo di controllo. |
||
Studi effettuati sul profilo di sicurezza di etanercept hanno riscontrato una maggiore incidenza dello sviluppo di linfoma nella popolazione pediatrica trattata con l’inibitore del TNF-alfa rispetto alla popolazione pediatrica generale.<ref name="pmid20546618">{{Cita pubblicazione | cognome = McCroskery | nome = P. | coautori = CA. Wallace; DJ. Lovell; S. Stryker; N. Chernyukhin; C. Blosch; DJ. Zack | titolo = Summary of worldwide pediatric malignancies reported after exposure to etanercept. | rivista = Pediatr Rheumatol Online J | volume = 8 |
Studi effettuati sul profilo di sicurezza di etanercept hanno riscontrato una maggiore incidenza dello sviluppo di linfoma nella popolazione pediatrica trattata con l’inibitore del TNF-alfa rispetto alla popolazione pediatrica generale.<ref name="pmid20546618">{{Cita pubblicazione | cognome = McCroskery | nome = P. | coautori = CA. Wallace; DJ. Lovell; S. Stryker; N. Chernyukhin; C. Blosch; DJ. Zack | titolo = Summary of worldwide pediatric malignancies reported after exposure to etanercept. | rivista = Pediatr Rheumatol Online J | volume = 8 | pagine = 18 | anno = 2010 | doi = 10.1186/1546-0096-8-18 | pmid = 20546618 }}</ref> |
||
Sulla base dei dati di letteratura e delle segnalazioni postmarketing raccolte, nell’aprile del 2011 la FDA ha iniziato un’analisi del profilo di sicurezza, relativamente al rischio di tumore, dei farmaci anti-TNF nei pazienti con età uguale o inferiore a 30 anni.<ref name="FdaDScommunication">{{Cita web | autore= | titolo= FDA Drug Safety Communication: UPDATE on Tumor Necrosis Factor (TNF) blockers and risk for pediatric malignancy | url= http://www.fda.gov/Drugs/DrugSafety/ucm278267.htm | editore= Food and Drug Administration | data= |
Sulla base dei dati di letteratura e delle segnalazioni postmarketing raccolte, nell’aprile del 2011 la FDA ha iniziato un’analisi del profilo di sicurezza, relativamente al rischio di tumore, dei farmaci anti-TNF nei pazienti con età uguale o inferiore a 30 anni.<ref name="FdaDScommunication">{{Cita web | autore= | titolo= FDA Drug Safety Communication: UPDATE on Tumor Necrosis Factor (TNF) blockers and risk for pediatric malignancy | url= http://www.fda.gov/Drugs/DrugSafety/ucm278267.htm | editore= Food and Drug Administration | data=11 marzo 2011 | accesso = 12 giugno 2013 }}</ref> |
||
== Controindicazioni == |
== Controindicazioni == |
||
| Riga 168: | Riga 168: | ||
=== Granulomatosi di Wegener === |
=== Granulomatosi di Wegener === |
||
Etanercept non è raccomandato nel trattamento della [[granulomatosi di Wegener]] in quei soggetti che sono già in cura con farmaci [[citotossici]]. In questa forma di [[vasculite]] autoimmune necrotizzante dei vasi di piccolo e medio calibro, sono stati condotti degli studi per determinare l'efficacia del farmaco e l'eventuale correlazione tra l’utilizzo dell'inibitore del TNF-α e l’insorgenza di tumori solidi. |
Etanercept non è raccomandato nel trattamento della [[granulomatosi di Wegener]] in quei soggetti che sono già in cura con farmaci [[citotossici]]. In questa forma di [[vasculite]] autoimmune necrotizzante dei vasi di piccolo e medio calibro, sono stati condotti degli studi per determinare l'efficacia del farmaco e l'eventuale correlazione tra l’utilizzo dell'inibitore del TNF-α e l’insorgenza di tumori solidi. |
||
Etanercept non si è dimostrato efficace nel mantenere la remissione nei pazienti con granulomatosi di Wegener.<ref name="pmid15673801">{{Cita pubblicazione | cognome= Wegener's Granulomatosis Etanercept Trial (WGET) Research Group. | nome= |
Etanercept non si è dimostrato efficace nel mantenere la remissione nei pazienti con granulomatosi di Wegener.<ref name="pmid15673801">{{Cita pubblicazione | cognome= Wegener's Granulomatosis Etanercept Trial (WGET) Research Group. | nome= | titolo = Etanercept plus standard therapy for Wegener's granulomatosis. | rivista = N Engl J Med | volume = 352 | numero = 4 | pagine = 351-61 | mese=gennaio| anno = 2005 | doi = 10.1056/NEJMoa041884 | pmid = 15673801 }}</ref> |
||
Inoltre in un trial (''Wegener's Granulomatosis Etanercept Trial-WGET'') comprendente 180 pazienti, metà dei quali in terapia con etanercept e metà con placebo, sono comparsi 13 nuovi tumori solidi, di cui 8 nel gruppo trattato con etanercept e 5 nel gruppo trattato con placebo. |
Inoltre in un trial (''Wegener's Granulomatosis Etanercept Trial-WGET'') comprendente 180 pazienti, metà dei quali in terapia con etanercept e metà con placebo, sono comparsi 13 nuovi tumori solidi, di cui 8 nel gruppo trattato con etanercept e 5 nel gruppo trattato con placebo. |
||
Il rischio di insorgenza di [[neoplasie]] solide nei pazienti trattati con etanercept è risultato maggiore rispetto alla popolazione generale, e lo è in particolare in coloro già trattati precedentemente con [[ciclofosfamide]], così come, più in generale, il rischio di insorgenza di tumori solidi sembra aumentare nei soggetti già trattati anche con farmaci [[citotossici]].<ref name="pmid16646004">{{Cita pubblicazione | cognome = Stone | nome = JH. | coautori = JT. Holbrook; MA. Marriott; AK. Tibbs; LP. Sejismundo; YI. Min; U. Specks; PA. Merkel; R. Spiera; JC. Davis; EW. St Clair | titolo = Solid malignancies among patients in the Wegener's Granulomatosis Etanercept Trial. | rivista = Arthritis Rheum | volume = 54 | numero = 5 | pagine = 1608-18 | mese = Mag | anno = 2006 | doi = 10.1002/art.21869 | |
Il rischio di insorgenza di [[neoplasie]] solide nei pazienti trattati con etanercept è risultato maggiore rispetto alla popolazione generale, e lo è in particolare in coloro già trattati precedentemente con [[ciclofosfamide]], così come, più in generale, il rischio di insorgenza di tumori solidi sembra aumentare nei soggetti già trattati anche con farmaci [[citotossici]].<ref name="pmid16646004">{{Cita pubblicazione | cognome = Stone | nome = JH. | coautori = JT. Holbrook; MA. Marriott; AK. Tibbs; LP. Sejismundo; YI. Min; U. Specks; PA. Merkel; R. Spiera; JC. Davis; EW. St Clair | titolo = Solid malignancies among patients in the Wegener's Granulomatosis Etanercept Trial. | rivista = Arthritis Rheum | volume = 54 | numero = 5 | pagine = 1608-18 | mese = Mag | anno = 2006 | doi = 10.1002/art.21869 | pmid = 16646004 }}</ref><ref name="pmid21484770">{{Cita pubblicazione | cognome = Silva | nome = F. | coautori = P. Seo; DR. Schroeder; JH. Stone; PA. Merkel; GS. Hoffman; R. Spiera; JK. Sebastian; JC. Davis; EW. St Clair; NB. Allen | titolo = Solid malignancies among etanercept-treated patients with granulomatosis with polyangiitis (Wegener's): long-term followup of a multicenter longitudinal cohort. | rivista = Arthritis Rheum | volume = 63 | numero = 8 | pagine = 2495-503 | mese = Ago | anno = 2011 | doi = 10.1002/art.30394 | pmid = 21484770 }}</ref> |
||
== Gravidanza e allattamento == |
== Gravidanza e allattamento == |
||
Studi sperimentali in vivo su ratti e conigli non hanno evidenziato alcuna prova di danno od effetti tossici sulla prole. |
Studi sperimentali in vivo su ratti e conigli non hanno evidenziato alcuna prova di danno od effetti tossici sulla prole. |
||
La mancanza di dati certi in letteratura medica inerenti l’uso del farmaco in gravidanza comporta l’uso di valide misure contraccettive per tutta la durata della terapia e fino a tre settimane dopo la cessazione della stessa. |
La mancanza di dati certi in letteratura medica inerenti l’uso del farmaco in gravidanza comporta l’uso di valide misure contraccettive per tutta la durata della terapia e fino a tre settimane dopo la cessazione della stessa. |
||
La [[Food and Drug Administration]] ha inserito etanercept in classe B per l’uso in gravidanza. Nella classe B sono inseriti i farmaci per i quali sono disponibili solo studi preclinici in vivo che non hanno evidenziato tossicità fetale e i farmaci i cui studi preclinici in vivo hanno evidenziato effetti tossici sul feto non confermati da studi clinici in donne esposte nel primo trimestre di gravidanza e per i quali non c’è evidenza di danno nelle fasi tardive della gravidanza.<ref>{{Cita web | autore = | titolo = FDA Pregnancy Categories | url = http://depts.washington.edu/druginfo/Formulary/Pregnancy.pdf |
La [[Food and Drug Administration]] ha inserito etanercept in classe B per l’uso in gravidanza. Nella classe B sono inseriti i farmaci per i quali sono disponibili solo studi preclinici in vivo che non hanno evidenziato tossicità fetale e i farmaci i cui studi preclinici in vivo hanno evidenziato effetti tossici sul feto non confermati da studi clinici in donne esposte nel primo trimestre di gravidanza e per i quali non c’è evidenza di danno nelle fasi tardive della gravidanza.<ref>{{Cita web | autore = | titolo = FDA Pregnancy Categories | url = http://depts.washington.edu/druginfo/Formulary/Pregnancy.pdf | data = | accesso = 11 giugno 2013 }}</ref><ref>{{Cita web | autore= Onyeka Otugo |coautori= Olabode Ogundare, Christopher Vaughan, Emmanuel Fadiran, Leyla Sahin | titolo = Consistency of Pregnancy Labeling Across Different Therapeutic Classes | url = http://www.fda.gov/downloads/ScienceResearch/SpecialTopics/WomensHealthResearch/UCM308982.pdf | editore= Food and Drug Administration - Office of Women’s Health | data= 1979 | accesso = 27 giugno 2013 }}</ref><ref name="pmid8852521">{{Cita pubblicazione | cognome = Sannerstedt | nome = R. | coautori = P. Lundborg; BR. Danielsson; I. Kihlström; G. Alván; B. Prame; E. Ridley | titolo = Drugs during pregnancy: an issue of risk classification and information to prescribers. | rivista = Drug Saf | volume = 14 | numero = 2 | pagine = 69-77 | mese=febbraio| anno = 1996 | pmid = 8852521 }}</ref> |
||
Non è noto se etanercept venga escreto nel latte materno. Da sperimentazioni animali in vivo sui ratti il farmaco somministrato per via sottocutanea alla madre viene poi ritrovato nel siero dei cuccioli allattati. Poiché le [[immunoglobuline]] vengono escrete nel latte, è opportuno non assumere etanercept o sospendere l’allattamento durante il trattamento. |
Non è noto se etanercept venga escreto nel latte materno. Da sperimentazioni animali in vivo sui ratti il farmaco somministrato per via sottocutanea alla madre viene poi ritrovato nel siero dei cuccioli allattati. Poiché le [[immunoglobuline]] vengono escrete nel latte, è opportuno non assumere etanercept o sospendere l’allattamento durante il trattamento. |
||
== Interazioni == |
== Interazioni == |
||
* Farmaci anti-diabete: sono stati riportati casi di [[iperglicemia|ipoglicemia]] in soggetti trattati con farmaci per il diabete. La co-somministrazione di etanercept in questa popolazione di pazienti deve essere strettamente monitorata, ed eventualmente il medico può decidere se diminuire la dose dei farmaci ipoglicemizzanti o dell'insulina.<ref name="pmid17998221">{{Cita pubblicazione | cognome = Bonilla | nome = E. | |
* Farmaci anti-diabete: sono stati riportati casi di [[iperglicemia|ipoglicemia]] in soggetti trattati con farmaci per il diabete. La co-somministrazione di etanercept in questa popolazione di pazienti deve essere strettamente monitorata, ed eventualmente il medico può decidere se diminuire la dose dei farmaci ipoglicemizzanti o dell'insulina.<ref name="pmid17998221">{{Cita pubblicazione | cognome = Bonilla | nome = E. |coautori= YY. Lee; PE. Phillips; A. Perl | titolo = Hypoglycaemia after initiation of treatment with etanercept in a patient with type 2 diabetes mellitus. | rivista = Ann Rheum Dis | volume = 66 | numero = 12 | pagine = 1688 | mese=dicembre| anno = 2007 | doi = 10.1136/ard.2007.072256 | pmid = 17998221 }}</ref> |
||
* [[Anakinra]]: nei soggetti adulti trattati con etanercept ed anakinra è stata riscontrata una maggiore incidenza di effetti collaterali (infezioni gravi e neutropenia) rispetto a pazienti trattati in monosomministrazione con etanercept o con anakinra.<ref name="pmid15146410">{{Cita pubblicazione | cognome = Genovese | nome = MC. | coautori = S. Cohen; L. Moreland; D. Lium; S. Robbins; R. Newmark; P. Bekker | titolo = Combination therapy with etanercept and anakinra in the treatment of patients with rheumatoid arthritis who have been treated unsuccessfully with methotrexate. | rivista = Arthritis Rheum | volume = 50 | numero = 5 | pagine = 1412-9 | mese |
* [[Anakinra]]: nei soggetti adulti trattati con etanercept ed anakinra è stata riscontrata una maggiore incidenza di effetti collaterali (infezioni gravi e neutropenia) rispetto a pazienti trattati in monosomministrazione con etanercept o con anakinra.<ref name="pmid15146410">{{Cita pubblicazione | cognome = Genovese | nome = MC. | coautori = S. Cohen; L. Moreland; D. Lium; S. Robbins; R. Newmark; P. Bekker | titolo = Combination therapy with etanercept and anakinra in the treatment of patients with rheumatoid arthritis who have been treated unsuccessfully with methotrexate. | rivista = Arthritis Rheum | volume = 50 | numero = 5 | pagine = 1412-9 | mese=maggio| anno = 2004 | doi = 10.1002/art.20221 | pmid = 15146410 }}</ref> |
||
* [[Abatacept]]: nei pazienti trattati con etanercept più [[abatacept]] è stato riscontrato un incremento di incidenza di effetti collaterali (in particolare [[neutropenia]] e infezioni gravi) rispetto ai pazienti trattati solo con etanercept, in assenza di benefici terapeutici.<ref name="MedscapeAbataceptEtanercept">{{Cita web | autore = | titolo = Abatacept Plus Etanercept Should Not Be Used for Rheumatoid Arthritis Therapy | url = http://www.medscape.org/viewarticle/544158 | editore = Medscape Education | data = 05/09/2006 | accesso = 12 maggio 2013 }}</ref> |
* [[Abatacept]]: nei pazienti trattati con etanercept più [[abatacept]] è stato riscontrato un incremento di incidenza di effetti collaterali (in particolare [[neutropenia]] e infezioni gravi) rispetto ai pazienti trattati solo con etanercept, in assenza di benefici terapeutici.<ref name="MedscapeAbataceptEtanercept">{{Cita web | autore = | titolo = Abatacept Plus Etanercept Should Not Be Used for Rheumatoid Arthritis Therapy | url = http://www.medscape.org/viewarticle/544158 | editore = Medscape Education | data = 05/09/2006 | accesso = 12 maggio 2013 }}</ref> |
||
Versione delle 00:19, 24 mar 2014
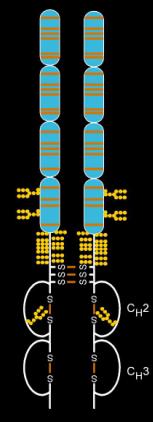
Etanercept è un farmaco per il trattamento di malattie a carattere autoimmunitario, che agisce modificando la risposta biologica dell'organismo, appartenente alla classe dei farmaci in grado di modificare il decorso della malattia (i cosiddetti DMARDs, dall'inglese Disease Modifying Antirheumatic Drugs), cioè una sostanza in grado di trasformare l'andamento e la storia naturale della malattia per la quale viene impiegata. È un composto derivato da DNA ricombinante, una immunoglobulina umana G1 (IgG1), un anticorpo monoclonale specifico ed interferente con l'attività del fattore di necrosi tumorale umano (TNF o TNF-α). Come farmaco è indicato per la cura della psoriasi, dell’artrite psoriasica dell’artrite reumatoide, della spondilite anchilosante e, potenzialmente, da qualsiasi altro processo mediato dal TNFα. In Italia il farmaco è venduto dalla società farmaceutica Amgen con il nome commerciale di Enbrel nella forma farmaceutica di siringhe preriempite con 25 o 50 mg del composto.
L’etanercept è una proteina di fusione, ottenuta tramite tecniche del DNA ricombinante, ottenuta dall'unione del recettore umano p75 per il fattore TNF-alfa con la frazione Fc dell’immunoglobulina umana IgG1. La proteina funziona da recettore solubile per il TNF-alfa e possiede un’affinità di legame per il TNF-alfa più alta di quella degli altri recettori solubili. È una molecola complessa, dall'alto peso molecolare, circa 150 KDa, che si lega al TNFα andando ad inibire la sua attività nel processo evolutivo dell'infiammazione, sia nell'uomo sia negli animali.
Usi clinici
Il farmaco è utilizzato nei soggetti con spondilite anchilosante grave, con artrite psoriasica in fase attiva e progressiva, con psoriasi a placche da moderata a grave. Al farmaco si ricorre in caso di risposta insoddisfacente alla terapia convenzionale, oppure nei soggetti che presentano una controindicazione o sono intolleranti ad altre terapie sistemiche. Nei soggetti adulti etanercept trova anche indicazione nel trattamento dell'artrite reumatoide in fase attiva, da moderata a grave, in associazione con metotrexato. Alla terapia di associazione si ricorre quando la risposta ai farmaci antireumatici modificanti la malattia (DMARDs), compreso lo stesso metotrexato, è risultata insoddisfacente. Ad etanercept si può ricorrere anche in caso di intolleranza al metotrexato oppure in quei pazienti in cui il trattamento continuo con il metotrexato non è appropriato. Esso è anche indicato nel trattamento dell'artrite reumatoide grave, attiva e progressiva negli adulti precedentemente non trattati con metotrexato. In questa popolazione, l'etanercept ha mostrato di rallentare la progressione del danno strutturale associato alla malattia misurato radiologicamente.
Popolazione pediatrica
Il farmaco è autorizzato per la terapia della psoriasi a placche cronica grave nei bambini (a partire dagli 8 anni d’età) e negli adolescenti in cui la malattia non è adeguatamente controllata da altre terapie sistemiche o fototerapie, così come in quei soggetti in età pediatrica che sono intolleranti a queste ultime.
Effetti collaterali ed indesiderati
| Tipi di reazioni | Comuni (>1/100, <1/10) | Non comuni (>1/1.000, <1/100) |
Rare (>1/10.000, <1/1.000) |
Molto rare (<1/10.000) | Frequenza non nota |
|---|---|---|---|---|---|
| Infezioni ed infestazioni |
|
|
|
||
| Alterazioni del sistema ematico e linfatico |
|
|
|
||
| Alterazioni del sistema immunitario |
|
|
| ||
| Alterazioni del sistema nervoso |
|
||||
| Alterazioni dell’occhio |
|
||||
| Patologie respiratorie, toraciche e mediastiniche |
|
||||
| Patologie gastro-intestinali |
| ||||
| Patologie epato-biliari |
|
||||
| Patologie della cute e del tessuto sottocutaneo: |
|
|
|
||
| Patologie sistema muscoloscheletrico e del tessuto connettivo |
|
Malattia infiammatoria cronica intestinale
Nei pazienti affetti da artrite giovanile idiopatica in cura con etanercept si sono verificati diversi casi di malattia infiammatoria intestinale (malattia di Crohn, pancoliti). L'analisi dei registri europei (dal 1999 al 2008) sembra evidenziare una correlazione tra l’insorgenza della malattia infiammatoria intestinale e l’uso di etanercept. In diversi studi su soggetti con artrite giovanile idiopatica l’incidenza della malattia è risultata più elevata,[1] fino a 43 volte superiore rispetto alla popolazione pediatrica generale[2]
Infezioni sistemiche
Il Tumor Necrosis Factor alfa (TNFalfa) ha un ruolo fondamentale nella risoluzione delle infezioni intracellulari, la sua inibizione potrebbe compromettere le difese immunitarie dell’ospite. La sua soppressione può mascherare i sintomi di un’infezione e renderne più difficoltosa la diagnosi e il successivo trattamento. Nel corso di terapia con etanercept i pazienti devono essere monitorati per il rischio di sviluppare infezioni, in particolare quelli con anamnesi di infezioni ricorrenti e coloro che vivono in zone in cui infezioni quali istoplasmosi e coccidiomicosi sono comuni. In alcuni casi le infezioni sviluppatesi durante la terapia con etanercept hanno avuto esito fatale. In pazienti trattati con etanercept sono state segnalate tubercolosi (tubercolosi miliari, tubercolosi con localizzazione extrapolmonare), sepsi,[3][4][5][6] aspergillosi,[7][8] pneumocistosi, istoplasmosi.[9][10][11][12]
Infezione tubercolare latente
La riattivazione di un'infezione latente da Mycobacterium tuberculosis è una tipica complicanza dei trattamenti con gli inibitori del TNFalfa, meno frequente con etanercept rispetto a infliximab e adalimumab.(Tubach et al., 2009). Per questo motivo prima di iniziare il trattamento con etanercept si deve escludere la presenza di tubercolosi in fase attiva mediante anamnesi accurata del paziente, test cutaneo con tubercolina e radiografia del torace.
Infezione da virus Herpes zoster
La somministrazione di etanercept è stata associata a riattivazione dell’infezione da Herpes zoster in pazienti con artrite reumatoide.[13] In caso di infezione o riattivazione dell’infezione, l’etanercept deve essere immediatamente sospeso e il paziente sottoposto a terapia antivirale.
Neoplasie maligne e disordini linfoproliferativi
Nei trial clinici in pazienti trattati con inibitori del TNF-alfa, l’incidenza di neoplasie maligne, ed in particolare di linfoma, è risultata maggiore rispetto al gruppo di controllo. Studi effettuati sul profilo di sicurezza di etanercept hanno riscontrato una maggiore incidenza dello sviluppo di linfoma nella popolazione pediatrica trattata con l’inibitore del TNF-alfa rispetto alla popolazione pediatrica generale.[14] Sulla base dei dati di letteratura e delle segnalazioni postmarketing raccolte, nell’aprile del 2011 la FDA ha iniziato un’analisi del profilo di sicurezza, relativamente al rischio di tumore, dei farmaci anti-TNF nei pazienti con età uguale o inferiore a 30 anni.[15]
Controindicazioni
Etanercept è controindicato nei soggetti con ipersensibilità al principio attivo oppure ad uno qualsiasi degli eccipienti utilizzati nella formulazione farmaceutica. È inoltre controindicato nei pazienti con qualsiasi infezione attiva, infezione cronica o localizzata, e nei soggetti con sepsi oppure a rischio di sepsi. Etanercept è controindicato nei pazienti pediatrici con artrite giovanile idiopatica poliarticolare e nei bambini con psoriasi a placche di età inferiore ai 6 anni.
Granulomatosi di Wegener
Etanercept non è raccomandato nel trattamento della granulomatosi di Wegener in quei soggetti che sono già in cura con farmaci citotossici. In questa forma di vasculite autoimmune necrotizzante dei vasi di piccolo e medio calibro, sono stati condotti degli studi per determinare l'efficacia del farmaco e l'eventuale correlazione tra l’utilizzo dell'inibitore del TNF-α e l’insorgenza di tumori solidi. Etanercept non si è dimostrato efficace nel mantenere la remissione nei pazienti con granulomatosi di Wegener.[16] Inoltre in un trial (Wegener's Granulomatosis Etanercept Trial-WGET) comprendente 180 pazienti, metà dei quali in terapia con etanercept e metà con placebo, sono comparsi 13 nuovi tumori solidi, di cui 8 nel gruppo trattato con etanercept e 5 nel gruppo trattato con placebo. Il rischio di insorgenza di neoplasie solide nei pazienti trattati con etanercept è risultato maggiore rispetto alla popolazione generale, e lo è in particolare in coloro già trattati precedentemente con ciclofosfamide, così come, più in generale, il rischio di insorgenza di tumori solidi sembra aumentare nei soggetti già trattati anche con farmaci citotossici.[17][18]
Gravidanza e allattamento
Studi sperimentali in vivo su ratti e conigli non hanno evidenziato alcuna prova di danno od effetti tossici sulla prole. La mancanza di dati certi in letteratura medica inerenti l’uso del farmaco in gravidanza comporta l’uso di valide misure contraccettive per tutta la durata della terapia e fino a tre settimane dopo la cessazione della stessa. La Food and Drug Administration ha inserito etanercept in classe B per l’uso in gravidanza. Nella classe B sono inseriti i farmaci per i quali sono disponibili solo studi preclinici in vivo che non hanno evidenziato tossicità fetale e i farmaci i cui studi preclinici in vivo hanno evidenziato effetti tossici sul feto non confermati da studi clinici in donne esposte nel primo trimestre di gravidanza e per i quali non c’è evidenza di danno nelle fasi tardive della gravidanza.[19][20][21]
Non è noto se etanercept venga escreto nel latte materno. Da sperimentazioni animali in vivo sui ratti il farmaco somministrato per via sottocutanea alla madre viene poi ritrovato nel siero dei cuccioli allattati. Poiché le immunoglobuline vengono escrete nel latte, è opportuno non assumere etanercept o sospendere l’allattamento durante il trattamento.
Interazioni
- Farmaci anti-diabete: sono stati riportati casi di ipoglicemia in soggetti trattati con farmaci per il diabete. La co-somministrazione di etanercept in questa popolazione di pazienti deve essere strettamente monitorata, ed eventualmente il medico può decidere se diminuire la dose dei farmaci ipoglicemizzanti o dell'insulina.[22]
- Anakinra: nei soggetti adulti trattati con etanercept ed anakinra è stata riscontrata una maggiore incidenza di effetti collaterali (infezioni gravi e neutropenia) rispetto a pazienti trattati in monosomministrazione con etanercept o con anakinra.[23]
- Abatacept: nei pazienti trattati con etanercept più abatacept è stato riscontrato un incremento di incidenza di effetti collaterali (in particolare neutropenia e infezioni gravi) rispetto ai pazienti trattati solo con etanercept, in assenza di benefici terapeutici.[24]
Avvertenze
Anamnesi pre-terapeutica: prima di somministrare etanercept effettuare una anamnesi accurata per infezioni croniche o recidivanti, tubercolosi (incluso fattori di rischio per TBC), vaccinazione recente con vaccini vivi attenuati, tumori maligni, gravidanza. Per accertare o escludere la presenza di infezione tubercolare, è indicato sottoporsi all’intradermoreazione secondo Mantoux (inoculazione sottocute di tubercolina PPD, derivato proteico purificato) ed effettuare una radiografia del torace, soprattutto per le categorie più a rischio di contrarre l’infezione tubercolare (bambini, anziani, diabetici, pazienti immunodepressi, operatori sanitari)[25].
Anticorpi anti-etanercept: la terapia con etanercept è stata associata alla comparsa, nel siero, di anticorpi anti-etanercept non neutralizzanti. Studi clinici hanno constatato la comparsa di anticorpi nel 6% dei pazienti in terapia con l’inibitore del TNFalfa. Non è stata ancora accertata la correlazione causa-effetto tra la presenza degli anticorpi non neutralizzanti e la comparsa di eventi avversi[25].
Epatite B: la somministrazione di etanercept in pazienti con epatite cronica B richiede cautela e monitoraggio attento perché sono stati riportati casi di riattivazione del virus epatico. In caso di riattivazione dell’epatite è necessaria l’interruzione del trattamento con etanercept e l’inizio di un’adeguata terapia antivirale. L’utilizzo di più farmaci immunosoppressori può contribuire alla riattivazione del virus nei pazienti sottoposti a terapia concomitante con etanercept[25].
Epatite C: sulla base dei dati di letteratura attualmente disponibili (limitati), la somministrazione di etanercept non sembra comportare un peggioramento dell’epatite C cronica (Brunasso et al., 2011). In caso di infezione in atto, la terapia antivirale non richiede la sospensione di etanercept[25].
Epatite correlata all’abuso di alcol: la somministrazione di etanercept in pazienti con epatite alcolica da moderata a grave deve essere attentamente monitorata. Uno studio condotto su 48 pazienti trattati con etanercept o placebo, ha rilevato un tasso di mortalità superiore nei pazienti trattati con etanercept dopo 6 mesi di trattamento rispetto al placebo[26].
Terapia immunosoppressiva: somministrare con cautela etanercept in pazienti che ricevono terapie che inducono immunosoppressione per il rischio di infezione. Questo aspetto deve essere tenuto in considerazione soprattutto quando i pazienti in trattamento sono anziani[25].
Vaccinazione: la somministrazione di etanercept nelle quattro settimane che seguono la vaccinazione con vaccini vivi attenuati è controindicata. Il problema relativo alle vaccinazioni riguarda soprattutto i pazienti pediatrici. I vaccini vivi attenuati comprendono: il vaccino morbillo-parotite-rosolia, il vaccino intranasale per l’influenza Fluenz, il vaccino orale per il tifo, BCG, febbre gialla e antrace. Questi vaccini andrebbero somministrati prima del trattamento con etanercept. Poiché sono stati segnalati casi di varicella durante terapie con farmaci biologici anti-TNFalfa, anche questo vaccino andrebbe somministrato prima del trattamento con etanercept e comunque non durante terapia immunosoppressiva[25].
Insufficienza cardiaca: la somministrazione di etanercept in caso di pazienti con insufficienza cardiaca richiede cautela, poiché sono stati riscontrati dei casi di peggioramento della malattia o insorgenza di insufficienza cardiaca congestizia[27]
Tossicità centrale: gli inibitori del TNF-alfa sono stati associati, in rari casi, a neurite ottica, convulsioni, comparsa e/o esacerbazioni di patologie demielinizzanti inclusa la sclerosi multipla. Somministrare etanercept con cautela in caso di pazienti con patologie demielinizzanti preesistenti o di recente manifestazione[25].
Neonati e nati prematuri: le specialità medicinali a base di etanercept che contengono alcol benzilico non devono essere somministrate ai neonati o ai bambini nati prematuramente. L’alcol benzilico infatti può causare gravi eventi avversi nella popolazione neonatale (reazioni allergiche e tossiche)[25].
Reazioni allergiche: in caso di reazioni allergiche, sospendere la somministrazione di etanercept. La somministrazione di etanercept deve essere monitorata, nel caso il paziente risulti avere un’ipersensibilità accertata o possibile al lattice (gomma naturale essiccata) dato che il cappuccio che ricopre l’ago è costituito da tale materiale[28].
Altri progetti
 Wikimedia Commons contiene immagini o altri file su Etanercept
Wikimedia Commons contiene immagini o altri file su Etanercept
Note
- ^ A. Dallocchio, D. Canioni; F. Ruemmele; A. Duquesne; JY. Scoazec; R. Bouvier; F. Paraf; J. Languepin; CH. Wouters; M. Guillot; P. Quartier, Occurrence of inflammatory bowel disease during treatment of juvenile idiopathic arthritis with etanercept: a French retrospective study., in Rheumatology (Oxford), vol. 49, n. 9, settembre 2010, pp. 1694-8, DOI:10.1093/rheumatology/keq136, PMID 20472717.
- ^ TD. van Dijken, SJ. Vastert; VM. Gerloni; I. Pontikaki; K. Linnemann; H. Girschick; W. Armbrust; K. Minden; FH. Prince; FT. Kokke; EE. Nieuwenhuis, Development of inflammatory bowel disease in patients with juvenile idiopathic arthritis treated with etanercept., in J Rheumatol, vol. 38, n. 7, luglio 2011, pp. 1441-6, DOI:10.3899/jrheum.100809, PMID 21459936.
- ^ M. Baghai, DR. Osmon; DM. Wolk; LE. Wold; GJ. Haidukewych; EL. Matteson, Fatal sepsis in a patient with rheumatoid arthritis treated with etanercept., in Mayo Clin Proc, vol. 76, n. 6, Giu 2001, pp. 653-6, DOI:10.4065/76.6.653, PMID 11393506.
- ^ A. Kling, T. Mjörndal; S. Rantapää-Dahlqvist, Sepsis as a possible adverse drug reaction in patients with rheumatoid arthritis treated with TNFalpha antagonists., in J Clin Rheumatol, vol. 10, n. 3, giugno 2004, pp. 119-22, DOI:10.1097/01.rhu.0000128734.07926.8e, PMID 17043483.
- ^ C. Nuñez-Cornejo, J. Borrás-Blasco; A. Gracia-Perez; JD. Rosique-Robles; V. Lopez-Camps; E. Casterã; FJ. Abad, Septic shock and community-acquired pneumonia associated with etanercept therapy., in Int J Clin Pharmacol Ther, vol. 46, n. 4, aprile 2008, pp. 193-7, PMID 18397693.
- ^ N. Ikumi, Y. Matsukawa; Y. Kuwana; H. Kodaira; T. Tanaka; N. Maruyama; S. Nozawa; A. Horikoshi; J. Takeuchi, Staphylococcus aureus sepsis after etanercept induction in a hemodialysis patient., in Hemodial Int, vol. 17, n. 1, gennaio 2013, pp. 133-5, DOI:10.1111/j.1542-4758.2012.00723.x, PMID 22742581.
- ^ S. Lassoued, S. Sire; M. Farny; T. Billey; K. Lassoued, Pulmonary aspergillosis in a patient with rheumatoid arthritis treated by etanercept., in Clin Exp Rheumatol, vol. 22, n. 2, pp. 267-8, PMID 15083902.
- ^ EJ. Lee, R. Song; JN. Park; YA. Lee; JS. Son; SJ. Hong; HI. Yang; SH. Lee, Chronic necrotizing pulmonary aspergillosis in a patient treated with a tumor necrosis factor-alpha inhibitor., in Int J Rheum Dis, vol. 13, n. 3, agosto 2010, pp. e16-9, DOI:10.1111/j.1756-185X.2010.01528.x, PMID 20704604.
- ^ JH. Lee, NR. Slifman; SK. Gershon; ET. Edwards; WD. Schwieterman; JN. Siegel; RP. Wise; SL. Brown; JN. Udall; MM. Braun, Life-threatening histoplasmosis complicating immunotherapy with tumor necrosis factor alpha antagonists infliximab and etanercept., in Arthritis Rheum, vol. 46, n. 10, ottobre 2002, pp. 2565-70, DOI:10.1002/art.10583, PMID 12384912.
- ^ NR. Slifman, SK. Gershon; JH. Lee; ET. Edwards; MM. Braun, Listeria monocytogenes infection as a complication of treatment with tumor necrosis factor alpha-neutralizing agents., in Arthritis Rheum, vol. 48, n. 2, febbraio 2003, pp. 319-24, DOI:10.1002/art.10758, PMID 12571839.
- ^ JF. Colombel, EV. Loftus; WJ. Tremaine; LJ. Egan; WS. Harmsen; CD. Schleck; AR. Zinsmeister; WJ. Sandborn, The safety profile of infliximab in patients with Crohn's disease: the Mayo clinic experience in 500 patients., in Gastroenterology, vol. 126, n. 1, gennaio 2004, pp. 19-31, PMID 14699483.
- ^ J. Bourré-Tessier, C. Fortin; A. Belisle; E. Desmarais; D. Choquette; JL. Senécal, Disseminated Histoplasma capsulatum infection presenting with panniculitis and focal myositis in rheumatoid arthritis treated with etanercept., in Scand J Rheumatol, vol. 38, n. 4, 2009, pp. 311-6, DOI:10.1080/03009740902776935, PMID 19444717.
- ^ A. Strangfeld, J. Listing; P. Herzer; A. Liebhaber; K. Rockwitz; C. Richter; A. Zink, Risk of herpes zoster in patients with rheumatoid arthritis treated with anti-TNF-alpha agents., in JAMA, vol. 301, n. 7, febbraio 2009, pp. 737-44, DOI:10.1001/jama.2009.146, PMID 19224750.
- ^ P. McCroskery, CA. Wallace; DJ. Lovell; S. Stryker; N. Chernyukhin; C. Blosch; DJ. Zack, Summary of worldwide pediatric malignancies reported after exposure to etanercept., in Pediatr Rheumatol Online J, vol. 8, 2010, p. 18, DOI:10.1186/1546-0096-8-18, PMID 20546618.
- ^ FDA Drug Safety Communication: UPDATE on Tumor Necrosis Factor (TNF) blockers and risk for pediatric malignancy, su fda.gov, Food and Drug Administration, 11 marzo 2011. URL consultato il 12 giugno 2013.
- ^ Wegener's Granulomatosis Etanercept Trial (WGET) Research Group., Etanercept plus standard therapy for Wegener's granulomatosis., in N Engl J Med, vol. 352, n. 4, gennaio 2005, pp. 351-61, DOI:10.1056/NEJMoa041884, PMID 15673801.
- ^ JH. Stone, JT. Holbrook; MA. Marriott; AK. Tibbs; LP. Sejismundo; YI. Min; U. Specks; PA. Merkel; R. Spiera; JC. Davis; EW. St Clair, Solid malignancies among patients in the Wegener's Granulomatosis Etanercept Trial., in Arthritis Rheum, vol. 54, n. 5, Mag 2006, pp. 1608-18, DOI:10.1002/art.21869, PMID 16646004.
- ^ F. Silva, P. Seo; DR. Schroeder; JH. Stone; PA. Merkel; GS. Hoffman; R. Spiera; JK. Sebastian; JC. Davis; EW. St Clair; NB. Allen, Solid malignancies among etanercept-treated patients with granulomatosis with polyangiitis (Wegener's): long-term followup of a multicenter longitudinal cohort., in Arthritis Rheum, vol. 63, n. 8, Ago 2011, pp. 2495-503, DOI:10.1002/art.30394, PMID 21484770.
- ^ FDA Pregnancy Categories (PDF), su depts.washington.edu. URL consultato l'11 giugno 2013.
- ^ Onyeka Otugo, Olabode Ogundare, Christopher Vaughan, Emmanuel Fadiran, Leyla Sahin, Consistency of Pregnancy Labeling Across Different Therapeutic Classes (PDF), su fda.gov, Food and Drug Administration - Office of Women’s Health, 1979. URL consultato il 27 giugno 2013.
- ^ R. Sannerstedt, P. Lundborg; BR. Danielsson; I. Kihlström; G. Alván; B. Prame; E. Ridley, Drugs during pregnancy: an issue of risk classification and information to prescribers., in Drug Saf, vol. 14, n. 2, febbraio 1996, pp. 69-77, PMID 8852521.
- ^ E. Bonilla, YY. Lee; PE. Phillips; A. Perl, Hypoglycaemia after initiation of treatment with etanercept in a patient with type 2 diabetes mellitus., in Ann Rheum Dis, vol. 66, n. 12, dicembre 2007, p. 1688, DOI:10.1136/ard.2007.072256, PMID 17998221.
- ^ MC. Genovese, S. Cohen; L. Moreland; D. Lium; S. Robbins; R. Newmark; P. Bekker, Combination therapy with etanercept and anakinra in the treatment of patients with rheumatoid arthritis who have been treated unsuccessfully with methotrexate., in Arthritis Rheum, vol. 50, n. 5, maggio 2004, pp. 1412-9, DOI:10.1002/art.20221, PMID 15146410.
- ^ Abatacept Plus Etanercept Should Not Be Used for Rheumatoid Arthritis Therapy, su medscape.org, Medscape Education, 05/09/2006. URL consultato il 12 maggio 2013.
- ^ a b c d e f g h Pharmamedix: Etanercept http://www.pharmamedix.com/principiovoce.php?pa=Etanercept&vo=Avvertenze
- ^ Nicholas C. et al., Gastroenterology., 2008, 135 (6), 1953
- ^ Sànchez Carazo J.L. et al., Drug Saf., 2006, 29 (8), 675
- ^ Scheda Prodotto Enbrel, 2012, disponibile online: http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/000262/human_med_000764.jsp&mid=WC0b01ac058001d124