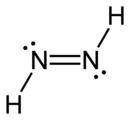
Utente:Grasso Luigi/sanbox1/diazene
| Diazina | |
|---|---|
 | |
| Nome IUPAC | |
| Dinitrogeno di diazoto [1] | |
| Nomi alternativi | |
| Diazene, diimide | |
| Caratteristiche generali | |
| Massa molecolare (u) | 30.02936 gm mole-1 |
| Numero CAS | Immagine_3D |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| attenzione | |
| Frasi H | --- |
| Consigli P | --- |
La diazina, anche detta diimide o diimina nel caso di composti organici, è un composto inorganico dell'azoto con l'idrogeno con formula chimica N2H2 con un legame doppio N=N , a differenza dell'idrazina con un legame semplice N-N. Il termine diazina è più usato per derivati organici del termine diimide. Quindi, azobenzene (C6H5N2C6H5) è un esempio di diazina organica.
La diazina forma la struttura di base dei composti organici detti azoici. È instabile a temperatura ambiente. La diazina metastabile pura, solida, al di sotto di -180 °C ha un colore giallo brillante. Il composto non è sublimabile, è molto sensibile alla luce e si decompone con sproporzione in azoto e idrazina.
2N2H2 → N2 + N2H4
Struttura[modifica | modifica wikitesto]
Esiste in due isomeri geometrici, E (trans) e Z (cis) e un isomero strutturale detto iso.
Struttura del composto E/trans-diazina
|
Struttura del composto Z/cis-diazina
|
Struttura del composto iso-diazina
|
Sintesi e rivelazione[modifica | modifica wikitesto]
Il metodo std per produrre diazina è l'ossidazione dell'idrazina con il perossido di idrogeno (H2O2) o con aria. [2]
Un'altro metodo è la decarbossilazione dell'acido azodicarbossilico (HOOC-N=N-COOH) secondo la reazione chimica:[3]
- (NCOOH)2 → (NH)2 + 2 CO2
Oppure per eliminazione di sulfonoidrazide (un gruppo di composti organici con struttura R - SO2-NH-NH2) usando una base di Lewis adatta. Ad esempio, utilizzando l'idrazide 2,4,6-triisopropilbenzenesulfonoidrazide:
(CH3CHCH3)3C6H2-SO2-NH-NH2
e trattandola con la base bicarbonato di sodio (NaHCO3) si elimina la diazina.
Essendo un composto instabile, la diazina viene generata e usata in-situ. Viene prodotta una miscela sia di isomeri cis (Z-) che trans (E-). Questi sono instabili, e subiscono una lenta interconversione. L'isomero trans è più stabile, ma l'isomero cis è quello che reagisce con substrati insaturi, quindi l'equilibrio va in direzione dell'isomero cis per il principio di Le Chatelier. Alcune procedure richiedono l'aggiunta di acido carbossilico, che catalizzano l'isomerizzazione cis-trans.[4] La diazina si decompone subito. Inoltre a basse temperature (ca. -130°C), l'isomero più stabile trans subisce rapidamente varie reazioni di disproporzione, formando primariamente idrazina e gas di azoto: [3]
- 2 HN=NH → H2N–NH2 + N2
A causa di questa reazione di decomposizione a competere, le riduzioni con diazina solitamente richiedono una forte quantita del reagente precursore.
Rivelazione[modifica | modifica wikitesto]
La sostanza fu isolata per la prima volta nel 1972 da Nils Wiberg e collaboratori. In questo caso, una termolisi del composto sodio tosilidrazide (un composto organico del genere sulfonoidrazide) è stata effettuata sotto vuoto a 60 °C. La tosilidrazide fu decomposta con resa dell'80% in diazina e toluensolfato di sodio (formula Na(SO2C6H4CH3) ). La diazina è stata depositata come un rivestimento giallo brillante a -196 ° C su uno strumento di laboratorio detto cold-finger. La rilevazione nel gas era la spettrometria di massa. La preparazione è anche riuscita con altre tosilidrazidi di metalli alcalini, ma con una resa inferiore. [5]
La diazina si può rivelare tramite reazioni chimiche come la stereospecifica, quella molto selettiva della cis-idrogenazione dei legami C=C tramite idrazina e un ossidante, inoltre si può rivelare tramite spettrometria di massa nella decomposizione in fase gassosa sia di ammoniaca (NH3) e di idrazina (N2H4) su superficie di rodio.[6]
Applicazioni[modifica | modifica wikitesto]
Sintesi organica[modifica | modifica wikitesto]
La diazina a volte è utile come reagente in sintesi organica.[4]
Questa idrogenica alcheni e alchini con selettivo rilascio di idrogeno da una parte del substrato dovuta alla stereoselettivita come aggiunta di H2 catalizzata dal metallo syn. L'unico coprodotto rilasciato è gas di azoto (N2). Sebbene sia un sistema con attrezzi ingombranti, l'utilizzo della diazina annulla la necessità di pressioni alte quando si usa il gas idrogeno e un catalizzatore metallico, che sono metodi costosi.[7]
Il meccanismo di idrogenazione implica uno stato di transizione con sei membri (C2H2N2):
Riduzione selettiva[modifica | modifica wikitesto]
La diazina offre il vantaggio di riduzione selettiva di alcheni e alchini e non reagisce verso molti gruppi funzionali che possono influenzare il processo di idrogenazione catalitica. Quindi, perossidi, alogenuri alchilici, e tioli sono tollerati dalla diazina, ma possono essere di solito degradati dai catalizzatori metallici. Il reagente tende a ridurre alchini e alcheni senza ostacoli o vincoli[2] al corrispondente alchene e alcano.[4]
Composti derivati[modifica | modifica wikitesto]
Inorganici[modifica | modifica wikitesto]
- Un derivato della diazina è l'acido iponitroso detto pure diazendiolo (H2N2O2).
- Il composto gassoso difluoro diazoto o difluorodiazina (N2F2). Ha la struttura F−N=N−F ed ha isomeri geometrici.
Organici[modifica | modifica wikitesto]
- Gli azocomposti acidi come l'acido azodicarbossilico o diazindicarbossilico ( COOH-N=N-COOH oppure N2(COOH)2 ) o le loro ammidi ed esteri stabili,ad esempio dietil azodicarbossilato ( C2H5-COO-N=N-COO-C2H5 oppure C6H10N2O4 ).
- Sono noti anche gli azosilani, come la trans-bis (trimetilsilil) diimmina ( (CH3)3Si-N=N-Si(CH3)3 ).
Ioni correlati[modifica | modifica wikitesto]
La diazina possiede una certa tendenza a protonarsi; a seconda dei casi può subire una protonazione singola o doppia con la formazione rispettivamente del catione diazinio e del diazinio dicatione.
Diazinio[modifica | modifica wikitesto]
Lo ione diazinio ha formula chimica N2H+3 con le strutture:
presenta una carica positiva dislocata sull'atomo di azoto derivato dalla protonazione della diazina
- H-N=N-H + H+ → H2N+=N-H
Diazinio dicatione[modifica | modifica wikitesto]
Lo ione diazinio dicatione ha formula chimica N2H2+4 con le strutture:
presenta due cariche positive nette dislocate sugli atomi di azoto, cariche che derivano dalla doppia protonazione della diazina
- H-N=N-H + 2H+ → H2N+=N+H2
Confrontandoli con lo diazonio dicatione, HNNH2+, questi ammette il più forte legame chimico
conosciuto. Questo ione proviene da una doppia protonazione della molecola di azoto.
L' ordine della forza legame relativa (RBSO) è di 3.38.[8]
Gli unici ioni conosciuti, i dicationi diazoidrofluoronio e diazofluoronio FNNH2+ and FNNF2+, ammettono una forza di legame leggermente minore. [8]
Note[modifica | modifica wikitesto]
- ^ Nomenclature of Inorganic Chemistry : IUPAC Recommendations 2005 (Red Book), Cambridge, The Royal Society of Chemistry, 2005, p. 315, ISBN 978-0-85404-438-2.
- ^ a b cis-Cyclododecene, Organic Syntheses, 1973.
- ^ a b 1.2.7: Diimine, N2H2, in Inorganic Chemistry, Elsevier, 2001, p. 628, ISBN 9780123526519.
- ^ a b c D. J. Pasto, Diimide, in Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, 2001, DOI:10.1002/047084289X.rd235.
- ^ Nils Wiberg, Heinz Bachhuber, Gerd Fischer: Isolamento della diimina, Angewandte Chemie, 84. Jahrg. 1972, Nr. 18, S. 889, DOI: 10.1002/ange.19720841808
- ^ The Journal of the American Chemical Society, vol. 113, 1991, p. 1577.
- ^ Miller, C. E., Hydrogenation with Diimide, in Journal of Chemical Education, vol. 42, n. 5, 1965, pp. 254–259, DOI:10.1021/ed042p254.
- ^ a b Identification of the Strongest Bonds in Chemistry, in The Journal of Physical Chemistry A, vol. 117, n. 36, 12 September 2013, pp. 8981–8995, DOI:10.1021/jp406200w.
Bibliografia[modifica | modifica wikitesto]
- Cotton F., Wilkinson G., Murillo C., Bochmann M., Advanced inorganic chemistry, Wiley&Sons, 1999, ISBN 0-471-19957-5.
Altri progetti[modifica | modifica wikitesto]