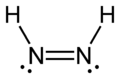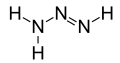Azani

Gli azani[1][2] sono composti binari saturi e aciclici dell'azoto trivalente con l'idrogeno.[3] Consistono infatti di catene di atomi di azoto uniti tra loro da legami singoli e che completano le valenze rimanenti con atomi di idrogeno, non diversamente dalla formazione degli alcani da carbonio e idrogeno. Quindi, gli azani sono idruri di azoto[4] e comprendono una serie omologa di composti inorganici aventi formula chimica generale NnHn+2.[3]
Conformemente alla definizione, ciascun atomo di azoto forma tre legami (legami N-H e N-N), e ciascun atomo di idrogeno è unito a un atomo di azoto (legami H-N). Una catena di atomi di azoto (N-N-N ... -N) collegati costituiscono lo scheletro di azoto della molecola.[2] Il numero atomi di azoto viene utilizzato per definire la dimensione dell'azano.
L'azano più semplice possibile (la molecola capostipite) è l'ammoniaca, NH3. Il secondo, il diazano, è la nota idrazina H2N-NH2. Non ci sono limiti formali al numero di atomi di azoto che si possono collegare tra di loro, sebbene la stabilità dei composti risultanti limiti fortemente e rapidamente la lunghezza delle catene e questo a marcata differenza da quanto avviene per gli alcani in chimica organica.[1]
Classificazione della struttura[modifica | modifica wikitesto]
Gli azani possono essere:
- Lineari (formula generale NnHn + 2) in cui gli atomi di azoto sono uniti in un'unica catena.
- Ramificati (formula generale NnHn + 2, n > 3) in cui lo scheletro di azoto si divide in due o più rami.
Secondo la definizione IUPAC, gli analoghi composti ciclici vengono detti cicloazani ed hanno formula generale NnHn, con n > 2, in cui la la catena di atomi di azoto è collegata in modo da formare un anello. I composti binari di H e N saturi possono essere pure una combinazione della struttura lineare, ciclica (anche policiclica), e ramificata.
Isomeria[modifica | modifica wikitesto]
Gli azani con più di tre atomi di azoto possono essere disposti in modi diversi, formando isomeri strutturali. Il più semplice isomero è quello di atomi azoto disposti in una catena singola senza rami. Questo isomero è detto n-isomero (n per "normale", anche se non è sempre il più comune). Tuttavia la catena di atomi di azoto può anche essere ramificata su uno o più punti. Il numero di possibili isomeri incrementa rapidamente al crescere degli atomi di azoto.
A causa della bassa energia di inversione ad ombrello degli atomi di azoto, gli azani ramificati non sostituiti non possono mostrare chiralità.
Nomenclatura[modifica | modifica wikitesto]
La nomenclatura IUPAC ha una denominazione sistematica dei composti dell'azoto mediante l'identificazione delle catene di azoto, in analogia alla nomenclatura degli alcani.
Gli idruri di azoto saturi e non saturi sono denominati con un prefisso numerico greco per il numero di atomi azoto e il suffisso "-azano" per quelli saturi, o "-azene" per quelli con legami doppi.[5]
Azani a molecola lineare[modifica | modifica wikitesto]
Gli azani a catena lineare sono indicati pure con un prefisso n- (per normale) quando esistono isomeri non-lineari. Sebbene non sia strettamente necessario, l'uso di premettere la n- al nome è comune nei casi in cui vi è una differenza importante nelle proprietà tra l'isomero lineare e gli isomeri a catena ramificata.
I primi membri della serie (in ordine del numero atomi di azoto) sono denominati come segue:
- azano[6] (ammoniaca), NH3 - 1 atomo N e 3 atomi H
- diazano[7] (idrazina), N2H4 - 2 atomi N e 4 atomi H
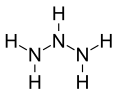
- triazano,[7] N3H5 - 3 atomi N e 5 atomi H
- tetrazano,[7] N4H6 - 4 atomi N e 6 atomi H
-
(mono) azano
-
Diazano
-
Triazano
-
Tetrazano
Gli azani, a partire dal secondo, sono denominati premettendo l'appropriato prefisso numerico greco ad azano. Quindi, diazano, N2H4; triazano, N3H5; tetrazano o tetraazano, N4H6; pentazano o pentaazano, N5H7; esazano o esaazano, N6H8; etc. Il prefisso è generalmente greco, con l'eccezione di nonaazano che ha un prefisso Latino, undecaazano e tridecaazano che hanno un prefisso a lingua-mista.
Idruri di azoto con doppio legame (Azeni) a molecola lineare[modifica | modifica wikitesto]
In analogia agli alcheni in chimica organica, si usa denominare azeni gli idruri di azoto a catena-lineare contenenti un doppio legame; anch'essi sono indicati con un prefisso n- (per normale) quando esistono isomeri non-lineari.
I primi membri della serie (in ordine del numero atomi di azoto) sono denominati come segue:
- diazene, N2H2 - 2 atomo N e 2 atomi H
- triazene, N3H3 - 3 atomi N e 3 atomi H
- tetrazene, N4H4 - 4 atomi N e 4 atomi H
- pentazene, N5H5 - 5 atomi N e 5 atomi H
-
Diazene
-
Triazene
-
Tetrazene
-
Pentazene
Pericoli[modifica | modifica wikitesto]
L'ammoniaca è esplosiva quando mista con aria (15 – 25%). Anche altri azani possono formare miscele esplosive con l'aria. Gli azani liquidi più leggeri sono altamente infiammabili; questo rischio aumenta con la lunghezza della catena dell'azoto. L'ammoniaca è più leggera dell'aria, ed ha possibilità di accumulo sui soffitti.
Organoazani[modifica | modifica wikitesto]
Gli organoazani sono un gruppo di composti chimici derivati da azani contenenti uno o più gruppi organici. Sono un sottoinsieme della classe generale dei composti organoazoto, anche se la distinzione non è spesso fatta. Quindi le ammine, le alchil- o aril- idrazine sono un sottoinsieme degli organoazani, i primi derivati dall'ammoniaca, i secondi dall'idrazina.
In aggiunta alle ammine e alle idrazine, i composti organoazoto (categoria più generale) includono pure composti come, idrazoni, immine, nitrili.
Sono note molte idrazine sostituite da radicali organici, e diverse si trovano in natura. Esempi sono:
- Monometilidrazina,CH3(NH)NH2, dove un atomo H della molecola idrazina viene sostituito con un gruppo metile (CH3). A causa della simmetria della molecola di idrazina, non importa quale atomo di idrogeno viene sostituito. A volte è usato come carburante per missili.
- 1,1-dimetilidrazina, H2NN(CH3)2, (detta pure UDMH-unsymmetrical dimethylhydrazine) e 1,2-dimetilidrazina,(CH3NH)2, (detta pure SDMH-symmetrical dimethylhydrazine) sono idrazine dove due atomi H sono sostituiti da gruppi metilici. L'UDMH è più facile da produrre rispetto alla SDMH e l'UDMH è un carburante per razzi abbastanza comune.
- Gyromitrina e agaritina sono derivati dell'idrazina trovati nelle specie di funghi Agaricus bisporus prodotte commercialmente. La gyromitrina viene metabolizzata in monometilidrazina.
- Isoniazide, iproniazide, idralazina, e fenelzina sono farmaci le cui molecole contengono strutture derivate dall'idrazina.
- 2,4-dinitrofenilidrazina (abbreviato: 2,4-DNPH) è comunemente usata per testare chetoni e aldeidi in chimica organica e chimica clinica.
- Fenilidrazina, C6H5NHNH2, la prima organoidrazina che venne isolata.
Idruri di azoto correlati e derivati[modifica | modifica wikitesto]
Relativi agli azani sono una serie omologa di gruppi funzionali, catene laterali, o radicali con la formula chimica generale -NnHn+1. Esempi sono l'azanile (-NH2) e l'idrazinile o diazanile (-N2H3). Questi gruppi sono generalmente abbreviati con i simboli -N, -N2 ... -Nn.
Note[modifica | modifica wikitesto]
- ^ a b (EN) Owen T. O’Sullivan e Michael J. Zdilla, Properties and Promise of Catenated Nitrogen Systems As High-Energy-Density Materials, in Chemical Reviews, vol. 120, n. 12, 24 giugno 2020, pp. 5682–5744, DOI:10.1021/acs.chemrev.9b00804. URL consultato il 13 aprile 2024.
- ^ a b (EN) Hongbo Wang, Mikhail I. Eremets e Ivan Troyan, Nitrogen Backbone Oligomers, in Scientific Reports, vol. 5, n. 1, 19 agosto 2015, pp. 13239, DOI:10.1038/srep13239. URL consultato il 13 aprile 2024.
- ^ a b The International Union of Pure and Applied Chemistry (IUPAC), IUPAC - azanes (A00553), su goldbook.iupac.org. URL consultato il 13 aprile 2024.
- ^ N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth - Heinemann, 1997, p. 426, ISBN 0-7506-3365-4.
- ^ Nota che "-azino", che viene usato per quelli con triplo legame, è assente perché l'unico membro della serie, N2, non è, ovviamente, un idruro di azoto.
- ^ Catherine E. Housecroft e Alan G. Sharpe, Inorganic chemistry, 3. ed, Pearson Prentice Hall, 2008, p. 444, ISBN 978-0-13-175553-6.
- ^ a b c Egon Wiberg, Nils Wiberg e A. F. Holleman, Anorganische Chemie, 103. Auflage, De Gruyter, 2017, p. 748, ISBN 978-3-11-026932-1, OCLC 970042787. URL consultato il 13 aprile 2024.
Bibliografia[modifica | modifica wikitesto]
- A. Earnshaw, Norman Greenwood, Chemistry of the Elements, Reed Educational and Professional Publishing Ltd, 1997, ISBN 0-7506-3365-4.