Via dello shikimato
La via dello shikimato o via dell'acido shikimico è una via metabolica trovata in batteri, piante, funghi, alghe e parassiti e definita da Bernard Davis negli anni '50 tramite lo studio su ceppi mutanti di Escherichia coli.[1] È responsabile per la biosintesi degli amminoacidi aromatici (fenilalanina, tirosina e triptofano) dal metabolismo dei carboidrati. Gli animali e l'uomo sono privi di questa via, di conseguenza per questi organismi si tratta di amminoacidi essenziali (ad eccezione della tirosina) che devono essere ottenuti tramite l'alimentazione. Questa via metabolica prende il nome dall'intermedio centrale, l'acido shikimico, un composto isolato per la prima volta da piante del genere illicium (in giapponese shikimi) molti anni prima che fosse scoperto il suo ruolo nel metabolismo.
Biosintesi del corismato[modifica | modifica wikitesto]
Il fosfoenolpiruvato e l'eritrosio 4-fosfato reagiscono formando 3-deossi-arabinoeptulsonato-7-fosfato (DAHP), in una reazione catalizzata dall'enzima DAHP sintasi. Il DAHP viene quindi trasformato in 3-deidrochinato (DHQ), in una reazione catalizzata da DHQ sintasi. La reazione richiede come cofattore NAD, il quale però, contrariamente a quanto mostrato nello schema sottostante, sarà successivamente rigenerato.
Il 3-deidrochinato viene disidratato a 3-deidroshikimato dall'enzima deidrochinasi, successivamente il deidroshikimato viene ridotto ad acido shikimico dall'enzima shikimato deidrogenasi, che utilizza NADPH quale cofattore.
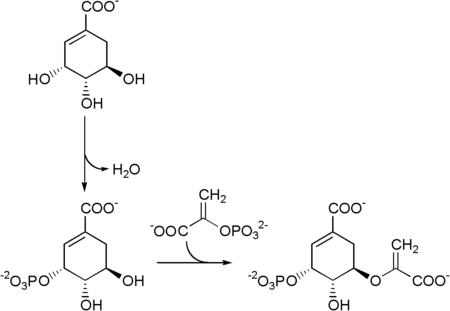
Shikimato → shikimato-3-fosfato → 5-enolpiruvilshikimato-3-fosfato.
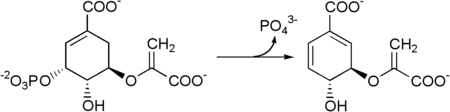
La corismato sintasi è l'enzima che catalizza la reazione 5-enolpiruvilshikimato-3-fosfato → corismato.
Il corismato è l'intermedio fondamentale per la produzione degli amminoacidi aromatici (fenilalanina, triptofano e tirosina) e di altri composti aromatici.
Le sette reazioni della via dello shikimato che portano alla sintesi di corismato sono riassunte nella tabella seguente:
| Substrati e coenzimi | Prodotti | Enzima | Tipo di reazione | |
|---|---|---|---|---|
| 1 | fosfoenolpiruvato + eritrosio 4-fosfato + H2O | 3-deossi-arabinoeptulsonato-7-fosfato (DAHP) + fosfato | DAHP sintasi | |
| 2 | 3-deossi-arabinoeptulsonato-7-fosfato (DAHP) | 3-deidrochinato | DHQ sintasi | |
| 3 | 3-deidrochinato | 3-deidroshikimato | 3-deidrochinato deidratasi | eliminazione di una molecola d'acqua |
| 4 | 3-deidroshikimato + NADPH + H+ | shikimato + NADP+ | Shikimato deidrogenasi | riduzione di un gruppo carbonilico a gruppo ossidrilico |
| 5 | shikimato + ATP | shikimato-3-fosfato + ADP | Shikimato chinasi | fosforilazione |
| 6 | fosfoenolpiruvato + shikimato-3-fosfato | 5-enolpiruvilshikimato-3-fosfato | 3-fosfoshikimato 1-carbossiviniltransferasi (EPSPS) | condensazione |
| 7 | 5-enolpiruvilshikimato-3-fosfato + FMN | corismato | Corismato sintasi |
Biosintesi di fenilalanina e tirosina[modifica | modifica wikitesto]
Piante e microrganismi generalmente sintetizzano fenilalanina e tirosina tramite il prefenato che è biosintetizzato mediante una trasposizione di Claisen del corismato[2][3]:
La reazione è catalizzata dall'enzima corismato mutasi.
Biosintesi della tirosina[modifica | modifica wikitesto]
Il prefenato è sottoposto a decarbossilazione ossidativa NAD-dipendente con ritensione dell'idrossile, dando luogo al p-idrossifenilpiruvato, successivamente sottoposto ad una reazione di transaminazione dove il glutammato è il donatore del gruppo amminico.
Biosintesi della fenilalanina[modifica | modifica wikitesto]
Il prefenato è decarbossilato con perdita dell'ossidrile per formare fenilpiruvato. Questo subisce transaminazione a fenilalanina, con il glutammato come donatore del gruppo amminico.
I mammiferi sintetizzano la tirosina dall'amminoacido essenziale fenilalanina (phe), introdotto tramite l'alimentazione. La conversione della fenilalanina in tirosina è catalizzata dall'enzima fenilalanina idrossilasi, un'ossigenasi a funzione mista che utilizza un cofattore pterinico, la tetraidrobiopterina. Questo enzima catalizza la reazione di conversione aggiungendo un gruppo ossidrile sull'atomo di carbonio in posizione 6 dell'anello aromatico della fenilalanina.
Biosintesi del triptofano[modifica | modifica wikitesto]
Piante e microrganismi generalmente sintetizzano il triptofano dall'acido antranilico. Questo si condensa con Fosforibosil pirofosfato (PRPP), generando Pirofosfato come sottoprodotto. Dopo l'apertura dell'anello della frazione ribosio e dopo decarbossilazione riduttiva, si genera indolo-Gliceraldeide-3-fosfato, che a sua volta si trasforma in indolo. Nell'ultimo passaggio, l'enzima triptofano sintasi catalizza la formazione di triptofano dall'aminoacido serina e dall'indolo.
Note[modifica | modifica wikitesto]
- ^ (EN) Bernard D. Davis, Aromatic Biosynthesis I. The Role of Shikimic Acid, in Journal of Biological Chemistry, vol. 191, 1951, pp. 315-326.
- ^ (EN) Helmut Goerisch, On the mechanism of the chorismate mutase reaction, in Biochemistry, vol. 17, n. 18, 1978, p. 3700, DOI:10.1021/bi00611a004.
- ^ (EN) Peter Kast, Yadu B. Tewari, Olaf Wiest, Donald Hilvert, Kendall N. Houk, and Robert N. Goldberg, Thermodynamics of the Conversion of Chorismate to Prephenate: Experimental Results and Theoretical Predictions, in J. Phys. Chem. B, vol. 101, n. 50, 1997, pp. 10976–10982, DOI:10.1021/jp972501l.
Bibliografia[modifica | modifica wikitesto]
- (EN) Klaus M. Herrmann and Lisa M. Weaver, The Shikimate Pathway, in Annual Review of Plant Physiology and Plant Molecular Biology, vol. 50, n. 1, 1999, pp. 473–503, DOI:10.1146/annurev.arplant.50.1.473.
- (EN) K. M. Herrmann, The Shikimate Pathway: Early Steps in the Biosynthesis of Aromatic Compounds, in The Plant Cell Online, vol. 7, n. 7, 1995, pp. 907–919, DOI:10.1105/tpc.7.7.907.
- (EN) Hiroshi Maeda e Natalia Dudareva, The Shikimate Pathway and Aromatic Amino Acid Biosynthesis in Plants, in Annual Review of Plant Biology, vol. 63, n. 1, 3 maggio 2012, pp. 73–105, DOI:10.1146/annurev-arplant-042811-105439. URL consultato il 10 febbraio 2017.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Shikimate pathway
Wikimedia Commons contiene immagini o altri file su Shikimate pathway