Nitrato di piombo
| Nitrato di piombo | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Ditriossonitrato(V) di piombo
Triossonitrato(V) di piombo | |
| Nomi alternativi | |
| Nitrato piomboso | |
| Caratteristiche generali | |
| Formula bruta o molecolare | Pb(NO3)2 |
| Massa molecolare (u) | 331,21 u |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 233-245-9 |
| PubChem | 16683880 |
| SMILES | [N+](=O)([O-])O[Pb]O[N+](=O)[O-] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 4,53 (20 °C) |
| Solubilità in acqua | 525 g/l (20 °C) |
| Temperatura di fusione | 470 °C (~743 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
    
| |
| pericolo | |
| Frasi H | 272 - 360 - 332 - 302 - 318 - 373 - 410 |
| Consigli P | 201 - 273 - 280 - 305+351+338 - 308+313 [1] |
Il nitrato di piombo è un composto inorganico con la formula chimica Pb(NO3)2. Si presenta comunemente come un cristallo incolore o una polvere bianca e, a differenza della maggior parte degli altri sali di piombo(II), è solubile in acqua.
Conosciuto fin dal Medioevo con il nome plumbum dulce, la produzione di nitrato di piombo dal piombo metallico o dal monossido di piombo nell'acido nitrico era su piccola scala, per l'uso diretto nella produzione di altri composti di piombo. Nel diciannovesimo secolo il nitrato di piombo iniziò ad essere prodotto commercialmente in Europa e negli Stati Uniti. Storicamente, l'uso principale era come materia prima nella produzione di pigmenti per vernici al piombo, ma tali vernici sono state sostituite da vernici meno tossiche a base di biossido di titanio. Altri usi industriali includevano la stabilizzazione al calore in nylon e poliesteri e nei rivestimenti di carta fototermografica. Da circa l'anno 2000, il nitrato di piombo ha iniziato ad essere utilizzato nella cianurazione dell'oro.
Il nitrato di piombo è tossico e procura il saturnismo; deve essere maneggiato con cura per prevenire l'inalazione, l'ingestione e il contatto con la pelle. A causa della sua natura pericolosa, le applicazioni (limitate) del nitrato di piombo sono sotto costante esame.
Storia
[modifica | modifica wikitesto]Il nitrato di piombo fu identificato per la prima volta nel 1597 dall'alchimista Andreas Libavius, che chiamò la sostanza plumbum dulce, che significa "piombo dolce", a causa del suo sapore[2]. È prodotto commercialmente dalla reazione di piombo metallico con acido nitrico concentrato in cui è moderatamente solubile[3][4]. È stato prodotto come materia prima per la produzione di pigmenti come il giallo cromo (cromato di piombo, PbCrO4) e l'arancio di cromo (cromato di piombo basico, Pb2CrO5) e giallo Napoli. Questi pigmenti venivano usati per tingere e stampare il calicò e altri tessuti[5]. È stato usato come ossidante nella polvere da sparo e insieme all'azoturo di piombo in speciali esplosivi[6].
Produzione
[modifica | modifica wikitesto]Il nitrato di piombo è prodotto dalla reazione dell'ossido di piombo (II) con l'acido nitrico concentrato:[7]
- .
Si può anche ottenere l'evaporazione della soluzione ottenuta facendo reagire il piombo metallico con acido nitrico diluito:[8]
- .
Soluzioni e cristalli di nitrato di piombo si formano nel trattamento dei rifiuti di piombo-bismuto provenienti dalle raffinerie di piombo[9].
Struttura
[modifica | modifica wikitesto]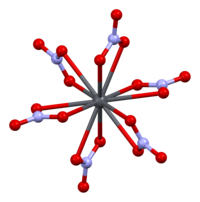
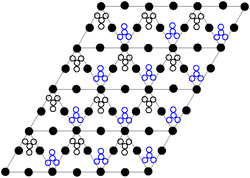
La struttura cristallina del nitrato di piombo solido è stata determinata mediante diffrazione neutronica[10][11] Il composto cristallizza nel sistema cubico con gli atomi di piombo in un sistema cubico a facce centrate. Il suo gruppo spaziale è Pa3Z=4 (notazione reticolare di Bravais), con ciascun lato del cubo di lunghezza 784 picometri.
I punti neri rappresentano gli atomi di piombo, i punti bianchi i gruppi di nitrati 27 picometri sopra il piano degli atomi di piombo e i punti blu i gruppi di nitrati alla stessa distanza al di sotto di questo piano. In questa configurazione, ogni atomo di piombo è legato a dodici atomi di ossigeno (lunghezza del legame: 281 pm). Tutte le lunghezze dei legami N–O sono identiche, del valore di 127 picometri.
L'interesse della ricerca sulla struttura cristallina del nitrato di piombo era in parte basato sulla possibilità di rotazione interna libera dei gruppi nitrato all'interno del reticolo cristallino a temperature elevate, ma ciò non si è concretizzato[11].
Proprietà chimiche e reazioni
[modifica | modifica wikitesto]Il nitrato di piombo si decompone per riscaldamento, una proprietà che è stata utilizzata nella pirotecnica[6]. È solubile in acqua e acido nitrico diluito.
I nitrati basici si formano quando gli alcali vengono aggiunti a una soluzione. A pH basso la specie predominante che si forma è Pb2(OH)2(NO3)2. A pH più alti si forma Pb6(OH)5(NO3)[12]. Il catione [Pb6O(OH)6]4+ è insolito nell'avere uno ione ossido all'interno di un cluster di 3 tetraedri PbO4 che condividono la faccia[13]. Non ci sono prove per la formazione dell'idrossido, Pb(OH)2, in soluzione acquosa al di sotto di pH=12.
Soluzioni di nitrato di piombo possono essere utilizzate per formare complessi di coordinazione. Il piombo(II) è un accettore duro; forma complessi più forti con ligandi donatori di elettroni di azoto e ossigeno. Ad esempio, la combinazione di nitrato di piombo e glicole pentaetilenico (EO5) in una soluzione di acetonitrile e metanolo seguita da una lenta evaporazione ha prodotto il composto [Pb(NO3)2(EO5)][14]. Nella struttura cristallina di questo composto, la catena EO5 è avvolta attorno allo ione piombo in un piano equatoriale simile a quello di un etere corona. I due ligandi nitrati bidentati sono in configurazione trans. Il numero di coordinazione totale è 10, con lo ione piombo in una geometria molecolare antiprisma quadrata bicappata.[senza fonte]
Il complesso formato dal nitrato di piombo con un ligando N-donatore di bi-tiazolo bidentato è binucleare. La struttura cristallina mostra che il gruppo nitrato forma un ponte tra due atomi di piombo[15]. Un aspetto interessante di questo tipo di complessi è la presenza di un gap fisico nella sfera di coordinazione; cioè i ligandi non sono posizionati simmetricamente attorno allo ione metallico. Ciò è potenzialmente dovuto a una coppia di elettroni solitari del piombo, che si trova anche in complessi del piombo con un ligando imidazolo[16].
Applicazioni
[modifica | modifica wikitesto]Il nitrato di piombo è stato utilizzato come stabilizzante termico in nylon e poliesteri, come rivestimento per carta fototermografica e nei rodenticidi[7].
Il riscaldamento del nitrato di piombo è un mezzo conveniente per produrre diossido di azoto:
- .
Nel processo di cianurazione dell'oro, l'aggiunta di una soluzione di nitrato di piombo migliora il processo di lisciviazione. Sono necessarie solo quantità limitate (da 10 a 100 milligrammi di nitrato di piombo per chilogrammo di oro)[17][18].
In chimica organica, può essere utilizzato nella preparazione di isotiocianati da ditiocarbammati[19]. È stato segnalato il suo uso come scavenger del bromuro durante la sostituzione SN1[20].
Sicurezza
[modifica | modifica wikitesto]Il nitrato di piombo è tossico e l'ingestione può portare ad avvelenamento acuto da piombo, cosa che succede con tutti i composti di piombo solubili[21]. Tutti i composti inorganici del piombo sono classificati dall'Agenzia internazionale per la ricerca sul cancro (IARC) come probabilmente cancerogeni per l'uomo (gruppo 2A)[22]. Sono stati collegati al cancro renale e al glioma negli animali da esperimento e al cancro renale, al tumore al cervello e al cancro del polmone nell'uomo, sebbene gli studi sui lavoratori esposti al piombo siano spesso complicati dalla contemporanea esposizione all'arsenico[23]. È noto che il piombo sostituisce lo zinco in numerosi enzimi, tra cui l'acido δ-amminolevulinico deidratasi (porfobilinogeno sintasi) nella via biosintetica dell'eme e la pirimidina-5′-nucleotidasi, importante per il corretto metabolismo del DNA e può quindi causare danni al feto[24].
Note
[modifica | modifica wikitesto]- ^ scheda del nitrato di piombo(II) su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ (LA) Andreas Libavius, Alchemia Andreæ Libavii, Francoforte, Iohannes Saurius, 1595.
- ^ (EN) Lead, in Encyclopedia Britannica, vol. 16, pp. 314–320.
- ^ (EN) John Macgregor, Progress of America to year 1846, Londra, Whittaker & Co, 1847, ISBN 0-665-51791-2.
- ^ (EN) James Riddick Partington, A Text-book of Inorganic Chemistry, MacMillan, 1950, p. 838.
- ^ a b (EN) J. B. Barkley, Lead nitrate as an oxidizer in blackpowder, in Pyrotechnica, vol. 4, Post Falls, Pyrotechnica Publications, ottobre 1978, pp. 16–18.
- ^ a b (EN) Norman N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, p. 456, ISBN 0-7506-3365-4.
- ^ (EN) Othmer D. F., 12, in Kirk-Othmer Encyclopedia of Chemical Technology, 2ª ed., New York, John Wiley & Sons, 1967, p. 272, ISBN 0-471-02040-0.
- ^ (EN) Product catalog; other products, su sidech.be. URL consultato il 5 gennaio 2008 (archiviato dall'url originale il 1º luglio 2007).
- ^ (EN) W. C. Hamilton, A neutron crystallographic study of lead nitrate, in Acta Crystallographica, vol. 10, n. 2, 1957, pp. 103–107, DOI:10.1107/S0365110X57000304.
- ^ a b (EN) H. Nowotny e G., Structure refinement of lead nitrate, in Acta Crystallographica, vol. 42, n. 2, 1986, pp. 133–35, DOI:10.1107/S0108270186097032.
- ^ (EN) J. L. Pauley e M. K. Testerman, Basic Salts of Lead Nitrate Formed in Aqueous Media, in Journal of the American Chemical Society, vol. 76, n. 16, 1954, pp. 4220–4222, DOI:10.1021/ja01645a062.
- ^ (EN) Norman N. Greenwood e Alan Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, p. 395, ISBN 978-00-80-37941-8.
- ^ (EN) Robin D. Rogers, Andrew H. Bond e Debra M. Roden, Structural Chemistry of Poly (ethylene glycol). Complexes of Lead(II) Nitrate and Lead(II) Bromide, in Inorganic Chemistry, vol. 35, n. 24, 1996, pp. 6964–6973, DOI:10.1021/ic960587b.
- ^ (EN) Ali Reza Mahjoub e Ali Morsali, A Dimeric Mixed-Anions Lead(II) Complex: Synthesis and Structural Characterization of [Pb2(BTZ)4(NO3)(H2O)](ClO4)3 {BTZ = 4,4'-Bithiazole}, in Chemistry Letters, vol. 30, n. 12, 2001, p. 1234, DOI:10.1246/cl.2001.1234.
- ^ (EN) Shuang-Yi Wan, Jian Fan, Taka-aki Okamura, Hui-Fang Zhu, Xing-Mei Ouyang, Wei-Yin Sun e Norikazu Ueyama, 2D 4.82 Network with threefold parallel interpenetration from nanometre-sized tripodal ligand and lead(II) nitrate, in Chemical Communications, n. 21, 2002, pp. 2520–2521, DOI:10.1039/b207568g.
- ^ (EN) Fathi Habashi, Recent advances in gold metallurgy, in Revisa de la Facultad de Ingeniera, Universidad Central de Venezuela, vol. 13, n. 2, 1998, pp. 43–54.
- ^ (EN) Auxiliary agents in gold cyanidation, su e-goldprospecting.com, Gold Prospecting and Gold Mining. URL consultato il 5 gennaio 2008.
- ^ (EN) Organic Syntheses, http://www.orgsyn.org/demo.aspx?prep=cv1p0447.
- ^ (EN) Rapoport, H. e Jamison, T., (S)-N-(9-Phenylfluoren-9-yl)alanine and (S)-Dimethyl-N-(9-phenylfluoren-9-yl)aspartate, vol. 9, 1998, p. 344.
- ^ (EN) Lead nitrate, Chemical Safety Card 1000, su inchem.org, International Labour Organization, International Occupational Safety and Health Information Centre, marzo 1999. URL consultato il 19 gennaio 2008.
- ^ (EN) Inorganic and Organic Lead Compounds (PDF), in IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Suppl. 7, International Agency for Research on Cancer, 1987, p. 239. URL consultato il 19 gennaio 2008 (archiviato dall'url originale il 6 marzo 2008).
- ^ (EN) World Health Organization, International Agency for Research on Cancer, Inorganic and Organic Lead Compounds (PDF), in IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, vol. 87, International Agency for Research on Cancer, 2006, ISBN 92-832-1287-8. URL consultato il 1º gennaio 2008 (archiviato dall'url originale il 21 ottobre 2007).
- ^ (EN) Mohammed-Brahim, B., Buchet, J.P. e Lauwerys, R., Erythrocyte pyrimidine 5'-nucleotidase activity in workers exposed to lead, mercury or cadmium, in Int Arch Occup Environ Health, vol. 55, n. 3, 1985, pp. 247–52, DOI:10.1007/BF00383757.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su nitrato di piombo
Wikimedia Commons contiene immagini o altri file su nitrato di piombo
| Controllo di autorità | Thesaurus BNCF 37248 |
|---|


