Sfera di coordinazione

I gruppi NH 3 e Cl formano una sfera di coordinazione attorno allo ione cobalto centrale.
Nella chimica della coordinazione, la prima sfera di coordinazione è rappresentata dai leganti, molecole e ioni, direttamente adiacenti e interagenti all'atomo di metallo. La seconda sfera di coordinazione è costituita, invece, dai leganti, che si attaccano in vari modi alla prima sfera di coordinazione. La simulazione della distribuzione spaziale e delle interazioni tra metallo e leganti è di interesse della chimica computazionale.
Prima sfera di coordinazione[modifica | modifica wikitesto]
La prima sfera di coordinazione è descritta dalla teoria del campo cristallino. I legami possono essere di tipo ionico, covalente ed essere anche mediamente forti, come nel caso del ferrocarbonile.
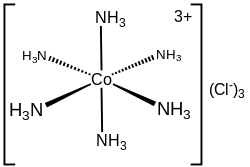
In cobaltoesammina(III) cloruro ([Co(NH3)6]Cl3), la prima sfera di coordinazione è rappresentata dal catione cobalto (III) più i 6 leganti di ammoniaca.
Seconda sfera di coordinamento[modifica | modifica wikitesto]

La seconda sfera di coordinazione è costituita principalmente da molecole di acqua o in generale dal solvente in cui è disciolto il metallo. In altri casi essa può essere degli ioni, come i cloruri nell'esempio del esamminocobalto cloruro, o ancora può essere un secondo gruppo funzionale del leganti della prima sfera di coordinazione, come nel caso del 1,5-diaza-3,7-difosfocicloottani. Le interazioni tra la prima e la seconda sfera di coordinazione solitamente coinvolgono il legame idrogeno e interazioni più deboli, come forze di Van der Waals e di London. Esternamente alla seconda sfera di coordinazione, le molecole di solvente interagiscono in maniera poco significativa con il metallo. Rispetto alla prima sfera di coordinazione, la seconda sfera di coordinazione ha un'influenza meno diretta sulla reattività e sulle proprietà chimiche del complesso metallico. Tuttavia, la seconda sfera di coordinazione è rilevante per comprendere le reazioni del complesso metallico, inclusi i meccanismi di scambio e catalisi dei leganti.
Ruolo nella catalisi[modifica | modifica wikitesto]
Nel caso di metalloproteine, la seconda sfera di coordinazione influenza il meccanismo di azione da parte della proteina. Ad esempio, un cofattore amminico nella seconda sfera di coordinazione di alcuni enzimi idrogenasi aiuta l'attivazione del substrato di diidrogeno.[1]

Ruolo nella chimica inorganica[modifica | modifica wikitesto]
La velocità con cui i leganti si scambiano tra la prima e la seconda sfera di coordinazione è il primo passo nelle reazioni di sostituzione dei leganti. Nella sostituzione associativa, il nucleofilo entrante nella prima sfera di coordinazione risiede inizialmente nella seconda sfera di coordinazione. Questi effetti sono rilevanti per applicazioni pratiche come i mezzi di contrasto utilizzati nella risonanza magnetica.[4]
L'energia delle reazioni di trasferimento di elettroni nella sfera interna è discussa in termini di seconda sfera di coordinazione. Alcune reazioni di trasferimento di elettroni accoppiate con protoni comportano il trasferimento di atomi tra le seconde sfere di coordinazione dei reagenti:
Ruolo nella spettroscopia[modifica | modifica wikitesto]
Gli effetti su colori e stabilità delle soluzioni di ioni metallici sono spesso attribuibili a cambiamenti della prima o seconda sfera di coordinazione. Tali effetti possono essere pronunciati in complessi in cui i leganti nella prima sfera di coordinamento sono donatori e accettatori di legami idrogeno forti, ad esempio rispettivamente [Co(NH3)6]3+ e [Fe(CN)6]3−.[5] Il colore della soluzione è il risultato della radiazione assorbita dalla soluzione, che corrisponde ad una energia necessaria all'eccitamento degli elettroni. Si può calcolare e prevedere l'energia assorbita dalla soluzione grazie alla teoria del campo cristallino. Tutto ciò che può avere una piccola perturbazione della prima o della seconda sfera di coordinazione, farà cambiare il colore della soluzione.
Ruolo nella chimica supramolecolare[modifica | modifica wikitesto]
Le molecole macrocicliche come le ciclodestrine fungono spesso da seconda sfera di coordinazione per i complessi metallici.[6][7]
Note[modifica | modifica wikitesto]
- ^ J. C. Fontecilla-Camps, A. Volbeda, C. Cavazza, Y. Nicolet "Structure/Function Relationships of [NiFe]- and [FeFe]-Hydrogenases" Chem. Rev. 2007, 107, 4273-4303. DOI: 10.1021/cr050195z
- ^ J. Y. Yang, S. Chen e W. G. Dougherty, Hydrogen oxidation catalysis by a nickel diphosphine complex with pendant tert-butyl amines, in Chem. Commun., 2010, pp. 8618–8620, DOI:10.1039/c0cc03246h.
- ^ R. M. Bullock e M. L. Helm, Molecular Electrocatalysts for Oxidation of Hydrogen Using Earth-Abundant Metals: Shoving Protons Around with Proton Relays, in Acc. Chem. Res., vol. 48, 2015, pp. 2017–2026, DOI:10.1021/acs.accounts.5b00069.
- ^ R. M. Supkowski, W. DeW.
- ^ Lehn, J. M. Supramolecular Chemistry: Concepts and Perspectives; VCH: Weinhiem, 1995.
- ^ Z. Liu, S. T. Schneebeli, J. F. Stoddart "Second-sphere coordination revisited" Chimia 2014, 68, 315-320.DOI: 10.2533/chimia.2014.315
- ^ Z. Liu, M. Frasconi, J. Lei, Z. J. Brown, Z. Zhu, D. Cao, J. Iehl, G. Liu, A. C. Fahrenbach, O. K. Farha, J. T. Hupp, C. A. Mirkin, Y. Y. Botros, J. F. Stoddart "Selective isolation of gold facilitated by second-sphere coordination with alpha-cyclodextrin" Nature Communications 2013, 4, 1855.DOI: 10.1038/ncomms2891
![{\displaystyle {\ce {[Fe(H2O)6]2+ + [Fe(H2O)5(OH)]2+ -> [Fe(H2O)6]3+ +[Fe(H2O)5(OH)]2+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bf664031ec68325a3ea21c857e68a80d979edc99)