Dolore oncologico
Il dolore nel paziente oncologico può essere causato dal tumore o dalle procedure diagnostiche e nel trattamento della malattia. Solitamente, il dolore acuto è correlato ai trattamenti oncologici, mentre quello cronico può essere dovuto sia ai trattamenti che al tumore stesso. Il tumore può, infatti, provocare dolore irritando o danneggiando i nervi, attivando speciali fibre nervose chiamate nocicettori o rilasciando sostanze chimiche che rendono i nocicettori sensibili a stimoli a cui normalmente non risponderebbero.
Radioterapia e chemioterapia sono esempi di trattamenti che a volte possono provocare un dolore persistente anche dopo la cura del tumore. Circa la metà di tutti i pazienti oncologici prova dolore.[1] È molto comune negli stadi finali della malattia.
Il dolore può essere eliminato o controllato nell'80-90% dei casi, grazie all'uso di farmaci o altri sistemi, ma quasi un paziente su due non riceve cure ottimali. Le guide al miglior uso di farmaci per il controllo del dolore oncologico sono state pubblicate dall'Organizzazione mondiale della sanità (OMS) e da altre organizzazioni mediche nazionali e internazionali.[2][3] Professionisti nel campo sanitario hanno l'obbligo etico di assicurarsi, quando possibile, che i loro pazienti siano informati riguardo ai rischi e ai benefici associati alle opzioni per la gestione del dolore. Una gestione del dolore adeguata potrebbe accorciare leggermente la vita di un paziente in fase terminale.
Segni e sintomi[modifica | modifica wikitesto]
Il dolore può danneggiare l'attenzione, la memoria, la flessibilità mentale e la velocità di elaborazione delle informazioni[4], inoltre è associato con la depressione, l'ansia, la paura e ira.[5]
La sensazione di dolore è distinta dal fastidio che viene con esso. Per esempio, è possibile, in certi casi, con la psicochirurgia o il trattamento farmacologico, rimuovere il fastidio derivante dal dolore senza che venga influenzata la sua intensità. Alcuni trattamenti farmacologici possono rimuovere sia la sensazione dolorosa che il fastidio.[6]
Cause[modifica | modifica wikitesto]
Il dolore può essere provocato da danni o malattie che interessano tessuti corporei che attivano speciali fibre nervose chiamate nocicettori (dolore nocicettivo) o può essere provocato da danni o malattie che interessano il sistema nervoso (dolore neuropatico). Tra il 40% e l'80% dei pazienti oncologici ha provato dolore di origine neuropatico. Il dolore oncologico è classificabile come acuto (di breve durata), solitamente causato da trattamenti medici, o cronico (di lunga durata). Circa il 75% dei pazienti con dolore cronico lo prova a causa del tumore stesso. Nella maggior parte del restante 25%, il dolore è causato dal trattamento medico attuato.[7]
Infezioni[modifica | modifica wikitesto]
L'infezione di un tumore o dei tessuti circostanti, può provocare un dolore in costante crescita, ma talvolta viene scarsamente considerato. Uno studio[8] ha scoperto che l'infezione è la causa del dolore nel 4% di casi in un campione di 300 pazienti.[9] Un altro studio ha descritto sette pazienti con grandi tumori ulcerati o necrotici della testa e del collo, con eritemi, gonfiori e indurimento o ispessimento dei tessuti circostanti, il cui dolore in precedenza ben controllato era aumentato in modo significativo nell'arco di diversi giorni. Un trattamento antibiotico ha eliminato in dolore nel giro di tre giorni in tutti questi pazienti.[10]
Sistema nervoso[modifica | modifica wikitesto]
I tessuti nervosi non contengono nocicettori; tumori cerebrali possono provocare dolore premendo sui vasi sanguigni o sulle membrane che ricoprono il cervello (meningi) o provocando un accumulo di liquido (edema) che comprime tessuti sensibili al dolore.[11] Il 10% dei pazienti con neoplasie disseminate sviluppa carcinomatosi meningea, che consiste nello sviluppo di stadi germinativi metastatici nelle meningi di cervello e midollo spinale.
Melanomi e tumori al seno e ai polmoni sono collegati al 90% di questi casi. Mal di testa, spesso intenso e associato a nausea, vomito, rigidità del collo e dolore o fastidio agli occhi dovuto all'esposizione alla luce (fotofobia), e mal di schiena sono di frequente i primi sintomi. Formicolio (parestesia), disfunzione della vescica o dell'intestino e debolezza del motoneurone inferiore sono caratteristiche comuni.[12] Circa il 3% dei pazienti oncologici ha manifestato la compressione del midollo spinale, di solito dovuta all'espansione della vertebra causata dalla metastasi.

A volte la compressione è dovuta a metastasi non vertebrali adiacenti al midollo spinale. La compressione di una radice nervosa spinale causa una radicolite mentre, la compressione del lungo tratto del midollo causa un dolore funicolare.[10]
Tra l'1% e il 5% dei pazienti soffre di neuropatia dovuta ad infiltrazione o compressione di un nervo da parte di un tumore. Cellule cancerogene del polmone e meno spesso, del seno, del colon o delle ovaie possono provocare infiammazione al ganglio dorsale. I danni al plesso brachiale sono frequenti nella sindrome di Pancoast, nei linfomi o nei tumori al seno e possono provocare dolore disestetico sul dorso delle mani e crampi all'avambraccio.[10][13]
Osso[modifica | modifica wikitesto]

L'invasione nell'osso da parte del cancro è la fonte più comune di dolore oncologico. Circa il 70% dei pazienti affetti da cancro della mammella e della prostata e il 40% di quelli con cancro al polmone, al rene e alla tiroide, sviluppa metastasi ossee. La condizione è comunemente percepita come fragilità, con dolore persistente e casi di esacerbazione spontanea o movimento-correlata, ed è spesso descritta come grave. I tumori del midollo stimolano una vigorosa risposta immunitaria che aumenta la sensibilità al dolore e rilasciano sostanze chimiche che stimolano i nocicettori. Man mano che crescono, i tumori comprimono, si infiltrano, bloccano l'afflusso di sangue o consumano i tessuti del corpo, causando dolore nocicettivo o neuropatico.[10][12]
Fratture costali, comuni nei tumori al seno, alla prostata e altri tumori con metastasi costali, possono causare forti dolori di tipo acuto quando si torce il collo, si tossisce, si ride o si respira profondamente. La base del cranio può essere attaccata da metastasi di tumore al bronco, al seno o alla prostata, o il tumore può estendersi direttamente a questa zona dalla nasofaringe, e questo può causare mal di testa, parestesia facciale, disestesia o dolore, o disfunzione dei nervi cranici - i sintomi esatti dipendono dai nervi coinvolti.[10]
Pelvi[modifica | modifica wikitesto]
Il dolore prodotto da un tumore all'interno delle pelvi varia a seconda delle cause, ma spesso si irradia diffusamente alla coscia e può essere in relazione con la regione lombare. Plessopatia lombosacrale è spesso causato da tumore recidivi nello spazio presacrale, e può essere in relazione con il perineo invece che con le gambe. Un cancro recidivo che attacca un lato della parete pelvica può causare dolore in una delle fosse iliache. Il dolore durante le camminate che confina il paziente a letto indica una possibile aderenza del cancro o invasione del muscolo iliaco. Il dolore all'ipogastrio (regione tra l'ombelico e l'osso pubico), è ricorrente nei tumori all'utero e alla vescica, e talvolta nel cancro al colon-retto, soprattutto se si è infiltrato o è collegato all'utero o alla vescica.[10]
Visceri[modifica | modifica wikitesto]

Il dolore viscerale è diffuso e difficile da individuare e spesso è collegato a parti distanti, di solito superficiali. Un tumore può aumentare le dimensioni del fegato più volte (epatomegalia) e il conseguente allungamento del suo rivestimento può causare un forte dolore nell'ipocondrio destro. Altre cause di dolore dovute all'ingrossamento del fegato sono la trazione dei legamenti di sostegno quando ci si alza in piedi o si cammina, l'emorragia interna del fegato, il fegato che preme contro la gabbia toracica, pizzica la parete dell'addome o tende la colonna lombare. In alcune posture, il fegato può schiacciare il peritoneo parietale contro la gabbia toracica inferiore, producendo un dolore acuto e transitorio, alleviabile se si cambia posizione. Il tumore può anche infiltrarsi nel rivestimento del fegato, causando un dolore lieve o, talvolta, lancinante.[10]
Il cancro ai reni e alla milza produce meno dolore rispetto a quello causato dal tumore al fegato - i tumori del rene provocano dolore solo una volta che l'organo è stata quasi totalmente distrutto e il tumore ha invaso il tessuto circostante o le pelvi adiacenti. La pressione sul rene o sull'uretere da parte di un tumore esterno al rene può causare un estremo dolore al fianco. La recidività di un tumore dopo la rimozione di un rene può causare dolore alla schiena lombare accompagnato da debolezza e intorpidimento del muscolo ileopsoas, acuito dall'attività fisica.[10]
Il dolore dovuto a tumori intestinali può essere il risultato di problemi di motilità dilatazione, alterazione del flusso sanguigno o ulcerazione. I linfomi maligni del tratto gastrointestinale sono in grado di produrre tumori di grandi dimensioni che portano a ulcerazione e sanguinamento significativo. L'infiammazione delle pareti delle arterie e dei tessuti adiacenti ai nervi è comune nei tumori degli organi cavi addominali e urogenitale.[14]
Il cancro nell'albero bronchiale è in genere indolore,[14] ma è stato segnalato in alcuni pazienti un dolore all'orecchio e alla faccia su un solo lato della testa. Questo dolore si sente attraverso il ramo auricolare del nervo vago.[10]

Il dieci per cento dei pazienti con cancro al pancreas ha avuto esperienza del dolore, mentre il 90 per cento di quelli con tumore della testa del pancreas lo percepiva, soprattutto se il tumore era vicino all'ampolla del Vater. Il dolore appare sulla parte sinistra o destra dell'addome, è costante, ed aumenta di intensità nel tempo. In alcuni casi è stato alleviato protendendosi in avanti ed aumentato sdraiandosi sullo stomaco. Il dolore alla schiena può essere presente e, se intenso, può diffondersi a destra e a sinistra. Il mal di schiena può indicare che il tumore è penetrato nel muscolo paravertebrale, oppure è entrato nel retroperitoneo e nel linfonodo paraortico.[10]
Il dolore del retto può essere presente anche dopo che il retto è stato rimosso chirurgicamente. La recidività locale del carcinoma rettale può causare dolore lieve (descritto come "pressione") o forte mentre ci si siede o quando si è in posizione eretta o camminando (descritto come dolore da "trascinamento"). Quest'ultimo può indicare una ricorrenza che coinvolge un attacco ad muscolo o ad una fascia. Un tumore locale nel retto o che coinvolge il plesso presacrale può causare dolore generalmente associato ad un urgente bisogno di defecare. Questo dolore può raramente, sparire dopo la rimozione chirurgica del retto. Si dice spesso che il dolore è angosciante, intenso, lancinante.[10]
Il dolore percepito dopo poche settimane in seguito alla rimozione chirurgica del retto è solitamente di tipo neuropatico dovuto alla chirurgia e descritto in uno studio[15] come spontaneo e intermittente. Il dolore che emerge dopo tre mesi è stato descritto come profondo, acuto, dolente, intenso e continuo, aggravato dalla posizione seduta o di pressione. In più della metà dei pazienti con esordio tardivo di dolore nello studio sopra citato vi è stato un miglioramento grazie all'uso di un analgesico. L'infezione o tumore può irritare il trigono della vescica urinaria, provocando lo spasmo del muscolo detrusore urinae (il muscolo che spinge urina dalla vescica urinaria), causando un profondo dolore sopra l'osso pubico, della durata che varia da pochi minuti a mezz'ora.[10]
Mucosa sierosa[modifica | modifica wikitesto]
La carcinosi del peritoneo può provocare dolore attraverso la pressione delle metastasi sui nervi, infiammazione o motilità viscerale problematica. Una volta che un tumore è penetrato o ha perforato i visceri cavi, compare l'infiammazione acuta del peritoneo, che provoca forti dolori addominali. La carcinomatosi pleurica è normalmente indolore.[14]
Tessuti molli[modifica | modifica wikitesto]
L'invasione dei tessuti molli da parte di un tumore può provocare dolore mediante la stimolazione infiammatoria o meccanica dei nocicettori, o la distruzione di strutture mobili quali legamenti, tendini e muscoli scheletrici.[14]
Legato al trattamento[modifica | modifica wikitesto]
Interventi potenzialmente dolorosi nel trattamento del cancro includono l'immunoterapia, che può provocare dolore articolare o muscolare, la radioterapia, che può causare reazioni cutanee, l'enterite, le radiazioni di fibrosi, la mielopatia, l'osteoradionecrosi, la neuropatia o Plessopatia; la chemioterapia, spesso associata a mucosite, dolori articolari, dolori muscolari, neuropatia periferica e dolori addominali dovuti a diarrea o stitichezza, la terapia ormonale, che provoca a volte dolore di brevissima durata; le terapie mirate, come il trastuzumab e rituximab, che possono causare dolore muscolare, dolore articolare o dolore al torace; gli inibitori dell'angiogenesi come bevacizumab, noti per causare a volte dolore osseo, l'intervento chirurgico, che può produrre il dolore postoperatorio e il dolore post-amputazione e le diagnosi invasive come la puntura lombare, la biopsia del midollo osseo, il prelievo venoso, la paracentesi e la toracentesi.[16]
Chemioterapia[modifica | modifica wikitesto]
La chemioterapia può causare mucosite, dolori muscolari, dolori articolari, dolori addominali causati da diarrea o costipazione e la neuropatia periferica (dolore e intorpidimento delle mani, polsi, piedi e caviglie).[16]
Chemioterapia indotta neuropatia periferica[modifica | modifica wikitesto]
Alcuni dei farmaci chemioterapici più comuni, tra cui la vincristina/vinblastina, l'aclitaxel/docetaxel, il cisplatino/oxaliplatino/carboplatino, la talidomide e il bortezomib, possono causare neuropatia periferica indotta (CIPN), vissuta come intorpidimento formicolio, dolore intenso, e ipersensibilità al freddo.[17] La CIPN spesso consegue alla prima dose di chemioterapia e aumenta di gravità man mano che il trattamento continua, ma questa progressiva degenerazione di solito finisce al termine del trattamento. I farmaci a base di platino, come il cisplatino e oxaliplatino sono l'eccezione, con questi farmaci, la sensazione può continuare a deteriorarsi per diversi mesi dopo la fine del trattamento.[18] Alcuni CIPN sembrano essere irreversibili.[18]
Il dolore spesso può essere aiutato con terapia farmacologica, ma il torpore di solito è resistente al trattamento. La CIPN sconvolge il tempo libero, il lavoro e le relazioni familiari, e il dolore di CIPN è spesso accompagnata da disturbi del sonno e dell'umore, fatica e difficoltà funzionali. Uno studio americano del 2007 ha rilevato che la maggior parte dei pazienti non si ricordava di essere stato avvertito di aspettarsi la CIPN, e i medici che monitoravano la condizione raramente chiedevano come influisse sulla loro vita, ma si focalizzavano sugli effetti pratici, come la destrezza e l'andatura.[19]
Non si sa che cosa provochi questa condizione, ma i danni ai microtubuli, ai mitocondri e ai vasi sanguigni vicino alle cellule nervose sono alcune delle possibilità da prendere in considerazione.[18] Non si sa qual è la percentuale di pazienti che sono affetti da questo problema. Come possibili interventi preventivi, l'American National Cancer Institute Symptom Managemenet and Health-related Quality of Life Steering Company raccomanda continui accertamenti sul glutatione, sul calcio per via endovenosa e sul magnesio, che hanno mostrato risultati promettenti nei primi limitati esperimenti sugli esseri umani.[17]
Mucosite[modifica | modifica wikitesto]
I farmaci contro il cancro possono causare cambiamenti nella biochimica delle membrane mucose con conseguente dolore intenso alla bocca, alla gola, al naso e al tratto gastrointestinale. Questo dolore può rendere difficile o impossibile il parlare, il bere, il mangiare.[20]
Dolori muscolari e articolari[modifica | modifica wikitesto]
La sospensione dei farmaci steroidi può causare dolori articolari e dolore muscolare diffuso accompagnato da stanchezza, questi sintomi si risolvono con la ripresa della terapia steroidea. La terapia steroidea cronica può portare a necrosi asettica della testa del femore, con conseguente dolore alla spalla o al ginocchio, descritto come movimento sordo e dolorante e ridotta o dall'impossibilità di usare il braccio o dell'anca. Gli inibitori dell'aromatasi possono causare diffusi dolori articolari, muscolari e rigidità, e aumentare la probabilità di fratture da osteoporosi.[20]
Radioterapia[modifica | modifica wikitesto]

La radioterapia può influire sul tessuto connettivo che circonda i nervi, e può danneggiare o distruggere la sostanza bianca o grigia nell'encefalo o nel midollo spinale.
Fibrosi intorno al plesso brachiale[modifica | modifica wikitesto]
La radioterapia può produrre una crescita eccessiva (fibrosi) del tessuto fibroso che avvolge il plesso brachiale, che può provocare danni ai nervi nel tempo (da 6 mesi a 20 anni). Questo danno ai nervi può causare "intorpidimento, formicolio o sensazione sgradevole (disestesia) e debolezza dell'arto interessato. Se il dolore si sviluppa, è descritto come diffuso, grave, aumentato nel tempo.[20]
Danni al midollo spinale[modifica | modifica wikitesto]
Se la radioterapia comprende il midollo spinale, possono verificarsi variazioni che non risulteranno evidenti fino a tempo dopo il trattamento. La "mielopatia iniziale ritardata indotta da radiazioni" può manifestarsi dalle sei alle settimane a sei mesi dopo il trattamento, il sintomo di solito è un segno di Lhermitte ("in breve, la spiacevole sensazione di intorpidimento, formicolio e spesso scarica elettrica che va dal collo alla colonna vertebrale e le estremità, innescati dalla flessione del collo "), ed è in genere seguito da un miglioramento di due a nove mesi dopo l'esordio, anche se in alcuni casi i sintomi persistono per lungo tempo. La mielopatia ritardata indotta da radiazioni può verificarsi dai sei mesi ai dieci anni dopo il trattamento.[21]
Gestione[modifica | modifica wikitesto]
Il trattamento del dolore oncologico ha lo scopo di alleviare il dolore con minimi effetti collaterali, permettendo al paziente una buona qualità di vita, di livello di funzioni e una morte relativamente indolore.[22] Sebbene 80-90% del dolore oncologico possa essere eliminato o ben controllato, quasi la metà di tutti i pazienti con questo dolore (compresi quelli nei paesi sviluppati) ricevono meno cure ottimali.[23]
Il cancro è un processo dinamico, il dolore e gli interventi lo devono riflettere questo. Possono essere richieste diverse modalità di trattamento nel corso del tempo, man mano che la malattia progredisce. Le figure sanitarie responsabili dovrebbe spiegare chiaramente al paziente la causa del dolore e le diverse possibilità di trattamento, e dovrebbero prendere in considerazione, così come la terapia farmacologica, la modifica diretta del trattamento di base, aumentando la soglia del dolore, interrompendo, distruggendo o stimolando, e suggerendo modifiche al suo stile di vita.[22] Il sollievo dal disagio psicologico, sociale e spirituale è un elemento chiave nella gestione efficace del dolore.[2]
Farmaci[modifica | modifica wikitesto]

Le linee guida dell'OMS[2] raccomandano la tempestiva somministrazione orale di farmaci quando il dolore si verifica, a partire, se il paziente non soffre troppo, con farmaci non-oppioidi come il paracetamolo, il dipirone, anti-infiammatori non-steroidei e inibitori selettivi della COX-2.[2] Quindi, se il dolore non si attenua del tutto si necessita di un trattamento più aggressivo, oppioidi lievi come il fosfato di codeina, destropropossifene, diidrocodeina o tramadolo vengono aggiunti al regime farmaceutico già esistente. Se questo è o diventa insufficiente, gli oppioidi lievi vengono sostituiti da forti oppioidi come la morfina, pur continuando la terapia non-oppioide, si aumenta le dosi di oppiacei fino a quando il paziente non sente più dolore o ha raggiunto il sollievo massimo possibile, senza effetti collaterali intollerabili.[22]
Se la presentazione iniziale è di dolore oncologico grave, questo passo dovrebbe essere saltato e si dovrebbe iniziare immediatamente con un oppioide forte in combinazione con un non-oppioide analgesico.[22]
L'utilità della seconda fase (oppioidi lievi) è oggetto di dibattito nelle comunità cliniche e di ricerca. Alcuni autori contestano la validità farmacologica del passo e, indicando la loro tossicità più elevata e bassa efficacia, sostengono che gli oppioidi miti, con la possibile eccezione del tramadolo grazie alle sue proprietà sedative basse e il potenziale di riduzione per la depressione respiratoria, potrebbero essere sostituiti da piccole dosi di oppioidi forti. I trattamenti antiemetico e lassativo dovrebbero essere iniziati in concomitanza con l'uso di oppioidi forti, per contrastare la nausea e la stipsi abituale. La nausea si risolve normalmente dopo due o tre settimane di trattamento, ma l'uso lassativi dovrà essere mantenuto in modo aggressivo. Più della metà dei pazienti con cancro avanzato e dolore avrà bisogno di oppioidi forti, e questi in combinazione con i non-oppioidi in grado di produrre analgesia accettabile nel 70-90 per cento dei casi. La sedazione e deficit cognitivo di solito si verificano con una dose iniziale o un significativo aumento del dosaggio di un oppioide forte, ma migliorano dopo una settimana di dosaggio costante.[22]
Gli analgesici non dovrebbero essere assunti "on demand", ma "seguendo l'orologio" (ogni 3-6 ore), con ogni dose somministrata prima che l'effetto della dose precedente sia svanito, in dosi sufficientemente alte per garantire sollievo continuo del dolore. Ai pazienti trattati con morfina a rilascio lento dovrebbe essere anche fornita con rilascio immediato ("salvataggio") di morfina da utilizzare, se necessario, per i picchi di dolore (il dolore episodico intenso) che non sono soppressi dal farmaco regolare.[22]
L'analgesia orale è la più economica, semplice e accettabile come modalità di somministrazione. Altre tipologie di somministrazione, come per via sublinguale, topica, parenterale, rettale o spinale, devono essere considerate se vi è una necessità urgente o in caso di vomito, stato di coscienza ridotto, ostruzione del tratto gastrointestinale, scarso assorbimento o coma.[22] Malattie del fegato e rene possono influenzare l'attività biologica degli analgesici. Quando questi pazienti vengono trattati con oppioidi per via orale devono essere monitorati per l'eventuale necessità di ridurre la dose, estendere gli intervalli di dosaggio o passare ad altri oppiacei o altre modalità di somministrazione.[22]
Non tutti i tipi di dolore rispondono completamente agli analgesici classici e farmaci che non sono tradizionalmente considerati analgesici, ma che riducono il dolore, in alcuni casi, come gli steroidi o bifosfonati, possono essere impiegati in concomitanza con gli analgesici in qualsiasi momento. Gli antidepressivi triciclici, gli antiaritmici di classe I o gli anticonvulsivanti sono i farmaci di scelta per il dolore neuropatico. Fino al 90% dei pazienti giudicati terminali, fa uso di questi trattamenti palliativi.[22] La riduzione dell'ansia può ridurre la sgradevolezza del dolore, ma è meno efficace per il dolore moderato o grave.[24] Siccome gli ansiolitici, come le benzodiazepine e i maggiori tranquillanti, si aggiungono alla sedazione, dovrebbero essere utilizzati solo per affrontare l'ansia, la depressione, i disturbi del sonno o gli spasmi muscolari.[22]
Interventistica[modifica | modifica wikitesto]
Se l'analgesico e il regime adiuvante raccomandati precedentemente non alleviano adeguatamente il dolore, ci sono le seguenti modalità di intervento disponibili[25]:
Radiazione[modifica | modifica wikitesto]
La radioterapia è utilizzata quando il trattamento farmacologico non riesce a controllare il dolore di un tumore in crescita, più frequentemente nelle metastasi osee, nella penetrazione del tessuto molle o nella compressione di nervi sensoriali. Spesso, basse dosi di radiazioni ionizzanti sono sufficienti per ottenere l'analgesia. Si pensa che ciò sia dovuto alla riduzione della pressione o, forse, all'interferenza con la produzione di sostanze chimiche da parte del tumore.[26] Radiofarmaci che attaccano tumori specifici vengono utilizzati per trattare il dolore delle malattie metastatiche. Il sollievo si può avere entro una settimana di trattamento e può durare da due a quattro mesi.[25]
Blocco dei nervi[modifica | modifica wikitesto]

La neurolisi consiste nella lesione volontaria di un nervo. Sostanze chimiche, laser, il congelamento o il riscaldamento possono essere utilizzati per ferire un nervo sensorio e quindi produrre degenerazione delle fibre nervose, della guaina mielinica e interferire temporaneamente con la trasmissione dei segnali del dolore. In questa procedura, il rivestimento di protezione posto attorno alla guaina mielinica, la lamina basale, si conserva in modo che, come una fibra danneggiata (e la sua guaina mielinica) ricresce, viaggia nella sua lamina basale e si collega con l'estremità libera corretta e la congiunzione possa ristrutturarsi. Il taglio chirurgico di un nervo taglia le lamine basali e, senza questi tubi per incanalare le fibre ricresciute alle loro connessioni perse, uno può sviluppare neuromi, che causano dolore. Questo è il motivo per cui la neurolisi è da preferire al blocco chirurgico dei nervi.[27] Una breve "prova" dovrebbe essere fatta con anestesia locale prima dell'operazione effettiva, per determinare l'efficacia e rilevare gli effetti collaterali.[25] Lo scopo di questo trattamento è l'eliminazione del dolore o la riduzione del dolore al punto in cui oppioidi siano efficaci.[25] Anche se la neurolisi manca di studi suffragati da risultati a lungo termine e linee guida basate sulle evidenze, per i pazienti con cancro e dolore progressivo incurabile svolge un ruolo essenziale.[27]
Obiettivi del blocco neurolitico includono il plesso celiaco, più comunemente per il cancro del tratto gastrointestinale fino al colon trasverso, il cancro del pancreas, ma anche per il cancro dello stomaco, il cancro della vescica biliare, la massa surrenale, il cancro del dotto biliare comune, pancreatite cronica e attiva intermittente porfiria, il nervo splancnico, per il dolore retroperitoneale, e condizioni simili a quelle affrontate dal blocco del plesso celiaco blocco, ma, a causa del suo elevato tasso di complicanze, viene utilizzato solo se il blocco del plesso celiaco non produce un sollievo adeguato. Il blocco del plesso ipogastrico viene scelto per i tumori del colon discendente, del colon sigmoideo e del retto, così come i tumori del uretra, della vescica, del prostata, delle vescicole seminali, dei testicoli, dell'utero, delle ovaie, del perineo, della vulva, dell'ano, del retto distale, dell'uretra distale e del terzo distale della vagina; il blocco del ganglio stellato solitamente è riservato al cancro della testa e del collo o del braccio con dolore alla mano.[25]
Taglio o distruzione di tessuto nervoso[modifica | modifica wikitesto]

Il taglio chirurgico o la distruzione del tessuto nervoso periferico centrale è ora raramente utilizzato nel trattamento del dolore. Le procedure includono neurectomia, cordotomia, lesione dorsale della radice e cingulotomia. La neurectomia comporta il taglio di un nervo, ed è (raramente) somministrato a pazienti con breve aspettativa di vita che non sono adatti per la terapia farmacologica a causa di inefficacia o intolleranza. Poiché i nervi spesso portano fibre sia sensitive e motorie, la disabilità motoria è un effetto collaterale possibile della neurectomia. Un risultato comune di questa procedura è il "dolore deafferentazione", dove, 6-9 mesi dall'intervento, il dolore ritorna a maggiore intensità.[28]
La cordotomia comporta il taglio nel tratto spinotalamico, che corre frontalmente/lateralmente al quadrante del midollo spinale e trasporta i segnali portatori di calore e dolore al cervello. Il dolore tumorale da sindrome di Pancoast viene efficacemente trattata con il taglio nella zona dorsal. Questa è un'operazione con rischio di effetti collaterali significativi da punto vista neurologico.[28]
La cingulotomia comporta il taglio delle fibre che trasportano i segnali direttamente alla corteccia entorinale nel cervello. Riduce la sgradevolezza del dolore (senza compromettere la sua intensità), ma può avere effetti collaterali cognitivi. La somministrazione di un oppiaceo come la morfina, l'idromorfone, il fentanyl e la meperidina sufentanyl direttamente nella cavità subaracnoidea, rafforza l'analgesia con effetti collaterali sistemici ridotti e riduce il livello di dolore in casi altrimenti intrattabili. L'ansiolitico clonidina o l'analgesico ziconotide non oppiaceo e gli anestetici locali come la bupivacaina, la ropivacaina o la tetracaina possono anche essere infusi insieme agli oppioidi.[28]
Catetere epidurale a lungo termine[modifica | modifica wikitesto]
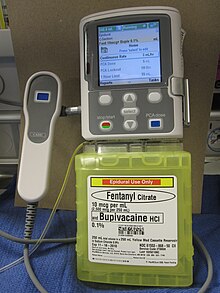
Lo strato esterno della guaina che circonda il midollo spinale è chiamata "dura madre". Tra questa e la vertebra vi è lo spazio epidurale, pieno di vasi del tessuto connettivo, grasso, sangue e attraversato dalle radici dei nervi spinali. Un catetere può essere inserito in questo spazio per un periodo che va dai tre ai sei mesi, al fine di somministrare anestetici o analgesici. La linea di trasporto del farmaco può essere inserito sotto la pelle, in una procedura chiamata "tunneling". Questa è raccomandata nell'uso a lungo termine in modo da ridurre la possibilità di una qualsiasi infezione nello spazio epidurale.[25]
Stimolazione del midollo spinale[modifica | modifica wikitesto]
La stimolazione elettrica delle colonne dorsali del midollo spinale può produrre analgesia. In primo luogo, i conduttori vengono impiantati, guidati dalla relazione del paziente e dalla fluoroscopia, e il generatore viene indossato esternamente per diversi giorni per valutare l'efficacia. Se il dolore è ridotto di più della metà, la terapia è ritenuto adatta. Una piccola tasca viene tagliato nel tessuto sotto la pelle dei glutei superiori, la parete toracica e l'addome ed i cavi sono infilati sotto la pelle dal sito di stimolazione per la tasca, su cui sono fissati saldamente al-fitting generatore.[28] Sembra essere più disponibile con dolore neuropatico e ischemica rispetto dolore nocicettivo, e spesso non viene utilizzato nel trattamento del dolore da cancro.[29]
La stimolazione cerebrale profonda[modifica | modifica wikitesto]
La stimolazione elettrica delle strutture profonde all'interno del cervello, hanno dimostrato risultati sorprendenti con alcuni pazienti, ma con variazioni da caso a caso. Uno studio[30] effettuato su diciassette pazienti con dolore oncologico intrattabile ha rilevato che tredici erano praticamente senza dolore e solo quattro richiedevano analgesici oppioidi alla dimissione dall'ospedale dopo l'intervento. La maggior parte, in ultima analisi, ha fatto ricorso a oppiacei, di solito nelle ultime settimane di vita.[29]
Ipofisectomia[modifica | modifica wikitesto]
L'ipofisectomia è la distruzione della ghiandola pituitaria, ed è stata utilizzata con successo su seno metastatico e il dolore da cancro alla prostata.[28]
Ostacoli al trattamento[modifica | modifica wikitesto]
Nonostante la disponibilità e la pronta pubblicazione di semplici ed efficaci linee guida sul dolore, medici e infermieri frequentemente difettano nella comprensione di aspetti chiave della gestione del dolore tra cui la valutazione, il dosaggio, la tolleranza e dipendenza e molti non sanno che l'eliminazione del dolore è possibile nella maggior parte dei casi e che ciò dovrebbe essere offerto, ove possibile. Dove la completa eliminazione della sofferenza non sia realizzabile a causa degli effetti intollerabili collaterali dei farmaci, la dose massima tollerabile dovrebbe essere comunque somministrata.[2][3]
Problemi sistemici nella gestione del dolore includono il fallimento clinico, la mancanza di scorte di farmaci del dolore nelle zone più povere e le restrizioni legali sulla prescrizione di farmaci oppioidi.[19]
Talvolta i pazienti possono non segnalare adeguatamente il dolore a causa della credenza che esso sia inevitabile, per la paura degli effetti collaterali del trattamento, per il timore di creare assuefazione o tolleranza agli oppioidi, per la paura di distrarre il medico dalla cura della malattia o dalla preoccupazione di mascherare un importante sintomo per monitorare i progressi della condizione. I pazienti possono essere riluttanti a prendere una medicina adeguata anche perché sono a conoscenza della prognosi o perché non vogliono accettare la diagnosi.[19]
Note[modifica | modifica wikitesto]
- ^ Marcus DA, Epidemiology of cancer pain, in Curr Pain Headache Rep, vol. 15, n. 4, agosto 2011, pp. 231–4, DOI:10.1007/s11916-011-0208-0, PMID 21556709.
- ^ a b c d e WHO guidelines:
- World Health Organization, Cancer pain relief. With a guide to opioid availability, 2ª ed., Geneva, WHO, 1996, ISBN 92-4-154482-1.
- World Health Organization, Cancer pain relief and palliative care in children, Geneva, WHO, 1998, ISBN 978-92-4-154512-9.
- ^ a b Linee guida clinche:
- Consensus statement – Symptom management in cancer: Pain, depression and fatigue, su consensus.nih.gov, USA National Institutes of Health, 2002. URL consultato il 22 agosto 2011 (archiviato dall'url originale l'8 novembre 2005).
- Recommendations: morphine and alternative opioids for cancer pain, su eapcnet.eu, European Association for Palliative Care, 2001. URL consultato il 22 agosto 2011 (archiviato dall'url originale il 30 marzo 2012).
- Control of pain in adults with cancer, su sign.ac.uk, Scottish Intercollegiate Guidelines Network, 2008. URL consultato il 22 agosto 2011 (archiviato dall'url originale il 27 ottobre 2011).
- Clinical practice guidelines in oncology: adult cancer pain (PDF), su nccn.org, USA National Comprehensive Cancer Network, 2011. URL consultato il 22 agosto 2011.
- ^ Hart RP, Wade JB, Martelli MF, Cognitive impairment in patients with chronic pain: the significance of stress, in Curr Pain Headache Rep, vol. 7, n. 2, aprile 2003, pp. 116–26, DOI:10.1007/s11916-003-0021-5, PMID 12628053.
- ^ Bruehl S, Burns JW, Chung OY, Chont M, Pain-related effects of trait anger expression: neural substrates and the role of endogenous opioid mechanisms, in Neurosci Biobehav Rev, vol. 33, n. 3, marzo 2009, pp. 475–91, DOI:10.1016/j.neubiorev.2008.12.003, PMC 2756489, PMID 19146872.
- ^ Melzack R, Casey KL, Sensory, motivational and central control determinants of chronic pain: A new conceptual model, in Kenshalo DR (a cura di), The skin senses: Proceedings of the first International Symposium on the Skin Senses, held at the Florida State University in Tallahassee, Florida, Springfield, Charles C. Thomas, 1968, pp. 423–443.
- ^ Kurita GP, Ulrich A, Jensen TS, Werner MU, Sjøgren P, How is neuropathic cancer pain assessed in randomised controlled trials?, in Pain, vol. 153, n. 1, gennaio 2012, pp. 13–7, DOI:10.1016/j.pain.2011.08.013, PMID 21903329.
- ^ Gonzalez GR, Foley KM & Portenoy RK, Evaluative skills necessary for a cancer pain consultant, in American Pain Society meeting, Phoenix Arizona, 1989.
- ^ Bruera E & MacDonald RN, Intractable pain in patients with advanced head and neck tumors: a possible role of local infection, in Cancer treatment reports, vol. 70, 1986, pp. 691–2, PMID 3708626.
- ^ a b c d e f g h i j k l Twycross R & Bennett M, Cancer pain syndromes, in Sykes N, Bennett MI & Yuan C-S (a cura di), Clinical pain management: Cancer pain, 2nd, Londra, Hodder Arnold, 2008, pp. 27–37, ISBN 978-0-340-94007-5.
- ^ Fitzgibbon Loeser, 2010, p. 34.
- ^ a b Urch CE & Suzuki R, Pathophysiology of somatic, visceral, and neuropathic cancer pain, in Sykes N, Bennett MI & Yuan C-S (a cura di), Clinical pain management: Cancer pain, 2nd, Londra, Hodder Arnold, 2008, pp. 3–12, ISBN 978-0-340-94007-5.
- ^ Foley KM, Acute and chronic cancer pain syndromes, in Doyle D, Hanks G, Cherny N & Calman K (a cura di), Oxford textbook of palliative medicine, Oxford, OUP, 2004, pp. 298–316, ISBN 0-19-851098-5.
- ^ a b c d Fitzgibbon Loeser, 2010, p. 35.
- ^ Boas RA, Schug SA & Acland RH, Perineal pain after rectal amputation: A 5 year follow up, in Pain, vol. 52, 1993, pp. 62–70, DOI:10.1016/0304-3959(93)90115-6, PMID 8446438.
- ^ a b International Association for the Study of Pain Archiviato il 28 settembre 2011 in Internet Archive. Treatment-Related Pain
- ^ a b del Pino BM, Chemotherapy-induced Peripheral Neuropathy, in NCI Cancer Bulletin, vol. 7, n. 4, 23 febbraio 2010, p. 6 (archiviato dall'url originale l'11 dicembre 2011).
- ^ a b c Windebank AJ & Grisold W, Chemotherapy-induced neuropathy, in Journal of the Peripheral Nervous System, vol. 13, n. 1, 2008 Mar, pp. 27–46, PMID 18346229.
- ^ a b c Paice JA, Ferrell B, The management of cancer pain, in CA – A Cancer Journal for Clinicians, vol. 61, n. 3, 2011, pp. 157–82, DOI:10.3322/caac.20112, PMID 21543825.
- ^ a b c Fitzgibbon Loeser, 2010, p. 39.
- ^ Fitzgibbon Loeser, 2010, p. 102–3.
- ^ a b c d e f g h i j Schug SA & Auret K, Clinical pharmacology: Principles of analgesic drug management, in Sykes N, Bennett MI & Yuan C-S (a cura di), Clinical pain management: Cancer pain, 2nd, Londra, Hodder Arnold, 2008, pp. 104–22, ISBN 978-0-340-94007-5.
- ^ Deandrea S, Montanari M, Moja L, Apolone G, Prevalence of undertreatment in cancer pain. A review of published literature, in Ann. Oncol., vol. 19, n. 12, dicembre 2008, pp. 1985–91, DOI:10.1093/annonc/mdn419, PMC 2733110, PMID 18632721.
- ^ Price DD, Riley JL & Wade JB, Psychophysical approaches to measurement of the dimensions and stages of pain, in Turk DC & Melzack R (a cura di), Handbook of pain assessment, NY, Guildford Press, 2001, pp. 65, ISBN 1-57230-488-X.
- ^ a b c d e f Atallah JN, Management of cancer pain, in Vadivelu N, Urman RD, Hines RL (a cura di), Essentials of pain management, New York, Springer, 2011, pp. 597–628, DOI:10.1007/978-0-387-87579-8, ISBN 978-0-387-87578-1.
- ^ Hoskin PJ, Radiotherapy, in Sykes N, Bennett MI & Yuan C-S (a cura di), Clinical pain management: Cancer pain, 2nd, London, Hodder Arnold, 2008, pp. 251–55, ISBN 978-0-340-94007-5.
- ^ a b Williams JE, Nerve blocks: Chemical and physical neurolytic agents, in Sykes N, Bennett MI & Yuan C-S (a cura di), Clinical pain management: Cancer pain, 2nd, Londra, Hodder Arnold, 2008, pp. 225–35, ISBN 978-0-340-94007-5.
- ^ a b c d e Cosgrove MA, Towns DK, Fanciullo GJ & Kaye AD, Interventional pain management, in Vadivelu N, Urman RD, Hines RL (a cura di), Essentials of pain management, New York, Springer, 2011, pp. 237–299, DOI:10.1007/978-0-387-87579-8, ISBN 978-0-387-87578-1.
- ^ a b Johnson MI, Oxberry SG & Robb K, Stimulation-induced analgesia, in Sykes N, Bennett MI & Yuan C-S (a cura di), Clinical pain management: Cancer pain, 2nd, Londra, Hodder Arnold, 2008, pp. 235–250, ISBN 978-0-340-94007-5.
- ^ Young RF & Brechner T, Electrical stimulation of the brain for relief of intractable pain due to cancer, in Cancer, vol. 57, 1986, pp. 1266–72, PMID 3484665.
Bibliografia[modifica | modifica wikitesto]
- (EN) DR Fitzgibbon e JD Loeser, Cancer pain: Assessment, diagnosis and management, Philadelphia, 2010, ISBN 1-60831-089-2.
- (EN) Foley KM, Acute and chronic cancer pain syndromes, in Doyle D, Hanks G, Cherny N & Calman K (a cura di), Oxford textbook of palliative medicine, Oxford, OUP, 2004, pp. 298–316, ISBN 0-19-851098-5.
- (EN) Urch CE & Suzuki R, Pathophysiology of somatic, visceral, and neuropathic cancer pain, in Sykes N, Bennett MI & Yuan C-S (a cura di), Clinical pain management: Cancer pain, 2nd, Londra, Hodder Arnold, 2008, ISBN 978-0-340-94007-5.
- (EN) Twycross R & Bennett M, Cancer pain syndromes, in Sykes N, Bennett MI & Yuan C-S (a cura di), Clinical pain management: Cancer pain, 2nd, Londra, Hodder Arnold, 2008, ISBN 978-0-340-94007-5.
- (EN) Schug SA & Auret K, Clinical pharmacology: Principles of analgesic drug management, in Sykes N, Bennett MI & Yuan C-S (a cura di), Clinical pain management: Cancer pain, 2nd, Londra, Hodder Arnold, 2008, ISBN 978-0-340-94007-5.
- (EN) Johnson MI, Oxberry SG & Robb K, Stimulation-induced analgesia, in Sykes N, Bennett MI & Yuan C-S (a cura di), Clinical pain management: Cancer pain, 2nd, Londra, Hodder Arnold, 2008, ISBN 978-0-340-94007-5.
- (EN) Cosgrove MA, Towns DK, Fanciullo GJ & Kaye AD, Interventional pain management, in Vadivelu N, Urman RD, Hines RL (a cura di), Essentials of pain management, New York, Springer, 2011, pp. 237–299, DOI:10.1007/978-0-387-87579-8, ISBN 978-0-387-87578-1.
| Controllo di autorità | LCCN (EN) sh87007052 · J9U (EN, HE) 987007536736805171 · NDL (EN, JA) 01198868 |
|---|