Membrana cellulare
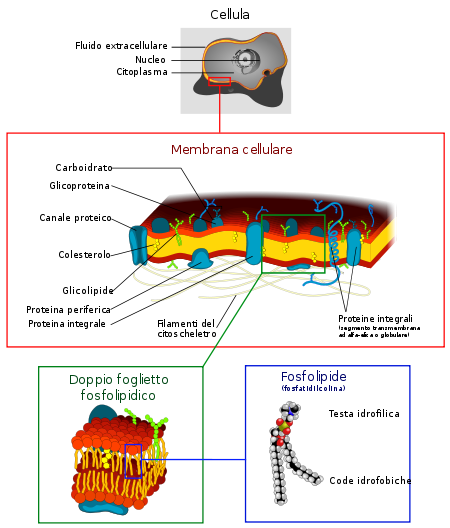
La membrana cellulare, detta anche membrana plasmatica, plasmalemma o citomembrana, è un sottile rivestimento, con spessore di 5-100 nm (50-1000 Å)[1], che delimita la cellula in tutti gli organismi viventi, la separa dall'ambiente esterno e ne regola gli scambi di elementi e sostanze chimiche. Nelle cellule eucariote delimita anche gli organelli interni alla cellula. Osservazioni al TEM (microscopio elettronico a trasmissione) hanno dimostrato che tutte le cellule sono delimitate da una membrana.
Formata in prevalenza da lipidi, in massima parte fosfolipidi, viene chiamata anche "doppio strato fosfolipidico" o "bilayer fosfolipidico", secondo l'accezione inglese, perché si dispongono in un doppio strato di fosfolipidi con le teste idrofile volte verso l'ambiente esterno e il citoplasma. Le code idrofobe di conseguenza sono in contatto tra loro "nell'interno" del bilayer. Questa disposizione minimizza la superficie delle teste idrofile in contatto con l'acqua.
Nella componente lipidica si vanno a collocare, con importanti funzioni fisiologiche, proteine e una piccola percentuale di glucidi, in forma di glicoproteine e glicolipidi, e di molecole di colesterolo che la stabilizzano. Questa conformazione rende ragione delle principali funzioni delle membrane, in particolare del trasporto di sostanze dall'esterno della cellula all'interno e viceversa.
Esiste una sostanziale uniformità di struttura fra il plasmalemma e le altre membrane che delimitano i diversi comparti cellulari o organuli. Negli organismi eucarioti animali la membrana cellulare è lo strato più esterno, mentre nelle cellule eucariote vegetali è presente una parete cellulare; in alcuni procarioti la membrana cellulare è ricoperta da un rivestimento protettivo chiamato parete batterica.
Descrizione
[modifica | modifica wikitesto]Composizione e asimmetria della membrana cellulare
[modifica | modifica wikitesto]Nella membrana cellulare si trova una grande quantità di lipidi (in particolare fosfolipidi).
I lipidi sono le molecole più rappresentate nella membrana plasmatica; quelli di membrana in cellule diverse, o anche in organuli diversi della stessa cellula, possono differire comunque per alcune caratteristiche:
- lunghezza delle code idrofobe e loro grado d'insaturazione;
- struttura della testa polare;
- presenza di steroli.
Queste diversità sono legate alla presenza di specifiche catene laterali idrofobiche che li compongono.
Oltre alla componente lipidica si trovano numerose proteine (in rapporto 1:50 rispetto ai lipidi; per ogni proteina ci sono circa 50 molecole lipidiche), aventi importanti funzioni fisiologiche. Quelle di membrana sono distribuite in maniera asimmetrica sui due strati. Esistono proteine intrinseche che hanno dei domini transmembrana molto idrofobi ed estrinseche che interagiscono con la superficie polare del doppio strato fosfolipidico e con le porzioni extra membrana delle proteine intrinseche.
Si riscontra anche una piccola percentuale di glucidi (= carboidrati) in forma di glicoproteine e glicolipidi e di molecole di colesterolo che stabilizzano la membrana.
I carboidrati costituiscono dei siti di riconoscimento possono essere legati alle proteine formando le glicoproteine o ai lipidi formando i glicolipidi.
La composizione dei due strati, esterno e interno, della membrana cellulare presenta notevoli differenze, non solo nella componente proteica, ma anche nella stessa componente lipidica, per cui la membrana plasmatica è caratterizzata da una marcata asimmetria, che riflette le differenti funzioni dei due monostrati. Tale asimmetria presenta importanti funzioni ed è finemente controllata dalla cellula.
Modello a mosaico fluido
[modifica | modifica wikitesto]
Secondo il "modello a mosaico fluido", proposto nel 1972 da S. J. Singer e G. L. Nicholson, il doppio strato lipidico della membrana plasmatica è allo stato di liquido-cristallino ed in esso sono immerse numerose proteine, che grazie alla fluidità della componente lipidica presentano un notevole grado di mobilità; ad esse spetta lo svolgimento della gran parte delle funzioni di membrana. Il doppio strato lipidico non ha carattere omogeneo, ma piuttosto all'interno del mosaico fluido sono presenti microdomini lipidici meno fluidi (lipid rafts Simon e Ikonen, 1997), formati principalmente da sfingolipidi e colesterolo allo stato liquido-ordinato, che funzionerebbero sia da zattere di trasporto di componenti di membrana, sia da piattaforme per la genesi di segnali intracellulari, per cui in essi sono concentrate proteine specifiche.
Attualmente si distinguono due tipi di zattere lipidiche: le caveole e le zattere "non invaginate". Le prime si presentano morfologicamente come fossette (caveole) della superficie cellulare e biochimicamente sono caratterizzate dalla presenza della proteina strutturale caveolina (caveolinea), essenziale per la loro costituzione. I rafts "non invaginati" sono piattaforme morfologicamente indistinguibili dalla restante porzione della membrana cellulare; in condizioni basali sono di piccolissime dimensioni, ma sono in grado di confluire per formare piattaforme di maggiori dimensioni in seguito a stimolazione, ad esempio in conseguenza del legame dei recettori, contenuti nei rafts, con i corrispondenti segnali extracellulari.
Il concetto iniziale del modello a mosaico fluido, che prevedeva una distribuzione casuale delle proteine con ampia libertà di movimento laterale e di rotazione, deve quindi essere rivisto in favore di un modello di membrana in cui all'interno del doppio strato lipidico fluido esistono domini lipidici e aggregati proteici a carattere dinamico, la cui mobilità è ristretta sia dai legami lipidi-lipidi, proteina-proteina o proteina-lipidi, sia dalle interazioni delle proteine con il citoscheletro, con la matrice extracellulare o con cellule adiacenti.
Fluidità della membrana cellulare
[modifica | modifica wikitesto]
In condizioni fisiologiche, sia le molecole lipidiche sia quelle proteiche in essa immerse sono in grado di muoversi all'interno del proprio monostrato della membrana cellulare. A temperature fisiologiche, la membrana cellulare è allo stato lamellare liquido-cristallino, in cui le catene idrocarboniose dei lipidi sono allo stato fluido, per cui manifestano una notevole libertà di movimento (stato L alfa di Luzzati). Al contrario, allo stato cristallino le catene idrocarboniose presentano una disposizione rigida, parallela alla perpendicolare della superficie del doppio strato (L beta) o angolata rispetto a questa (L beta'). La temperatura alla quale si verifica la fusione delle catene alifatiche, cioè il passaggio dallo stato cristallino a quello liquido-cristallino, si definisce temperatura di transizione (Tc o Temperatura Critica oppure Tm da melting).
La maggior parte delle proteine presenta movimenti di spostamento (diffusione) laterale; fanno eccezione le proteine di membrana ancorate al citoscheletro. Per quanto riguarda i lipidi di membrana, sono stati descritti diversi tipi di movimenti, che possono essere intramolecolari (1) o intermolecolari (2-4):
- Rotazione intorno ai legami semplici C-C
- Rotazione intorno all'asse longitudinale
- Rotazione intorno all'asse trasversale (la rotazione di 180° porta ad un movimento di flip-flop)
- Diffusione laterale
- Movimenti collettivi, come l'ondulazione della membrana
Il movimento intermolecolare si svolge soprattutto in direzione orizzontale (diffusione laterale), oltre che intorno agli assi longitudinale e trasversale della molecola (rotazione e oscillazione), ma solo raramente avviene la rotazione trasversale di 180°, che causa il passaggio della molecola da un monostrato all'altro (movimento di flip-flop). Infatti dal punto di vista termodinamico è sfavorevole per una molecola polare penetrare con la sua estremità idrofila attraverso la parte idrofoba del doppio strato; la spesa di energia è minore nel caso di una molecola lipidica, ma anche in questo caso lo spostamento da una parte all'altra della membrana avviene molto lentamente. Nelle membrane artificiali e naturali, una singola molecola lipidica scambia il posto con quelle vicine con una frequenza di circa 107 volte al secondo e diffonde alcuni micron al secondo a 37 °C, con un coefficiente di diffusione (D) di circa 10–8 cm²/s. A questa velocità di spostamento, una molecola lipidica può diffondere lungo l'intera cellula batterica (≈1 micron) in un solo secondo, mentre può percorrere l'intera circonferenza di una cellula animale in circa 20 secondi.
I movimenti intramolecolari consistono nella rotazione intorno ai legami semplici C-C, che comporta l'isomerizzazione tra le differenti conformazioni della molecola lipidica, in particolare l'isomerizzazione trans-gauche. I movimenti di rotazione dei gruppi metilici e di isomerizzazione trans-gauche sono massimi verso il centro del doppio strato lipidico. La conformazione trans è la più stabile (minor contenuto di energia) in quanto i gruppi metilici sono alla massima distanza tra loro. Alla configurazione tutto trans (quando tutti i gruppi metilici sono in conformazione trans) la catena idrocarboniosa ha la sua massima lunghezza, in quanto la molecola è completamente distesa, mentre la presenza di conformazione gauche causa un piegamento della molecola. Allo stato cristallino (L beta), le catene alifatiche dei fosfolipidi sono in conformazione tutto trans, con l'aumento della temperatura l'eccitazione termica delle catene favorisce l'isomerizzazione trans-gauche. Poiché la percentuale delle conformazioni gauche aumenta con l'aumentare della temperatura, alle alte temperature le catene idrocarboniose dei fosfolipidi sono più corte.

I principali fattori che determinano la fluidità della membrana cellulare sono, oltre alla temperatura:
- Lunghezza degli acidi grassi;
- Grado di insaturazione degli acidi grassi delle code dei fosfolipidi;
- Caratteristiche della testa polare;
- Concentrazione del colesterolo nella membrana.
Nei fosfogliceridi si trovano due tipi di acidi grassi: quelli saturi, in cui tutti i legami che gli atomi di carbonio possono formare sono saturati con atomi di idrogeno, e quelli insaturi, nei quali si formano doppi legami tra gli atomi di carbonio.
La fluidità del doppio strato lipidico è in parte dovuta alla abbondanza relativa degli acidi grassi insaturi; in genere l'acido grasso in posizione 2 dei fosfogliceridi è insaturo, tuttavia il grado di insaturazione varia a seconda della specie lipidica, essendo la fosfatidiletanolamina e la fosfatidilserina (prevalenti nel monostrato interno della membrana) più insature rispetto agli altri fosfolipidi, in primo luogo rispetto alla sfingomielina, che presenta circa il 70% di acidi grassi saturi.
La presenza di catene insature provoca un maggiore disordine nell'allineamento delle catene, rendendo più fluida la membrana, mentre le catene sature con il loro allineamento più compatto favoriscono la formazione di un reticolo rigido.
Infatti, i doppi legami con configurazione cis (che costituiscono la configurazione di quasi tutti gli acidi grassi insaturi naturali) causano un inginocchiamento della catena idrocarboniosa, per cui si riduce la lunghezza dei segmenti paralleli che interagiscono con le molecole vicine, ottenendo lo stesso effetto di un accorciamento della catena; il massimo effetto si ha quando il doppio legame occupa la posizione intermedia tra la fine della catena ed il glicerolo: allontanandosi il doppio legame dalla posizione intermedia, la lunghezza del segmento parallelo aumenta progressivamente e diventano maggiori le interazioni con le catene vicine.
Al contrario i doppi legami in conformazione trans hanno un effetto di gran lunga inferiore sulla fluidità di membrana, in quanto la catena idrocarboniosa mantiene quasi la stessa conformazione delle catene sature (la sfingosina presenta un doppio legame trans).
Un altro fattore che influisce sulla fluidità della membrana cellulare è il volume occupato dalla testa polare dei fosfolipidi, che è dipendente dal suo grado di idrofilia. Il volume occupato dalla testa idratata rispetto all'area occupata dalle due catene idrocarboniose influenza lo spazio a disposizione per il movimento delle catene idrocarboniose e quindi la compattezza del loro allineamento. Per esempio, le teste della fosfatidiletanolamina occupano poco spazio per la formazione di legami idrogeno tra i gruppi –NH e i gruppi -PO-4, mentre le teste di fosfatidilcolina, prive di gruppi donatori, interagiscono attraverso le molecole di acqua legate, cosicché l'area occupata da ciascuna testa misura 47-54 Å, molto di più dell'area di sezione occupata dalle due catene idrocarboniose. Ciò determina una minore vicinanza delle catene idrocarboniose, che possono così formare un minor numero di legami fra loro. Di conseguenza, gli acidi grassi della fosfatidilcolina hanno una maggior libertà di movimento, per cui la fluidità della membrana risulta aumentata.
La libertà di movimento della catena idrocarboniosa è espressa dal parametro S o parametro di ordine di orientamento, che è funzione degli angoli tra la perpendicolare alla membrana e gli assi x, y, z del sistema cartesiano relativo al gruppo CH2 in esame, in modo che S = 1 significa ordine e S = 0 disordine.
Marcando con deuterio gli atomi di C in posizioni sequenziali lungo la catena idrocarboniosa, le tecniche di risonanza hanno dimostrato che la massima mobilità si verifica all'estremità delle code idrocarboniose e corrisponde al centro del doppio strato, mentre la minore mobilità si registra in prossimità della testa polare.
La natura della testa polare influenza l'ordine della catena idrocarboniosa prossimale, cosicché la mobilità è minore per gli etilenamminofosfolipidi rispetto ai colinofosfolidi.
L'ordine della catena è influenzato anche dalla presenza di colesterolo e dal grado di saturazione della catena e naturalmente dalla temperatura.
Effetti del colesterolo sulla fluidità della membrana
[modifica | modifica wikitesto]Sebbene il colesterolo sia troppo idrofobico per formare, in dispersione pura, lamine bimolecolari, esso concorre alla struttura della membrana cellulare intercalandosi tra le molecole di fosfolipidi. Il colesterolo è composto da un anello tetraciclico (ciclopentanoperidrofenantrene), che costituisce il nucleo steroideo, contenente un gruppo ossidrilico in posizione 3 e due gruppi metilici (C18 e C19), e da una catena laterale iso-ottilica. Il colesterolo è inserito perpendicolarmente nella membrana cellulare, in modo che il suo gruppo ossidrilico sia situato verso l'esterno, mentre la catena ottilica è inserita nella profondità della membrana. Il nucleo steroideo del colesterolo ha una struttura planare relativamente rigida e risulta asimmetrico rispetto al piano dell'anello tetraciclico, dal momento che una faccia espone i gruppi metilici, mentre l'altra è liscia e priva di sostituenti. La faccia liscia del nucleo steroideo viene in contatto con i gruppi CH2 prossimali (C1 – C10) delle catene alifatiche sature dei fosfolipidi, mentre l'altra faccia, più ingombrante, interagisce con le catene insature dei fosfolipidi oppure con le proteine di membrana. Il gruppo ossidrilico in posizione 3 è in contatto con l'ambiente acquoso extracellulare, posizionandosi nei pressi della testa polare dei fosfolipidi, nelle immediate vicinanze del gruppo carbossilico esterificato degli acidi tapti.
Per questa sua posizione, il colesterolo riduce la libertà di movimento del tratto prossimale (più vicino al glicerolo) delle catene degli acidi grassi, con scarso effetto sul tratto distale, che occupa il centro della membrana cellulare. Gli studi di risonanza hanno, infatti, dimostrato che il colesterolo aumenta l'ordine del tratto prossimale delle catene alifatiche, diminuendo l'isomerizzazione trans-gauche e gli inginocchiamenti transitori delle catene stesse.
Quindi, a causa della rigidità della sua struttura, l'effetto del colesterolo sui fosfolipidi, a temperature al di sopra della Tm, è quello di aumentare l'ordine del tratto prossimale delle catene degli acidi grassi, mentre l'effetto sul tratto distale, al centro del doppio strato lipidico della membrana, è scarso.
Al contrario, a temperature inferiori alla Tm, l'effetto del colesterolo è quello di diminuire l'ordine delle catene alifatiche degli acidi grassi e di ostacolarne la cristallizzazione, in quanto interferisce con l'interazione CH2-CH2 tra le catene idrocarboniose dei fosfolipidi.
A causa del maggior contenuto di sfingolipidi e di colesterolo, i rafts presentano un minor grado di fluidità rispetto alle restanti regioni della membrana plasmatica. Proprio il maggior ordine delle catene lipidiche nei rafts, porta alla separazione di questi microdomini dalla restante membrana allo stato liquido-cristallino L alfa.

La nuova fase che si forma per l'effetto del colesterolo sugli altri lipidi è stata denominate da Zuckermann (1993) liquido-ordinata o lo, intermedia tra la fase cristallina e quella liquido-cristallina. Le catene idrocarboniose in fase lo sono distese e strettamente impaccate, come nella fase cristallina, ma conservano un alto grado di mobilità laterale.
Nelle miscele binarie di colesterolo con un fosfolipide saturo (che quindi ha una elevata Tm), al di sopra della Tm si separa una fase lo da una fase liquido-cristallina, mentre al di sotto della Tm la fase lo si separa dalla fase cristallina.
Poiché gli sfingolipidi hanno una maggiore saturazione e una più elevata Tm, rispetto ai fosfogliceridi, anche il maggior contenuto in sfingolipidi favorisce la separazione di domini lo e quindi la formazione dei rafts.
In conclusione, è lo stretto impaccamento delle catene idrocarboniose la caratteristica chiave della esistenza dei rafts.
Data l'asimmetria della membrana, gli sfingolipidi si localizzano per la massima parte nel foglietto esterno del doppio strato, per cui i rafts sono probabilmente più abbondanti in questo foglietto. Tuttavia, la formazione di rafts nel foglietto interno è favorita dai fosfolipidi contenenti etanolammina (fosfatidiletanolammina e plasmeniletanolammina), i quali grazie alla piccola testa polare hanno un'influenza favorevole sull'impaccamento delle code idrocarboniose. Va sottolineato che la separazione di fase che occorre nei rafts favorisce la partizione di proteine provviste di ancore lipidiche sature o che comunque abbia preferenza per gli ambienti lo. Per questo motivo i rafts contengono proteine specifiche.
Un'altra conseguenza dell'effetto del colesterolo sugli acidi grassi dei fosfolipidi è l'aumento di spessore delle membrane, dovuto alla diminuzione delle isomerizzazioni trans-gauche e, quindi, alla tendenza del tratto prossimale delle catene alifatiche ad assumere di preferenza la configurazione trans, anche se non si manifesta mai la configurazione all trans tipica dello stato cristallino. Tuttavia, per concentrazioni di colesterolo superiori al 25%, la lunghezza delle catene si riduce a causa dell'impaccamento delle catene dei fosfolipidi del foglietto opposto, che sono disposti di fronte alle molecole del colesterolo. Queste coppie opposte colesterolo-fosfolipidi sono più corte delle coppie opposte fosfolipidi-fosfolipidi.
Permeabilità della membrana cellulare
[modifica | modifica wikitesto]
La membrana plasmatica è una barriera selettivamente permeabile tra il citoplasma e l'ambiente extracellulare. Questa caratteristica è conseguenza della composizione lipidica e proteica della membrana. Il doppio strato fosfolipidico permette il libero passaggio, dell'acqua, di gas (O2, CO2) e di piccole molecole liposolubili (prive di carica), come ammoniaca, urea, etanolo e glicerolo, mentre specifiche proteine di trasporto assicurano il passaggio di ioni e molecole idrosolubili (elettricamente cariche). A differenza di quanto avviene per i composti a basso p.m. (peso molecolare), il trasporto di macromolecole è un processo molto più complesso, che non si svolge esclusivamente nella membrana cellulare, ma che interessa sia la membrana plasmatica che il citoplasma e che richiede la formazione di vescicole (trasporto vescicolare), al cui interno sono contenute le macromolecole da trasportare. Il trasporto vescicolare viene utilizzato sia per trasferire macromolecole extracellulari all'interno della cellula (endocitosi), come nel caso delle lipoproteine a bassa densità (LDL) o del complesso Fe-transferrina, sia per trasportare composti intracellulari nell'ambiente extracellulare (esocitosi).
Diffusione passiva
[modifica | modifica wikitesto]Il passaggio attraverso la componente lipidica della membrana avviene per semplice diffusione passiva, secondo il gradiente di concentrazione tra i compartimenti intra- ed extracellulare e senza consumo di energia (ATP). Il movimento delle molecole è diretto dal compartimento a più alta concentrazione a quello a concentrazione più bassa ed è influenzato dalle dimensioni e dalla lipofilia della molecola.
Ad esempio, la dietilurea, che è 50 volte più idrofobica dell'urea, diffonde attraverso la membrana cellulare 50 volte più velocemente di questa, nonostante le maggiori dimensioni. Secondo la teoria del mobile kink il passaggio delle molecole attraverso il doppio strato lipidico avverrebbe attraverso gli spazi tra le catene degli acidi grassi dei fosfolipidi. La formazione di questi spazi è favorita dalla mobilità, dalla isomerizzazione trans-gauche e dalla presenza di insaturazioni, che causano una piegatura o "inginocchiamento" (kink) dell'acido grasso. Di conseguenza, la massima resistenza alla diffusione delle molecole lipofile corrisponde al segmento prossimale delle catene degli acidi grassi, che presentano una minore mobilità (o maggiore rigidità), mentre la resistenza minore corrisponde al segmento terminale delle catene, che, al contrario, manifesta la massima mobilità.
Trasporto mediato da canali proteici
[modifica | modifica wikitesto]
La maggioranza delle molecole attraversa la membrana plasmatica con l'aiuto di proteine di trasporto. Oltre alle molecole idrosolubili, come l'urea, anche alcune molecole liposolubili, si avvalgono anche del trasporto mediato dalle proteine, con lo scopo di potenziarne il passaggio, qualora siano presenti particolari necessità funzionali, come si verifica nei tubuli renali. Si riconoscono diversi tipi di trasporto mediato da proteine: trasporto passivo, detto anche diffusione facilitata, che avviene secondo gradiente e perciò senza dispendio di energia, e trasporto attivo, che avviene contro gradiente e perciò con dispendio di energia. Si distinguono tre tipi di trasporto attivo: uniporto, simporto e antiporto. Nell'uniporto si ha il trasporto di un'unica specie di soluto. Nel simporto e nell'antiporto si ha il trasporto accoppiato di due diverse specie di soluti: nel simporto il trasporto dei due soluti avviene nella stessa direzione, mentre nell'antiporto avviene in direzione opposta. Il trasporto attivo può essere distinto in primario o secondario, in base alla modalità con cui è prodotta l'energia necessaria al trasporto.
Trasporto passivo
[modifica | modifica wikitesto]- modelli di trasporto passivo
-
Canale ionico
-
Diffusione facilitata
Nel trasporto passivo il passaggio di una molecola idrosolubile (uniporto) avviene per diffusione secondo il gradiente di concentrazione e, nel caso di molecole elettricamente cariche, anche secondo il gradiente elettrico. Tuttavia, a differenza di quanto accade nella diffusione passiva delle molecole liposolubili, in questo caso la diffusione è facilitata dall'intervento di proteine. Due classi di proteine sono responsabili del trasporto passivo, i carriers e i canali.
I carriers mediano il trasporto di glucidi, aminoacidi e nucleosidi. Una volta legato il soluto nel compartimento ad alta concentrazione, il carrier va incontro ad un cambiamento conformazionale che permette il trasferimento del soluto nel compartimento a bassa concentrazione.
Nel caso dei canali, le proteine formano dei pori nella membrana plasmatica, che consentono la diffusione di ioni o di piccole molecole idrosolubili di idoneo peso molecolare e carica elettrica. Fanno parte dei canali le acquaporine, che favoriscono il passaggio di molecole di acqua.
L'apertura dei canali può essere regolata da recettori (canali ROC - Receptor Operated Channels), da secondi messaggeri (canali SMOC o Second Messenger Operated Channels) o dal potenziale elettrico della membrana (canali VOC o Voltage Operated Channels), cosicché il passaggio può essere finemente modulato. Ne è un chiaro esempio la complessa famiglia dei canali del calcio, la cui complessità è in relazione con il ruolo determinante che il calcio intracellulare ha nel controllo di un'ampia serie di funzioni cellulari. I canali delle gap junctions permettono il passaggio di molecole da una cellula all'altra.
Trasporto attivo
[modifica | modifica wikitesto]- Modelli di trasporto attivo
-
Uniporto attivo (ATP → ADP + Pi)
-
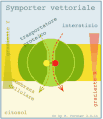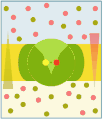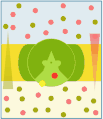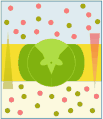
Simporto vettoriale
-
Antiporto vettoriale
Nel trasporto attivo primario le proteine trasportano i soluti contro il gradiente elettrochimico, utilizzando l'energia ottenuta dall'idrolisi dell'ATP, per cui queste proteine sono dotate di attività enzimatica (ATPasi). Le pompe trasportano ioni, mentre i trasportatori ABC (ATP-binding cassettes) trasportano un'ampia gamma di molecole, compresi glucidi, aminoacidi e ioni. Il legame dell'ATP alla proteina di trasporto permette il cambiamento conformazionale necessario al trasferimento del soluto.
Nel trasporto attivo secondario, l'energia necessaria al trasporto di un soluto contro il suo gradiente di concentrazione non è fornita direttamente dall'ATP, ma dall'esistenza di un gradiente elettrochimico del Na+ (o di H+) prodotto dalla rispettiva pompa ionica. Il trasporto attivo secondario è quindi indirettamente accoppiato ad un sistema di trasporto attivo primario, che genera il gradiente elettrochimico.
Nel trasporto attivo secondario si ha, quindi, il trasporto accoppiato di due diverse specie di soluti: il Na+ (o H+) è trasportato passivamente dall'ambiente a concentrazione elevata al compartimento a bassa concentrazione, mentre l'altro soluto è trasportato, sempre passivamente, contro il gradiente di concentrazione dal compartimento a bassa concentrazione verso quello ad alta concentrazione, sfruttando il gradiente elettrico favorevole generata dal trasporto dello ione accoppiato. Nel simporto (cotrasporto) il trasporto dei due soluti avviene nella stessa direzione, mentre nell'antiporto (scambio) avviene in direzione opposta. Anche in questo caso il trasferimento dei soluti avviene grazie al cambiamento conformazionale della proteina trasportatrice, che è indotto dal legame dei soluti stessi.
Un esempio di trasporto attivo secondario è quello del glucosio all'interno della cellule epiteliali dell'intestino. Una proteina di membrana detta cotrasportatore Na+/glucosio, sfrutta il gradiente del sodio per trasportare il glucosio contro gradiente.
Funzioni
[modifica | modifica wikitesto]La membrana cellulare presiede all'omeostasi cellulare, grazie alla sua permeabilità selettiva.
Per la sua posizione di interfaccia, la membrana plasmatica, oltre alla funzione strutturale, svolge altre funzioni essenziali:
- La funzione di isolamento fisico, poiché rappresenta una barriera tra liquido intracellulare e liquido extracellulare.
- La funzione di filtro selettivo, che lascia passare alcune sostanze piuttosto che altre, assicurando così l'integrità biochimica del citoplasma;
- La funzione di superficie di comunicazione, permettendo sia lo scambio di informazioni tra l'ambiente intra- ed extracellulare, sia l'interazione fisica con le strutture extracellulari circostanti.
- La funzione di superficie catalitica, dato l'abbondante numero di enzimi ad essa legati, in gran parte coinvolti nella produzione di messaggeri intracellulari, come le fosfolipasi e la sfingomielinasi, che idrolizzano i fosfolipidi di membrana, e l'adenilciclasi, che sintetizza AMP ciclico.
- La funzione di supporto strutturale, attraverso le proteine di membrana ancorate al citoscheletro e le giunzioni cellulari mantiene la forma della cellula.
Infine, la membrana cellulare partecipa a funzioni complesse: esocitosi (secrezione), endocitosi (ingestione di sostanze esterne mediante la formazione di vescicole), adesione e movimento cellulare ameboide (es. leucociti).
La struttura e le funzioni della membrana plasmatica sono comuni a quelle delle membrane intracellulari, come ad esempio la membrana nucleare.
Note
[modifica | modifica wikitesto]- ^ Gerald Karp: Cell and molecular biology, 2006, 6th ed.
Bibliografia
[modifica | modifica wikitesto]- Alberts, Bruce: Molecular Biology of the Cell, 2002 4th ed; 2008 5th ed.
- Yeagle, Philip: The Structure of Biological Membranes, 2005, 2th ed.
Modello a mosaico fluido
- Singer, S. J., and G. L. Nicolson. 1972. The fluid mosaic model of the structure of cell membranes. Science. 175:720-731.
- Simons, K., E. Ikonen. 1997. Functional rafts in cell membranes. Nature. 387:569–572
- Parton, R. G. 1996. Caveolae and caveolins. Curr. Opin. Cell Biol. 8:542–548.
- Harder, T., and K. Simons. 1997. Caveolae, DIGs, and the dynamics of sphingolipid-cholesterol microdomains. Curr. Opin.Cell Biol. 9:534–542.
- Brown, D.A., E. London. 1998. Functions of lipid rafts in biological membranes. Annu. Rev. Cell Dev. Biol 14:111–136
- Brown, D.A., and E. London. 1998. Structure and origin of ordered lipid domains in biological membranes. J. Membr. Biol. 164:103–114.
- Simons, K., and D. Toomre. 2000. Lipid rafts and signal transduction. Nat. Rev. Mol. Cell Biol. 1:31–39.
- Zhi-Jie Cheng. 2006. Membrane microdomains, caveolae, and caveolar endocytosis of sphingolipids. Molecular Membrane Biology, 23:101-110.
- Quinn, Peter J. 2011. A lipid matrix model of membrane raft structure. Progress in Lipid Research 49:390–406.
Fluidità della membrana cellulare ed effetti del colesterolo
- Luzzati, V. 1968. X-ray diffraction studies of lipid-water systems. In Biological Membranes, vol 1. Edited by Chapman D. New York. Academic Press.
- Luzzati, V. 1974. Order-Disorder Conformational Transitions of the Hydrocarbon Chains of Lipids. J. Mol. Biol. 85:249-277.
- Seelig, A. 1974. The dynamic structure of fatty acyl chains in a phospholipid bilayer measured by deuterium magnetic resonance. Biochemistry. 13:4839-4845.
- Bloch, K.E. 1983. Sterol structure and membrane function, CRC Crit. Rev. Biochem. 14:47–92.
- Small, D. M. 1986. The physical chemistry of lipids. In The Handbook of Lipid Research, vol. 4. D. J. Hanahan, series editor. Plenum Press, New York.
- Boggs, Joan M. 1987.Lipid intermolecular hydrogen bonding: influence on structural organization and membrane function Biochimica et Biophysica Acta 906:353-404.
- Tate, M. W., and S. M. Gruner. 1987. Lipid polymorphism of dioleoylphosphatidylethanolamine and saturated and monounsaturated phosphatidylcholines of various chain lengths. Biochemistry. 26:231–236.
- Marsh, D. 1990. Handbook of Lipid Bilayers. CRC Press, Boca Raton.
- Seddon, J. M. 1990. Structure of the inverted hexagonal (HII) phase, and non-lamellar phase transitions in lipids. Biochim. Biophys. Acta. 1031:1–69.
- Yeagle, PL. 1991. Modulation of membrane function by cholesterol. Biochimie. 73:1303-1310.
- Mouritsen OG, Zuckermann MJ. 2004. What's so special about cholesterol? Lipids 39:1101–13.
- Pöyry, S. 2008. Significance of cholesterol methyl groups. J. Phys. Chem. B 112:2922–2929.
- Quinn, Peter J. 2009. The liquid-ordered phase in membranes. Biochimica et Biophysica Acta 1788:33–46
- Marsh, Derek. 2010. Molecular volumes of phospholipids and glycolipids in membranes. Chemistry and Physics of Lipids. 163:667–677.
- Chaudhuri, A. 2011. Transbilayer organization of membrane cholesterol at low concentrations. Biochimica et Biophysica Acta 1808:19–25.
Permeabilità della membrana cellulare
- Arguello, J.M. Metal Transport across Biomembranes: Emerging Models for a Distinct Chemistry. (2012). J. Biol. Chem. 287:13510-13517.
- Nagle, J.F., Mathai, j.C. (2008). Theory of Passive Permeability through Lipid Bilayers. J Gen Physiol. 131:77-85.
- Mathai, J.C. (2008). Structural Determinants of Water Permeability through the Lipid Membrane. J Gen Physiol. 131:69-76.
- Linton, K.J. (2007). Structure and Function of ABC Transporters. Physiology. 22:122-130.
- Scheiner-Bobis, G. (2000). The sodium pump: Its molecular properties and mechanics. Eur. J. Biochem. 269:2424–2433.
- Pao S. (1998). Major Facilitator Superfamily. Microbiol. Mol. Biol. Rev. 62:1–34.
- Orlowski, J. (1997). Na+/H+ Exchangers of Mammalian Cells. J. Biol. Chem. 272:22373-22376.
- Haines, T.H. (1994). Water transport across biological membranes. FEBS Lett. 346:115–122.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «plasmalemma»
Wikizionario contiene il lemma di dizionario «plasmalemma» Wikiversità contiene risorse sulle membrane cellulari
Wikiversità contiene risorse sulle membrane cellulari Wikimedia Commons contiene immagini o altri file sulle membrane cellulari
Wikimedia Commons contiene immagini o altri file sulle membrane cellulari
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) cell membrane, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 35472 · LCCN (EN) sh85021654 · GND (DE) 4067550-6 · BNF (FR) cb11958886k (data) · J9U (EN, HE) 987007284825105171 · NDL (EN, JA) 00569973 |
|---|