Borazina
| Borazina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| 1,3,5,2,4,6-triazatriborinano | |
| Nomi alternativi | |
| ciclotriborazano borazolo | |
| Caratteristiche generali | |
| Formula bruta o molecolare | B3N3H6 |
| Massa molecolare (u) | 80,051 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 641-426-2 |
| PubChem | 138768 |
| SMILES | B1NBNBN1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,81 |
| Solubilità in acqua | si idrolizza |
| Temperatura di fusione | 218 K (−55 °C) |
| Temperatura di ebollizione | 331 K (58 °C) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −541,0 |
| ΔfG0 (kJ·mol−1) | −392,7 |
| S0m(J·K−1mol−1) | 199,6 |
| Indicazioni di sicurezza | |
La borazina o borazolo è un composto chimico della famiglia dei borani, di formula B3N3H6.
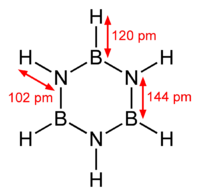
La molecola ricorda nella forma il benzene, con un anello esagonale di boro e azoto alternati, tanto da essere nota anche come benzene inorganico.
Molte proprietà fisiche, tra cui la temperatura di ebollizione critica e gli spettri UV e IR, sono assai simili a quelli del benzene. Tuttavia, tra le tre forme di risonanza prevale quella con tutti orbitali σ, nella quale il doppietto degli atomi di azoto, più elettronegativo, non si delocalizza. Pertanto la borazina non presenta carattere aromatico, ha invece elevata reattività chimica e forma composti per addizione più frequentemente che per sostituzione. Inoltre, l'azoto è ibridato sp2 (forma 3 legami in tutto, di cui uno doppio, e quindi il suo numero sterico è pari a 3), così come il boro. La molecola, pertanto, è planare. La distanza interatomica tra boro e azoto è di 144 pm.
Sintesi
[modifica | modifica wikitesto]La borazina è stata osservata per la prima volta nel 1926 dai chimici Alfred Stock e Pohland tramite la reazione dell'ammoniaca con il diborano; la reazione avviene attorno ai 250-300 °C:
- 3 B2H6 + 6 NH3 → 2 B3H6N3 + 12 H2↑
Un metodo più efficace consiste nella reazione del boroidruro di litio con il cloruro d'ammonio:
- 3 LiBH4 + 3 NH4Cl → B3H6N3 + 3 LiCl + 9 H2↑
Struttura
[modifica | modifica wikitesto]La borazina è isostrutturale al benzene. I sei legami B-N hanno una lunghezza di 143,6 pm, comparabile con 139,7 pm per il legame C-C nel benzene. Un legame singolo fra il boro e l'azoto è lungo 151 pm, il che suggerisce la donazione del doppietto elettronico da parte dell'azoto nell'orbitale p del boro che è invece libero. La forza dei legami nella borazina è anche data dalla grande differenza in elettronegatività fra i due atomi (3,04 per N e 2,04 per B sulla scala di Pauling). Tutto ciò suggerisce la possibilità di proporre una risonanza per la struttura:

L'azoto agisce come una base di Lewis, donando un doppietto di elettroni, mentre il boro agisce come un acido di Lewis, ricevendo un doppietto in un orbitale vuoto.
Reattività
[modifica | modifica wikitesto]
Pur avendo struttura simile, la borazina è molto più reattiva del benzene poiché l'energia di delocalizzazione è molto minore e gli elettroni non sono distribuiti equamente intorno alla molecola. Ad esempio, l'aggiunta di acido cloridrico provoca la reazione di addizione:
nella quale l'atomo di cloro si lega al boro, l'elettrofilo, mentre l'atomo di idrogeno all'azoto, il nucleofilo. Il benzene non reagisce sotto le medesime condizioni per non perdere l'aromaticità. Se la borazina viene riscaldata fino a una temperatura di 70 °C si può formare un polimero, nel quale singoli monomeri di borazina si legano alla posizione para.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su borazina
Wikimedia Commons contiene immagini o altri file su borazina
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) borazine, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | GND (DE) 4146305-5 |
|---|