Biotina
| Biotina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
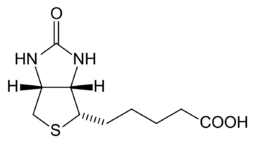
| acido 5-[(3aS,4S,6aR)-2-oxoexaidro-1H-tieno[3,4-d]imidazol-4-il]pentanoico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C10H16N2O3S |
| Numero CAS | |
| Numero EINECS | 200-399-3 |
| PubChem | 171548 |
| DrugBank | DB00121 |
| SMILES | C1C2C(C(S1)CCCCC(=O)O)NC(=O)N2 |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |
La biotina (unica denominazione internazionale ammissibile secondo la IUPAC) venne scoperta a seguito di alcuni studi riguardanti le alterazioni cutanee e della crescita verificatesi in animali nutriti esclusivamente con albume d'uovo crudo o proteine da esso estratte.
In passato essa era anche nota come: vitamina H (o talvolta vitamina I) nella nomenclatura tedesca; vitamina B7 in quella anglosassone; vitamina B8 in quella francese.
Il fattore la cui carenza è responsabile della comparsa della "malattia da bianco d'uovo" venne individuato nel 1931 e si è visto che esso è indispensabile per la corretta crescita dei mammiferi. Oggi è noto il fenomeno soggiacente allo sviluppo di questa patologia: il legame tra la biotina e l'avidina, una glicoproteina dell'albume d'uovo. Infatti l'avidina è resistente all'azione proteolitica dell'apparato gastrointestinale per cui il legame con la biotina impedisce l'assorbimento di quest'ultima.
Caratteristiche e processi chimici[modifica | modifica wikitesto]

Strutturalmente la biotina presenta due anelli tra loro condensati: uno tiofenico ed uno imidazolidinonico. Legata all'anello tiofenico vi è una catena laterale di acido valerianico.
La biotina è solubile in acqua e in questo stato è resistente al calore, alle basi ed agli acidi; si decompone per azione della luce ultravioletta e di forti ossidanti.
La biotina viene assunta dagli alimenti in forma libera o legata alle proteine. Attualmente non sono ben noti i meccanismi di assorbimento. Si ritiene che la scissione della biotina dalle proteine cui è legata avvenga per opera di una biotinasi secreta nel succo pancreatico. La vitamina libera viene assorbita a livello dell'ileo e del digiuno da due meccanismi di trasporto:
- uno attivo, contro gradiente di concentrazione, in cui una molecola di biotina viene scambiata con uno ione Na+,
- uno passivo, per diffusione semplice, operante solo in caso di alte concentrazioni di biotina.
Sembra che la biotina, una volta entrata nel plasma, venga trasportata da diverse proteine: NIGA ed α e β-globuline. Non è chiaro se esiste anche una proteina di trasporto specifica.
La biotina svolge il ruolo di cofattore di diverse carbossilasi ATP-dipendenti. Essa è legata al sito attivo dell'enzima tramite un legame peptidico che si forma tra il gruppo carbossilico dell'acido valerianico ed un gruppo aminico di un residuo di lisina. La reazione di carbossilazione, in cui interviene la biotina, prevede il trasferimento di una molecola di CO2 da un donatore ad un accettore, passando per un intermedio in cui la vitamina fissa la CO2 su uno degli atomi di azoto dell'anello imidazolico, formando così la carbossibiotina.
La formazione della carbossibiotina avviene tramite l'ausilio di bicarbonato, ioni magnesio ed ATP. Infatti il bicarbonato lega su di sé la CO2 tramite una reazione richiedente energia, fornita dall'idrolisi di una molecola ATP. La molecola di carbonilfosfato creatasi cede poi CO2 alla biotina, idrolizzando il gruppo fosfato.
La biotina viene utilizzata, nell'uomo, da quattro carbossilasi:
- la piruvato carbossilasi, per la trasformazione di piruvato in ossalacetato e quindi per la risintesi dei glucidi,
- la propionil CoA carbossilasi per la trasformazione di propionil-CoA in metilmalonil-CoA,
- la metilcrotonil carbossilasi,
- la acetil-CoA carbossilasi per trasformare acetil-CoA in malonil-CoA, importante nella sintesi degli acidi grassi.
Fonti alimentari[modifica | modifica wikitesto]
La biotina è presente sia nel regno animale sia in quello vegetale. Si trova anche nel latte umano e di vacca, nei latticini, nel tuorlo dell'uovo e nei frutti di mare. Soprattutto nei vegetali la biotina è presente legata in maniera energica alle proteine per cui la sua biodisponibilità è più bassa. La biotina è prodotta in elevate quantità anche dai batteri intestinali.
Carenza[modifica | modifica wikitesto]
Gli stati carenziali di biotina sono decisamente rari e si possono verificare in individui che assumono grandi quantità di uova crude o alla coque. Invece le uova cotte non hanno questo effetto in quanto la cottura denatura l'avidina. Sono stati anche descritti casi di carenza in individui nutriti solo per via parenterale. Sembra che anche la somministrazione di alte dosi di sulfamidici possa provocare carenza di biotina per l'alterazione massiccia della flora batterica che si può verificare. La carenza di biotina nell'adulto può dare origine a manifestazioni cutanee (desquamazioni).
Livelli di assunzione e tossicità[modifica | modifica wikitesto]
Dato che la biotina è presente in molti alimenti e che i batteri intestinali ne possono produrre alte quantità, non è al momento ben chiaro quali possono essere i livelli di assunzione raccomandabili. In effetti le diverse fonti al momento non sono concordi e riportano livelli altamente variabili nell'intervallo di 30-100 µg giornalieri.
Non si conoscono fenomeni di tossicità da biotina fino a livelli di 10 mg/die.
Note[modifica | modifica wikitesto]
- ^ Sigma Aldrich; rev. del 26.04.2012
Bibliografia[modifica | modifica wikitesto]
- Aldo Mariani Costantini, Carlo Cannella, Giovanni Tomassi, Fondamenti di Nutrizione Umana, Il Pensiero Scientifico Editore.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su biotina
Wikimedia Commons contiene immagini o altri file su biotina
Collegamenti esterni[modifica | modifica wikitesto]
- biotina, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) biotin, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- http://www.sinu.it/larn/vit_idro.asp Archiviato il 12 gennaio 2012 in Internet Archive.
- Biotina, in Treccani.it – Enciclopedie on line, Roma, Istituto dell'Enciclopedia Italiana.
| Controllo di autorità | Thesaurus BNCF 51225 · LCCN (EN) sh85014267 · GND (DE) 4145654-3 · BNF (FR) cb12266299x (data) · J9U (EN, HE) 987007282690405171 |
|---|