Herpes oftalmico: differenze tra le versioni
→Prevenzione: ampliamento+biblio |
|||
| Riga 177: | Riga 177: | ||
Gli studi avevano dimostrato che negli Stati Uniti, ogni anno, l'herpes zoster colpiva circa 200.000 persone sane di età compresa tra i 50 ed i 59 anni.<br> |
Gli studi avevano dimostrato che negli Stati Uniti, ogni anno, l'herpes zoster colpiva circa 200.000 persone sane di età compresa tra i 50 ed i 59 anni.<br> |
||
La nuova approvazione ha fatto seguito ad un ulteriore studio multicentrico, lo ZEST, condotto negli Stati Uniti ed in Europa su 22.439 persone di età compresa tra 50 e 59 anni.<br> |
La nuova approvazione ha fatto seguito ad un ulteriore studio multicentrico, lo ZEST, condotto negli Stati Uniti ed in Europa su 22.439 persone di età compresa tra 50 e 59 anni.<br> |
||
I partecipanti, randomizzati in rapporto 1:1 a ricevere il vaccino od il placebo, sono stati quindi monitorati per verificare gli eventi avversi e l'efficacia del trattamento. Il vaccino si è dimostrato valido con una efficacia di prevenzione di herpes zoster del 69,8% sicuro e ben tollerato (effetti avversi nel gruppo vaccino pari al 72.8% contro il 41.5% nel gruppo di controllo: la differenza tra i due gruppi era sostanzialmente legata a reazioni nel sito di iniezione o cefalea.<ref name=Schmader1>{{cite journal |author=Schmader KE, Levin MJ, Gnann JW, ''et al.'' |title=Efficacy, safety, and tolerability of herpes zoster vaccine in persons aged 50-59 years |journal=Clin. Infect. Dis. |volume=54 |issue=7 |pages=922–8 |year=2012 |month=April |pmid=22291101 |doi=10.1093/cid/cir970 |url=}}</ref> |
I partecipanti, randomizzati in rapporto 1:1 a ricevere il vaccino od il placebo, sono stati quindi monitorati per verificare gli eventi avversi e l'efficacia del trattamento. Il vaccino si è dimostrato valido con una efficacia di prevenzione di herpes zoster del 69,8% sicuro e ben tollerato (effetti avversi nel gruppo vaccino pari al 72.8% contro il 41.5% nel gruppo di controllo: la differenza tra i due gruppi era sostanzialmente legata a reazioni nel sito di iniezione o cefalea.<ref name=Schmader1>{{cite journal |author=Schmader KE, Levin MJ, Gnann JW, ''et al.'' |title=Efficacy, safety, and tolerability of herpes zoster vaccine in persons aged 50-59 years |journal=Clin. Infect. Dis. |volume=54 |issue=7 |pages=922–8 |year=2012 |month=April |pmid=22291101 |doi=10.1093/cid/cir970 |url=}}</ref><br> |
||
Il vaccino è stato registrato anche nella Unione Europea per la prevenzione dell'herpes zoster e della nevralgia post-erpetica, in adulti di età maggiore di 50 anni. Gli studi di farmacoeconomia variano notevolmente sulle previsioni di costo-efficacia ma si confermerebbe la validità del vaccino nel ridurre significativamente l'incidenza di herpes zoster e della sua gravità.<ref name=Sanford1>{{cite journal |author=Sanford M, Keating GM |title=Zoster vaccine (Zostavax): a review of its use in preventing herpes zoster and postherpetic neuralgia in older adults |journal=Drugs Aging |volume=27 |issue=2 |pages=159–76 |year=2010 |month=February |pmid=20104941 |doi=10.2165/10489140-000000000-00000 |url=}}</ref> |
|||
==Prognosi== |
==Prognosi== |
||
Versione delle 10:11, 8 giu 2012
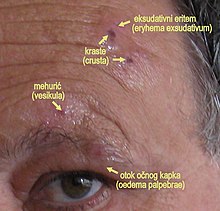
Con il termine herpes oftalmico ci si riferisce al coinvolgimento oftalmico in corso di una infezione da virus varicella-zoster (VZV), herpes simplex virus (HSV), citomegalovirus (CMV).
Il virus varicella-zoster (VZV) è all'origine di 2 sindromi distinte.
L'infezione primaria prende il nome di varicella, una malattia infettiva, epidemica, febbrile e solitamente benigna.
Alla risoluzione della infezione primaria da varicella (varicella), le particelle virali rimangono nel ganglio trigeminale od in altro ganglio sensoriale e restano latenti per anni o decenni.
A seguito del normale processo di invecchiamento, di malattie immunosoppressive, nuovi eventi stressanti o particolari trattamenti medici, la risposta immunitaria del soggetto, virus-specifica e cellulo mediata, può diminuire.
Questa condizione permette una riattivazione del VZV latente e risulta, talora, in una eruzione cutanea localizzata in un unico dermatomero, chiamata herpes zoster (HZ). L' HZ fu descritto originariamente da Ippocrate, e di questa affezione troviamo descrizioni ad opera anche di Plinio il Vecchio, ma la sua relazione con VZV non è stato chiarita fino ai tempi recenti e grazie a moderni saggi immunoistochimici.
I pazienti con herpes zoster che interessa la prima divisione del nervo trigemino (cioè il ramo naso-ciliare) presentano un processo patologico chiamato herpes zoster oftalmico (HZO).
L' herpes zoster oftalmico è, dopo lo zoster toracico, il tipo più frequente e rappresenta il 10-25% di tutti i casi di herpes zoster.[1][2][3]
Le sequele di HZO possono essere particolarmente gravi ed includono l'infiammazione oculare cronica, la perdita della vista ed il dolore cronico debilitante.[4][5][6][7]
Fisiopatologia
Dopo l'infezione primaria il virus varicella-zoster penetra nei gangli spinali, dove rimane latente per anni e decenni.[8]
Probabilmente la penetrazione del virus nelle strutture nervose può derivare da diffusione per contiguità del virus varicella dalla cute alle terminazioni nervose sensoriali e quindi ai gangli. In alternativa, i gangli potrebbero infettarsi per via ematica durante la fase di viremia. In condizioni predisponenti il virus può riattivarsi dal ganglio trigeminale e viaggiare lungo il nervo naso-ciliare corrispondente alla prima divisione (oftalmica) del nervo trigemino. I rami del nervo nasociliare innervano la superficie del globo oculare e la cute periorbitaria fino alla punta del naso. Durante questo tragitto lungo le terminazioni nervose il virus può provocare l'infiammazione perineurale ed intraneurale. L'infiammazione può determinare lesioni oculari e delle strutture circostanti.
Mentre la comparsa del rash cutaneo da zoster coincide con una proliferazione di cellule T VZV-specifiche, la produzione di interferone-alfa si associa alla risoluzione della sintomatologia.
Nei pazienti immunocompetenti, durante la riattivazione dell'infezione, le immunoglobuline G, M e A appaiono rapidamente e raggiungono elevate concentrazioni. Questi paziente hanno anche una risposta cellulo-mediata contro VZV di più lunga durata e migliore.[4][7]
Epidemiologia
L'infezione da VZV è estremamente diffusa. Circa il 90% della popolazione negli USA si infetta nel corso dell'adolescenza, ed all'età di 60 anni la quasi totalità dei soggetti ha avuto un contatto ed infezione sostenuta dal virus.[9]
L'incidenza e la gravità dell'herpes zoster aumentano con l'avanzare dell'età.
Più della metà di tutte le persone in cui si sviluppa l'herpes zoster hanno più di 60 anni.[10]
L'herpes zoster oftalmico (HZO) rappresenta circa il 10-20% dei casi di zoster.[9]
Circa la metà di questi soggetti sviluppa delle complicazioni.
Il rischio di complicanze oftalmiche in pazienti con zoster non sembra correlare con l'età, il sesso, o la gravità del rash.[11]
Il rischio di sviluppare lo zoster aumenta con il decrescere della immunità cellulo mediata, processo quest'ultimo associato al normale invecchiamento.
L'incidenza dell'herpes zoster comincia a salire fortemente nella sesta decade di vita.[12]
Tra gli individui di più di 75 anni di età il tasso di incidenza supera i 10 casi per 1000 individui/anno.
I soggetti che presentano una inibizione della risposta immunitaria cellulo mediata hanno un maggiore rischio di sviluppo dello zoster e delle sue complicanze. I soggetti affetti da AIDS presentano un rischio relativo di zoster di circa 15 volte maggiore rispetto a soggetti immunocompetenti ed in essi le alterazioni visive, spesso correlate ad uno zoster oftalmico, sono una fonte importante di morbilità.[13]
Sesso predominante
L'herpes zoster oftalmico non presenta un sesso predominante.
In letteratura è comunque riportato uno studio effettuato negli USA su 9152 pazienti che mostra un tasso di infezione da herpes zoster per 1.000 individui/anno più elevato tra le femmine (3,8) rispetto ai maschi (2,6), statisticamente significativo (P<.0001).[14]
Età predominante
L'incidenza di zoster ed il tasso delle complicazioni ad esso associate aumenta con l'età. I 2/3 dei casi si verificano nei soggetti di età superiore ai 50 anni.[15][9][10][14]
Fattori razziali
L'incidenza dello zoster nei bianchi caucasici appare quasi doppia rispetto agli individui afroamericani.[16][17]
Eziologia
Il virus varicella zoster (VZV), che in modo più corretto viene definito human herpesvirus 3, è un membro della famiglia Herpesviridae ed è l'agente eziologico della varicella, che ne rappresenta l'infezione primaria, e dell'herpes zoster, la riattivazione della infezione.
I fattori di rischio noti per l'infezione da VZV sono:
- Il declinare della immunità cellulo-mediata.
- L'immunosoppressione, in particolare associata a trapianto di midollo osseo[18][19][20] e ad infezione da HIV ed AIDS.[21][22][23][24][25][26][27]
- La terapia farmacologica con effetti immunosoppressivi.[28][29][30]
- Lo stress psicologico.[31][32]
- L'infezione primaria in utero o nella prima infanzia.[33][34][35]
Clinica
La fase iniziale o prodromica dell'herpes zoster oftalmico è assai aspecifica e si distingue assai poco da una comune sindrome di tipo influenzale. Include segni e sintomi generali, quali stanchezza, affaticabilità e malessere generale. Questi sintomi perdurano in genere circa una settimana.[36]
Anche se in questa fase l'herpes zoster oftalmico produce più spesso una eruzione cutanea classica, con rash unilaterale sulla fronte, alla palpebra superiore, e coinvolgente il naso, una minoranza di pazienti può avere solo segni oftalmici, limitati principalmente alla cornea.
Circa il 60% dei pazienti prova dolore nel dermatomero interessato prima della classica eruzione cutanea.[37]
Manifestazioni extra oculari dell'herpes zoster oftalmico
Nei pazienti con rash appaiono macule cutanee eritematose, che progrediscono poi in gruppi di papule e vescicole. Queste ultime evolvono poi in pustole e quindi in croste. In genere le lesioni si risolvono rapidamente nel giro di qualche settimana, ma in rari casi hanno un decorso cronico e possono persistere anche per anni.[38]
Se queste lesioni si infettano o vengono manipolate, è possibile che si formino delle cicatrici anche profonde.[39]
Manifestazioni oculari dell'herpes zoster oftalmico
Le manifestazioni cutanee dell'herpes zoster oftalmico rispettano rigorosamente la linea mediana e coinvolgono uno o più rami della branca oftalmica del nervo trigemino, vale a dire i rami sopracciliari, lacrimali e nasociliari. Dal momento che il ramo nasociliare innerva il globo oculare, il coinvolgimento oftalmico più grave si sviluppa in caso di coinvolgimento di questo ramo. L'interessamento della punta del naso (segno di Hutchinson) è stato utilizzato come segno clinico predittore del coinvolgimento oculare.[40] Va tenuto presente che fino ad 1/3 dei pazienti con segno di Hutchinson negativo sviluppano comunque manifestazioni oculari.[39][41]
Blefarite e congiuntivite
Il coinvolgimento palpebrale nell'herpes zoster oftalmico è estremamente comune.
I pazienti sviluppano blefarite e presentano spesso ptosi secondaria all'edema ed al processo infiammatorio.
La maggior parte dei pazienti presenta sulle palpebre le classiche lesioni vescicolari che evolvono successivamente in cicatrici minime.
Quando vi è un interessamento congiuntivale, evenienza molto comune in corso di herpes zoster oftalmico, la congiuntiva appare iperemica ed edematosa, e spesso sono evidenti petecchie emorragiche.[42][43] Comune è anche il coinvolgimento della sclera e dell'episclera. Talvolta nell'arco di 1-2 settimane si sviluppa una infezione secondaria da Stafilococco aureo che necessita di essere trattata con antibiotici ad ampio spettro per uso topico e/o sistemico.
Le infezioni secondarie possono portare a cicatrici che determinano una incompleta chiusura delle palpebre, e quindi al rischio di esposizione della cornea ed essicazione.
Coinvolgimento corneale
Un interessamento della cornea in corso di herpes zoster oftalmico può portare ad una significativa perdita della vista.
La cornea subisce un danno diretto da replicazione virale, così come un danno da reazione antigene-anticorpo e da reazioni da ipersensibilità cellulo-mediata.[44]
I pazienti con interessamento corneale presentano diversi gradi di diminuzione della visione, dolore ed ipersensibilità alla luce. Le complicanze corneali si verificano nel 40% dei casi di herpes zoster ophthalmicus.[45]
Cheratite epiteliale
Le prime lesioni corneali consistono nella cheratite puntata epiteliale.[46]
All'esame con la lampada a fessura, la cheratite puntata appare come un insieme di lesioni multiple, focali, e spesso edematose che si colorano con la fluoresceina. Queste lesioni probabilmente contengono particelle virali e possono risolversi od evolvere in cheratite dendritica.
La cheratite puntata epiteliale può comparire già da uno a due giorni dopo l'iniziale eruzione cutanea. La cheratite dendritica invece si presenta non prima di 4-6 giorni, ma può comparire anche a molte settimane di distanza.
Le lesioni dendritiche appaiono come placche elevate e sono costituite da cellule epiteliali rigonfie. Formano delle ramificazioni che ricordano quelle delle foglie e possono avere delle estremità rastremate, contrariamente alle lesioni dendritiche da herpes simplex virus, che tendono ad avere delle estremità terminali a bulbo.
Le lesioni dendritiche si colorano bene con il rosa bengala e la fluoresceina e sono facilmente visualizzabili in corso di esame con lampada di Wood o lampada a fessura. Sia la cheratite puntata che la dendritica possono portare ad infiltrati nello stroma corneale.[47]
Cheratite stromale anteriore
In una percentuale variabile dal 25% al 30% dei pazienti con herpes zoster oftalmico durante la seconda settimana di malattia si possono avere i primi segni di un coinvolgimento dello stroma corneale.[48]
La condizione, nota come cheratite stromale anteriore o cheratite nummulare, è caratterizzata da numerosi infiltrati granulari nello stroma corneale anteriore, al di sotto dello strato epiteliale. La maggior parte di questi infiltrati nummulari si localizzano direttamente al di sotto delle pre-esistenti aree di cheratite epiteliale puntata o dendritica.[46][47]Gli infiltrati sono verosimilmente secondari ad interazioni antigene-anticorpo.
La cheratite stromale anteriore può essere prolungata e ricorrente nel tempo.
Cheratite stromale profonda
È relativamente rara e si sviluppa a distanza di tre o quattro mesi dopo l'episodio iniziale acuto, con una ampia variabilità individuale (da un mese a molti anni dopo).[41] In genere tende ad essere centrale e preceduta da cheratite stromale anteriore. La lesione di tipo infiammatorio tende ad interessare tutti i livelli dello stroma. In questa fase è possibile evidenziare edema corneale spesso associato a processi infiammatori della camera anteriore.
Se un trattamento adeguato non viene intrapreso tempestivamente un decorso cronico recidivante non è infrequente.
Nei pazienti con malattia cronica è possibile che si verifichi una neovascolarizzazione corneale.
Cheratopatia neurotrofica
È il risultato finale del danno dell’innervazione causato dal virus che determina una ridotta sensibilità corneale ed assottigliamento corneale che può portare alla perforazione della cornea e quindi alla comparsa di un’ulcera ovoidale con ridotta secrezione lacrimale e riduzione dell’ammiccamento. Questi pazienti sono ad alto rischio di sviluppare una infezione batterica secondaria.[41]
Uveite
L'uveite anteriore può essere agevolmente diagnosticata con l'esame del paziente con la lampada a fessura. L'uveite consiste nella infiammazione del corpo ciliare e dell'iride e si verifica frequentemente in corso di herpes zoster oftalmico. Può essere una manifestazione isolata o associata a cheratite. L'infiammazione è generalmente lieve e transitoria. L'uveite da herpes zoster oftalmico può provocare atrofia dell'iride ed alterazioni con irregolarità della pupilla. Nella maggior parte dei pazienti l'uveite perdura per poche settimane ma talvolta, come per la cheratite stromale, il decorso della malattia può essere prolungato (anche per anni), in particolare se non viene prontamente istituito un trattamento adeguato. Talvolta l'uveite evolve in glaucoma e cataratta, determinando un lieve aumento della pressione intraoculare.[49][50][51]
Necrosi acuta retinica e sindrome retinica esterna progressiva di necrosi
L'herpes zoster virus è considerato l'agente incriminato nella maggior parte dei casi di necrosi acuta della retina.
La sindrome retinica esterna progressiva di necrosi è una variante di retinite acuta più grave, che si sviluppa nei soggetti immunocompromessi ed in particolare nei pazienti sottoposti a trapianto di midollo osseo od affetti da AIDS.[52][53]
La necrosi retinica acuta si caratterizzata per chiazze di necrosi periferiche della retina che rapidamente tendono a saldarsi tra loro, vasculite occlusiva e flogosi a carico del vitreo.
Al contrario i pazienti immunocompromessi non presentano una risposta infiammatoria ed in essi si assiste ben presto ad un coinvolgimento della macula.
In entrambi i casi si associa frequentemente il distacco di retina.[54][55]
Per quanto attiene alla capacità visiva la prognosi è estremamente negativa nei pazienti immunocompromessi, ed un poco migliore in quelli con con necrosi retinica acuta.[56]
Diagnosi
Herpes zoster (HZ) è in genere diagnosticato basandosi sulle caratteristiche del dolore riferito dal paziente e sulle tipiche eruzioni dermatomeriche.
In genere non è necessario ricorrere ad esami di laboratorio.
Tuttavia, soprattutto nei pazienti immunocompromessi, la tipica eruzione cutanea può essere assente o meno caratteristica.
La diagnosi talvolta può essere complicata dal fatto che alcuni pazienti presentano solo i segni e sintomi oculari.
Nei casi in cui la diagnosi sia dubbia è possibile procedere ad uno striscio di Tzanck e successiva colorazione di Wright, che permette una rapida diagnosi presuntiva di infezione da virus varicella-zoster (VZV).[57][58]
Alcune cellule vengono raschiate dal fondo e dalle pareti delle lesioni cutanee e spalmate su un vetrino per microscopia. L'esame evidenzia tipiche cellule giganti multinucleate sinciziali, omogeneizzazione della cromatina nucleare, ed anticorpi intranucleari acidofili con contorni sfaccettati.
Il test non distingue tra VZV e altri virus herpes.
È possibile eseguire colture virali, ma il virus è relativamente difficile da isolare.[59]
I saggi di immunofluorescenza diretta di un campione bioptico, relativamente rapidi ed conomici, possono essere utili e più sensibili della coltura virale.[60][61][62]
Queste ultime due tecniche permettono di distinguere le infezioni da virus herpes simplex dalle infezioni VZV.
Tecniche di reazione a catena della polimerasi (PCR) si sono rivelate utili per evidenziare il DNA virale nelle lesioni.[63][64]
[65][66]
Diagnosi differenziale
- Abrasioni corneali
- Ulcere corneali
- Cheratite ulcerosa
- Cherato-congiuntiviti funginee o batteriche
- Scleriti
- Irite ed uveite
- Iridocicliti
- Glaucoma acuto ad angolo chiuso
- Manifestazioni oculari da HIV
- Nevralgia del trigemino
Trattamento
Il trattamento d'emergenza dell'herpes zoster oftalmico comporta una adeguata analgesia, la cura locale delle lesioni cutanee, l'utilizzo di agenti antivirali e, se è presente un'infezione batterica secondaria , l'utilizzo di antibiotici.
In caso di compromissione del riflesso di ammiccamento e/o ptosi palpebrale, può essere indicato un agente lubrificante dell'occhio onde evitare lesioni della cornea.
Antivirali
L'aciclovir per via orale, 800 mg 5 volte al giorno, è in grado di ridurre la durata dei segni e dei sintomi, nonché l'incidenza e la gravità delle complicanze dell'herpes zoster oftalmico. L'aciclovir può ridurre il dolore durante la fase acuta ma non sembra avere effetto sulla riduzione dell'incidenza o della gravità della nevralgia posterpetica.[67] L'aciclovir sembra di maggior beneficio per il paziente se la terapia viene iniziata entro 72 ore dalla comparsa delle lesioni cutanee. Similmente le complicanze sono più frequenti nei pazienti in cui il trattamento è stato ritardato.[67][68][69]
Sia il famciclovir (500 mg tid) che il valaciclovir (1 g tid) hanno dimostrato di essere efficace quanto l' aciclovir (800 mg 5 volte al giorno) nel trattamento di herpes zoster e riduzione delle complicanze.[70][71] Famciclovir e valaciclovir hanno dei regimi di somministrazione più semplici rispetto all'aciclovir, la qual cosa può aumentare la compliance del paziente.
Non è mai stato chiaramente provato un vantaggio nell'iniziare una terapia a più di 72 ore dall'insorgenza dei sintomi.
La durata standard della terapia antivirale per l'herpes zoster è di 7-10 giorni. Poichè con test PCR è stato dimostrato che il DNA virale persiste nella cornea per un massimo di 30 giorni (in particolare nei soggetti anziani), questa scoperta potrebbe spingere a proseguire il trattamento antivirale più a lungo.
Da un punto di vista teorico l'estensione del trattamento potrebbe essere particolarmente utile, in particolare per i pazienti immunocompromessi e anziani. Tuttavia non vi sono studi clinici che dimostrino una efficacia in questa popolazione di pazienti.
Le complicanze più gravi, come il coinvolgimento della retina, possono richiedere giorni di terapia per via endovenosa e mesi di terapia orale antivirale.
Corticosteroidi
L'uso dei corticosteroidi si è dimostrato efficace nel ridurre la durata del dolore durante la fase acuta della malattia. I corticosteroidi migliorano il tasso di guarigione cutanea ma non sembrano efficaci nel diminuire l'incidenza della nevralgia posterpetica.[72][73]
Gli steroidi migliorano la qualità della vita dei soggetti affetti da herpes zoster ma debbono essere riservati a quei pazienti che non presentano alcuna controindicazione.
L'uveite da herpes zoster oftalmico è trattata tipicamente con colliri costicosteroidi e con l'utilizzo di gocce oculari che determinano la dilatazione della pupilla.
Si ricorda che i colliri costicosteroidi possono esacerbare altri tipi di malattie oculari, pertanto il loro impiego deve essere approvato da un medico specialista oftalmologo.
Trattare le complicanze oculari
Ogni complicanza da herpes zoster oftalmico presenta delle specifiche modalità di trattamento[74] che debbono essere affrontate consultando lo specialista oculista.
- Blefarite e congiuntivite: il trattamento è palliativo. Si ricorre ad impacchi freddi e gocce oculari lubrificanti. Pomate antibiotiche per applicazione topica possono essere utili nelle sovrainfezioni batteriche.
- Cheratite stromale: applicazione locale di pomate steroidi.
- Cheratite neurotrofica: gocce oculari lubrificanti; pomate antibiotiche da applicarsi in caso di infezioni secondarie; lenti a contatto terapeutiche per prevenire la perforazione della cornea.
- Uveite: applicazione locale di pomate steroidi; steroidi per via orale; antivirali per via orale; cicloplegici.
- Sclerite ed episclerite: pomate steroidi od antiinfiammatorie per applicazione locale.
- Necrosi acuta della retina e sindrome retinica esterna progressiva di necrosi: aciclovir per via endovenosa tid (1500 mg/m2 al giorno) per 7-10 giorni, seguito da aciclovir per via orale (800 mg 5 volte al giorno) per 14 settimane. A seguire laserterapia od intervento chirurgico.
Trattamento chirurgico
Alcuni pazienti richiedono l'esecuzione di piccoli interventi chirurgici per correggere le cicatrici secondarie alla malattia, come una parziale sutura delle palpebre (tarsoraffia laterale e cantorrafia laterale). In altri pazienti con cicatrici corneali diffuse può rendersi necessario un intervento di cheratoplastica.[75][76][77][78][79]
Prevenzione
Negli USA la Food and Drug Administration ha approvato a partire dal 2006 l'utilizzo di un vaccino per la prevenzione dell'herpes zoster nei soggetti di 60 anni di età basandosi sui risultati del Shingles Prevention Study.[80]
In questo studio più di 38.000 adulti di oltre età 60 anni d'età furono arruolati in uno studio randomizzato, in doppio cieco, controllato con placebo, per l'uso del vaccino. Il 95% dei soggetti completò lo studio e l'uso del vaccino dimostrò una riduzione dell'incidenza di herpes zoster del 61,1% e della nevralgia posterpetica del 66,5%.
L'uso del vaccino per la prevezione dell'herpes zoster e della nevralgia posterpetica nei soggetti anziani è stato presto oggetto di studi di costo-efficacia: fin da subito è apparso evidente che il rapporto costo-efficacia del vaccino varia notevolmente con l'età del paziente e che pertanto questo parametro deve essere sempre considerato nelle raccomandazioni vaccinali.[81]
Nel marzo 2011 la Food and Drug Administration (FDA) ha abbassato l'età approvata per l'utilizzo del vaccino a 50-59 anni.
Gli studi avevano dimostrato che negli Stati Uniti, ogni anno, l'herpes zoster colpiva circa 200.000 persone sane di età compresa tra i 50 ed i 59 anni.
La nuova approvazione ha fatto seguito ad un ulteriore studio multicentrico, lo ZEST, condotto negli Stati Uniti ed in Europa su 22.439 persone di età compresa tra 50 e 59 anni.
I partecipanti, randomizzati in rapporto 1:1 a ricevere il vaccino od il placebo, sono stati quindi monitorati per verificare gli eventi avversi e l'efficacia del trattamento. Il vaccino si è dimostrato valido con una efficacia di prevenzione di herpes zoster del 69,8% sicuro e ben tollerato (effetti avversi nel gruppo vaccino pari al 72.8% contro il 41.5% nel gruppo di controllo: la differenza tra i due gruppi era sostanzialmente legata a reazioni nel sito di iniezione o cefalea.[16]
Il vaccino è stato registrato anche nella Unione Europea per la prevenzione dell'herpes zoster e della nevralgia post-erpetica, in adulti di età maggiore di 50 anni. Gli studi di farmacoeconomia variano notevolmente sulle previsioni di costo-efficacia ma si confermerebbe la validità del vaccino nel ridurre significativamente l'incidenza di herpes zoster e della sua gravità.[82]
Prognosi
L'herpes zoster oftalmico è una malattia che con facilità diviene cronica o recidivante.
La tendenza a ripresentarsi è una caratteristica tipica dell'herpes zoster oftalmico. Le ricadute si possono verificare anche a più di 10 anni dalla primitiva insorgenza.
La percentuale di pazienti affetti da herpes zoster oftalmico che sviluppano complicanze è estremamente alta: secondo alcuni le complicanze possono interessare fino al 50% dei soggetti.[83][84]
I pazienti più giovani sarebbero a maggior rischio di sviluppo di cheratite pseudodendritiforme mentre i pazienti più anziani tenderebbero a presentare più problemi legati alla cheratopatia neurotrofica.[85]
Note
- ^ Ang LP, Au Eong KG, Ong SG, Herpes zoster ophthalmicus, in J Pediatr Ophthalmol Strabismus, vol. 38, n. 3, 2001, pp. 174–6.
- ^ Cockburn DM, Douglas IS, Herpes zoster opthalmicus, in Clin Exp Optom, vol. 83, n. 2, 2000, pp. 59–64.
- ^ Gurwood AS, Savochka J, Sirgany BJ, Herpes zoster ophthalmicus, in Optometry, vol. 73, n. 5, May 2002, pp. 295–302.
- ^ a b Ongkosuwito JV, Feron EJ, van Doornik CE, et al., Analysis of immunoregulatory cytokines in ocular fluid samples from patients with uveitis, in Invest. Ophthalmol. Vis. Sci., vol. 39, n. 13, December 1998, pp. 2659–65.
- ^ Mochizuki K, Matsushita H, Hiramatsu Y, Yanagida K, Detection of varicella-zoster virus genome in the vitreous humor from two patients with acute retinal necrosis; lacking or having a PstI cleavage site, in Jpn. J. Ophthalmol., vol. 42, n. 3, 1998, pp. 208–12.
- ^ Karlin JD, Herpes zoster ophthalmicus: the virus strikes back, in Ann Ophthalmol, vol. 25, n. 6, June 1993, pp. 208–15.>
- ^ a b Kumano Y, Manabe J, Hamamoto M, et al., Detection of varicella-zoster virus genome having a PstI site in the ocular sample from a patient with acute retinal necrosis, in Ophthalmic Res., vol. 27, n. 5, 1995, pp. 310–6.
- ^ Ritterband DC, Friedberg DN, Virus infections of the eye, in Rev. Med. Virol., vol. 8, n. 4, October 1998, pp. 187–201.
- ^ a b c Liesegang TJ, Herpes zoster ophthalmicus natural history, risk factors, clinical presentation, and morbidity, in Ophthalmology, vol. 115, 2 Suppl, February 2008, pp. S3–12, DOI:10.1016/j.ophtha.2007.10.009.
- ^ a b Holcomb K, Weinberg JM, A novel vaccine (Zostavax) to prevent herpes zoster and postherpetic neuralgia, in J Drugs Dermatol, vol. 5, n. 9, October 2006, pp. 863–6.
- ^ Weinberg JM, Herpes zoster: epidemiology, natural history, and common complications, in J. Am. Acad. Dermatol., vol. 57, 6 Suppl, December 2007, pp. S130–5, DOI:10.1016/j.jaad.2007.08.046.
- ^ Straus SE, Ostrove JM, Inchauspé G, et al., NIH conference. Varicella-zoster virus infections. Biology, natural history, treatment, and prevention, in Ann. Intern. Med., vol. 108, n. 2, February 1988, pp. 221–37.
- ^ Kaleem MA, Ramsahai S, Del Fierro K, et al., Ocular findings in human immunodeficiency virus patients in Washington, DC, in Int Ophthalmol, vol. 32, n. 2, April 2012, pp. 145–51, DOI:10.1007/s10792-012-9543-3.
- ^ a b Insinga RP, Itzler RF, Pellissier JM, Saddier P, Nikas AA, The incidence of herpes zoster in a United States administrative database, in J Gen Intern Med, vol. 20, n. 8, August 2005, pp. 748–53, DOI:10.1111/j.1525-1497.2005.0150.x.
- ^ Yawn BP, Saddier P, Wollan PC, St Sauver JL, Kurland MJ, Sy LS, A population-based study of the incidence and complication rates of herpes zoster before zoster vaccine introduction, in Mayo Clin. Proc., vol. 82, n. 11, November 2007, pp. 1341–9.
- ^ a b Schmader K, George LK, Burchett BM, Pieper CF, Hamilton JD, Racial differences in the occurrence of herpes zoster, in J. Infect. Dis., vol. 171, n. 3, March 1995, pp. 701–4. Errore nelle note: Tag
<ref>non valido; il nome "Schmader1" è stato definito più volte con contenuti diversi - ^ Schmader K, George LK, Burchett BM, Hamilton JD, Pieper CF, Race and stress in the incidence of herpes zoster in older adults, in J Am Geriatr Soc, vol. 46, n. 8, August 1998, pp. 973–7.
- ^ Walton RC, Reed KL. Herpes zoster ophthalmicus following bone marrow transplantation in children. Bone Marrow Transplant. Jun 1999;23(12):1317-20.
- ^ Koc Y, Miller KB, Schenkein DP, et al., Varicella zoster virus infections following allogeneic bone marrow transplantation: frequency, risk factors, and clinical outcome, in Biol. Blood Marrow Transplant., vol. 6, n. 1, 2000, pp. 44–9.
- ^ Steer CB, Szer J, Sasadeusz J, Matthews JP, Beresford JA, Grigg A, Varicella-zoster infection after allogeneic bone marrow transplantation: incidence, risk factors and prevention with low-dose aciclovir and ganciclovir, in Bone Marrow Transplant., vol. 25, n. 6, March 2000, pp. 657–64, DOI:10.1038/sj.bmt.1702190.
- ^ Buchbinder SP, Katz MH, Hessol NA, et al., Herpes zoster and human immunodeficiency virus infection, in J. Infect. Dis., vol. 166, n. 5, November 1992, pp. 1153–6.
- ^ Chronister CL. Review of external ocular disease associated with aids and HIV infection. Optom Vis Sci. Apr 1996;73(4):225-30.
- ^ Hodge WG, Seiff SR, Margolis TP, Ocular opportunistic infection incidences among patients who are HIV positive compared to patients who are HIV negative, in Ophthalmology, vol. 105, n. 5, May 1998, pp. 895–900, DOI:10.1016/S0161-6420(98)95033-3.
- ^ Jabs DA, Ocular manifestations of HIV infection, in Trans Am Ophthalmol Soc, vol. 93, 1995, pp. 623–83.
- ^ (Portuguese) Vargas MA, Rodrigues Mde L, Figueiredo JF, Souza NV, [Ophthalmologic conditions of AIDS patients with long-term follow-up], in Arq Bras Oftalmol, vol. 70, n. 1, 2007, pp. 85–9. Lingua sconosciuta: Portuguese (aiuto)
- ^ (French) Girard B, Prevost-Moravia G, Courpotin C, Lasfargues G, [Ophthalmologic manifestations observed in a pediatric HIV-seropositive population], in J Fr Ophtalmol, vol. 20, n. 1, 1997, pp. 49–60. Lingua sconosciuta: French (aiuto)
- ^ Rao NA, Acquired immunodeficiency syndrome and its ocular complications, in Indian J Ophthalmol, vol. 42, n. 2, June 1994, pp. 51–63.
- ^ Benz MS, Glaser JS, Davis JL, Progressive outer retinal necrosis in immunocompetent patients treated initially for optic neuropathy with systemic corticosteroids, in Am. J. Ophthalmol., vol. 135, n. 4, April 2003, pp. 551–3.
- ^ Smitten AL, Choi HK, Hochberg MC, et al., The risk of herpes zoster in patients with rheumatoid arthritis in the United States and the United Kingdom, in Arthritis Rheum., vol. 57, n. 8, December 2007, pp. 1431–8, DOI:10.1002/art.23112.
- ^ Fernandes NF, Malliah R, Stitik TP, Rozdeba P, Lambert WC, Schwartz RA, Herpes zoster following intra-articular corticosteroid injection, in Acta Dermatovenerol Alp Panonica Adriat, vol. 18, n. 1, March 2009, pp. 28–30.
- ^ Katz J, Cooper EM, Walther RR, Sweeney EW, Dworkin RH, Acute pain in herpes zoster and its impact on health-related quality of life, in Clin. Infect. Dis., vol. 39, n. 3, August 2004, pp. 342–8, DOI:10.1086/421942.
- ^ Livengood JM, The role of stress in the development of herpes zoster and postherpetic neuralgia, in Curr Rev Pain, vol. 4, n. 1, 2000, pp. 7–11.
- ^ Jha A, Kumar A, Paudel U, Neupane S, Pokhrel DB, Badal KP, Herpes zoster in a five month old infant subsequent to intrauterine exposure to varicella infection, in Nepal Med Coll J, vol. 9, n. 4, December 2007, pp. 281–3.
- ^ Huang JL, Sun PC, Hung IJ, Herpes zoster in infancy after intrauterine exposure to varicella zoster virus: report of two cases, in J. Formos. Med. Assoc., vol. 93, n. 1, January 1994, pp. 75–7.
- ^ Enders G, Miller E, Cradock-Watson J, Bolley I, Ridehalgh M, Consequences of varicella and herpes zoster in pregnancy: prospective study of 1739 cases, in Lancet, vol. 343, n. 8912, June 1994, pp. 1548–51.
- ^ Goh CL, Khoo L, A retrospective study of the clinical presentation and outcome of herpes zoster in a tertiary dermatology outpatient referral clinic, in Int. J. Dermatol., vol. 36, n. 9, September 1997, pp. 667–72.
- ^ Cobo M, Foulks GN, Liesegang T, et al., Observations on the natural history of herpes zoster ophthalmicus, in Curr. Eye Res., vol. 6, n. 1, January 1987, pp. 195–9.
- ^ Burgoon CF, Burgoon JS, Baldridge GD, The natural history of herpes zoster, in J Am Med Assoc, vol. 164, n. 3, May 1957, pp. 265–9.
- ^ a b Harding SP, Lipton JR, Wells JC, Natural history of herpes zoster ophthalmicus: predictors of postherpetic neuralgia and ocular involvement, in Br J Ophthalmol, vol. 71, n. 5, May 1987, pp. 353–8.
- ^ Zaal MJ, Völker-Dieben HJ, D'Amaro J. Prognostic value of Hutchinson's sign in acute herpes zoster ophthalmicus. Graefes Arch Clin Exp Ophthalmol. Mar 2003;241(3):187-91.
- ^ a b c Baratz KH, Goins K, Cobo M. Varicella-zoster viral infections. In: Kaufman HE, ed. The cornea. New York: Churchill Livingstone, 1988
- ^ Arffa RC. Viral diseases. In: Arffa RC, Grayson M. Diseases of the cornea. 4th ed. St. Louis: Mosby, 1997
- ^ (German) Roesel M, Heiligenhaus A, Messmer EM, [Clinical presentation of zoster ophthalmicus], in Klin Monbl Augenheilkd, vol. 227, n. 5, May 2010, pp. 370–4, DOI:10.1055/s-0029-1245329. Lingua sconosciuta: German (aiuto)
- ^ McGill J, The enigma of herpes stromal disease, in Br J Ophthalmol, vol. 71, n. 2, February 1987, pp. 118–25.
- ^ Puri LR, Shrestha GB, Shah DN, Chaudhary M, Thakur A, Ocular manifestations in Herpes Zoster Ophthalmicus, in Nepal J Ophthalmol, vol. 3, n. 6, July 2011, pp. 165–71, DOI:http://dx.doi.org/10.3126/nepjoph.v3i2.5271.
- ^ a b Liesegang TJ, Corneal complications from herpes zoster ophthalmicus, in Ophthalmology, vol. 92, n. 3, March 1985, pp. 316–24.
- ^ a b Marsh RJ, Herpes zoster keratitis, in Trans Ophthalmol Soc U K, vol. 93, 1973, pp. 181–92.
- ^ Womack LW, Liesegang TJ, Complications of herpes zoster ophthalmicus, in Arch. Ophthalmol., vol. 101, n. 1, January 1983, pp. 42–5.
- ^ Wang TJ, Hu CC, Lin HC, Increased risk of anterior uveitis following herpes zoster: a nationwide population-based study, in Arch. Ophthalmol., vol. 130, n. 4, April 2012, pp. 451–5, DOI:10.1001/archophthalmol.2011.357.
- ^ Tugal-Tutkun I, Otük-Yasar B, Altinkurt E, Clinical features and prognosis of herpetic anterior uveitis: a retrospective study of 111 cases, in Int Ophthalmol, vol. 30, n. 5, October 2010, pp. 559–65, DOI:10.1007/s10792-010-9394-8.
- ^ Cunningham ET, Diagnosing and treating herpetic anterior uveitis, in Ophthalmology, vol. 107, n. 12, December 2000, pp. 2129–30.
- ^ Gill H, Cheung J, Wong I, Lie AK, Kwong YL, Varicella zoster virus progressive outer retinal necrosis after allogeneic haematopoietic stem cell transplantation, in Br. J. Haematol., vol. 157, n. 3, May 2012, p. 279, DOI:10.1111/j.1365-2141.2012.09059.x.
- ^ {{cite journal |author=Margolis TP, Milner MS, Shama A, Hodge W, Seiff S |title=Herpes zoster ophthalmicus in patients with human immunodeficiency virus infection |journal=Am. J. Ophthalmol. |volume=125 |issue=3 |pages=285–91 |year=1998 |month=March |pmid=9512144 |doi= |url=}
- ^ Lim WK, Chee SP, Nussenblatt RB, Progression of varicella-zoster virus necrotizing retinopathy in an HIV-negative patient with transient immune deviation, in Graefes Arch. Clin. Exp. Ophthalmol., vol. 243, n. 6, June 2005, pp. 607–9, DOI:10.1007/s00417-004-0998-4.
- ^ Gariano RF, Berreen JP, Cooney EL, Progressive outer retinal necrosis and acute retinal necrosis in fellow eyes of a patient with acquired immunodeficiency syndrome, in Am. J. Ophthalmol., vol. 132, n. 3, September 2001, pp. 421–3.
- ^ Yoshida M, Hayasaka S, Yamada T, et al., Ocular findings in Japanese patients with varicella-zoster virus infection, in Ophthalmologica, vol. 219, n. 5, 2005, pp. 272–5, DOI:10.1159/000086110.
- ^ Veien NK, Vestergaard BF, Rapid diagnostic tests for cutaneous eruptions of herpes simplex, in Acta Derm. Venereol., vol. 58, n. 1, 1978, pp. 83–5.
- ^ Folkers E, Vreeswijk J, Oranje AP, Duivenvoorden JN, Rapid diagnosis in varicella and herpes zoster: re-evaluation of direct smear (Tzanck test) and electron microscopy including colloidal gold immuno-electron microscopy in comparison with virus isolation, in Br. J. Dermatol., vol. 121, n. 3, September 1989, pp. 287–96.
- ^ (French) Denis-Lassalle J, Clay C, Gherardi-Bakalova M, Offret G, [Ophthalmic zona: isolation of a viral strain from the aqueous humor], in Arch Ophtalmol Rev Gen Ophtalmol, vol. 31, n. 2, February 1971, pp. 109–18. Lingua sconosciuta: French (aiuto)
- ^ Wenkel H, Rummelt C, Rummelt V, Jahn G, Fleckenstein B, Naumann GO, Detection of varicella zoster virus DNA and viral antigen in human cornea after herpes zoster ophthalmicus, in Cornea, vol. 12, n. 2, March 1993, pp. 131–7.
- ^ Wenkel H, Rummelt V, Fleckenstein B, Naumann GO, Detection of varicella zoster virus DNA and viral antigen in human eyes after herpes zoster ophthalmicus, in Ophthalmology, vol. 105, n. 7, July 1998, pp. 1323–30, DOI:10.1016/S0161-6420(98)97042-7.
- ^ (Japanese) Uchida Y, [Viral diseases of the outer eye--rapid diagnosis by immunohistochemistry], in Nippon Ganka Gakkai Zasshi, vol. 94, n. 10, October 1990, pp. 889–902. Lingua sconosciuta: Japanese (aiuto)
- ^ Kaye SB, Baker K, Bonshek R, et al., Human herpesviruses in the cornea, in Br J Ophthalmol, vol. 84, n. 6, June 2000, pp. 563–71.
- ^ Bhatnagar A, Tomlins P, Parulekar MV, Role of polymerase chain reaction in early diagnosis of herpes zoster ophthalmicus in children, in J AAPOS, vol. 13, n. 2, April 2009, pp. 213–4, DOI:10.1016/j.jaapos.2008.10.006.
- ^ Mortemousque B, Chronic recurrent varicella-zoster virus keratitis confirmed by polymerase chain reaction testing, in Am. J. Ophthalmol., vol. 141, n. 4, April 2006, pp. 782; author reply 782, DOI:10.1016/j.ajo.2005.12.023.
- ^ Acharya N, Lietman T, Cevallos V, et al., Correlation between clinical suspicion and polymerase chain reaction verification of infectious vitritis, in Am. J. Ophthalmol., vol. 141, n. 3, March 2006, pp. 584–5, DOI:10.1016/j.ajo.2005.10.011.
- ^ a b Cobo LM, Foulks GN, Liesegang T, et al., Oral acyclovir in the treatment of acute herpes zoster ophthalmicus, in Ophthalmology, vol. 93, n. 6, June 1986, pp. 763–70.
- ^ Hoang-Xuan T, Büchi ER, Herbort CP, et al., Oral acyclovir for herpes zoster ophthalmicus, in Ophthalmology, vol. 99, n. 7, July 1992, pp. 1062–70; discussion 1070–1.
- ^ Severson EA, Baratz KH, Hodge DO, Burke JP, Herpes zoster ophthalmicus in olmsted county, Minnesota: have systemic antivirals made a difference?, in Arch. Ophthalmol., vol. 121, n. 3, March 2003, pp. 386–90.
- ^ Colin J, Prisant O, Cochener B, Lescale O, Rolland B, Hoang-Xuan T, Comparison of the efficacy and safety of valaciclovir and acyclovir for the treatment of herpes zoster ophthalmicus, in Ophthalmology, vol. 107, n. 8, August 2000, pp. 1507–11.
- ^ Tyring S, Engst R, Corriveau C, et al., Famciclovir for ophthalmic zoster: a randomised aciclovir controlled study, in Br J Ophthalmol, vol. 85, n. 5, May 2001, pp. 576–81.
- ^ Whitley RJ, Weiss H, Gnann JW, et al., Acyclovir with and without prednisone for the treatment of herpes zoster. A randomized, placebo-controlled trial. The National Institute of Allergy and Infectious Diseases Collaborative Antiviral Study Group, in Ann. Intern. Med., vol. 125, n. 5, September 1996, pp. 376–83.
- ^ Wood MJ, Johnson RW, McKendrick MW, Taylor J, Mandal BK, Crooks J, A randomized trial of acyclovir for 7 days or 21 days with and without prednisolone for treatment of acute herpes zoster, in N. Engl. J. Med., vol. 330, n. 13, March 1994, pp. 896–900, DOI:10.1056/NEJM199403313301304.
- ^ Shaikh S, Ta CN, Evaluation and management of herpes zoster ophthalmicus, in Am Fam Physician, vol. 66, n. 9, November 2002, pp. 1723–30.
- ^ Chen HJ, Pires RT, Tseng SC, Amniotic membrane transplantation for severe neurotrophic corneal ulcers, in Br J Ophthalmol, vol. 84, n. 8, August 2000, pp. 826–33.
- ^ (German) Meller D, Thomasen H, Steuhl K, [Amniotic membrane transplantation in herpetic corneal infections], in Klin Monbl Augenheilkd, vol. 227, n. 5, May 2010, pp. 393–9, DOI:10.1055/s-0029-1245339. Lingua sconosciuta: German (aiuto)
- ^ Tanure MA, Cohen EJ, Grewal S, Rapuano CJ, Laibson PR, Penetrating keratoplasty for varicella-zoster virus keratopathy, in Cornea, vol. 19, n. 2, March 2000, pp. 135–9.
- ^ Kaufman SC, Use of photorefractive keratectomy in a patient with a corneal scar secondary to herpes zoster ophthalmicus, in Ophthalmology, vol. 115, 2 Suppl, February 2008, pp. S33–4, DOI:10.1016/j.ophtha.2007.10.014.
- ^ Pavan-Langston D, Dohlman CH, Boston keratoprosthesis treatment of herpes zoster neurotrophic keratopathy, in Ophthalmology, vol. 115, 2 Suppl, February 2008, pp. S21–3, DOI:10.1016/j.ophtha.2007.10.013.
- ^ Oxman MN, Levin MJ, Johnson GR, et al., A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults, in N. Engl. J. Med., vol. 352, n. 22, June 2005, pp. 2271–84, DOI:10.1056/NEJMoa051016.
- ^ Rothberg MB, Virapongse A, Smith KJ, Cost-effectiveness of a vaccine to prevent herpes zoster and postherpetic neuralgia in older adults, in Clin. Infect. Dis., vol. 44, n. 10, May 2007, pp. 1280–8, DOI:10.1086/514342.
- ^ Sanford M, Keating GM, Zoster vaccine (Zostavax): a review of its use in preventing herpes zoster and postherpetic neuralgia in older adults, in Drugs Aging, vol. 27, n. 2, February 2010, pp. 159–76, DOI:10.2165/10489140-000000000-00000.
- ^ Miserocchi E, Waheed NK, Dios E, et al., Visual outcome in herpes simplex virus and varicella zoster virus uveitis: a clinical evaluation and comparison, in Ophthalmology, vol. 109, n. 8, August 2002, pp. 1532–7.
- ^ Zaal MJ, Völker-Dieben HJ, D'Amaro J, Visual prognosis in immunocompetent patients with herpes zoster ophthalmicus, in Acta Ophthalmol Scand, vol. 81, n. 3, June 2003, pp. 216–20.
- ^ Ghaznawi N, Virdi A, Dayan A, et al., Herpes zoster ophthalmicus: comparison of disease in patients 60 years and older versus younger than 60 years, in Ophthalmology, vol. 118, n. 11, November 2011, pp. 2242–50, DOI:10.1016/j.ophtha.2011.04.002.