Fosgene: differenze tra le versioni
Etichette: Modifica da mobile Modifica da web per mobile |
Nessun oggetto della modifica |
||
| Riga 1: | Riga 1: | ||
{{Composto chimico |
{{Composto chimico |
||
|immagine1_nome = Phosgene-dimensions-2D.png |
|immagine1_nome = Phosgene-dimensions-2D.png |
||
|immagine1_dimensioni = |
|immagine1_dimensioni = |
||
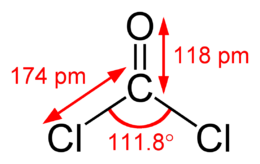
|immagine1_descrizione = formula di struttura |
|immagine1_descrizione = formula di struttura |
||
|immagine2_nome = Phosgene-3D-balls.png |
|immagine2_nome = Phosgene-3D-balls.png |
||
|immagine2_dimensioni = |
|immagine2_dimensioni = |
||
|immagine2_descrizione = struttura 3D |
|immagine2_descrizione = struttura 3D |
||
|nome_IUPAC = Ossido dicloruro di carbonio(IV) |
|nome_IUPAC = Ossido dicloruro di carbonio(IV) |
||
Versione delle 11:09, 19 ott 2021
| Fosgene | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Ossido dicloruro di carbonio(IV) | |
| Nomi alternativi | |
| cloruro di carbonile cloroformilcloruro dicloroformaldeide ossicloruro di carbonio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | COCl2 |
| Massa molecolare (u) | 98,92 |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 200-870-3 |
| PubChem | 6371 |
| SMILES | C(=O)(Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,42 (a 8 °C) |
| Temperatura di fusione | −118 °C (155 K) |
| Temperatura di ebollizione | 8 °C (281 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −219,1 |
| ΔfG0 (kJ·mol−1) | −204,9 |
| S0m(J·K−1mol−1) | 283,5 |
| C0p,m(J·K−1mol−1) | 57,7 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 330 - 314 - 280 - EUH071 |
| Consigli P | 260 - 280 - 304+340 - 303+361+353 - 305+351+338 - 315 - 405 - 403 [1] |
Il fosgene (o cloruro di carbonile) a temperatura ambiente è un gas incolore estremamente tossico e aggressivo, dal tipico odore di fieno ammuffito; la sua formula chimica è COCl2.
Da un punto di vista sistematico, è il dicloruro dell'acido carbonico.
È un prodotto di sintesi, ma piccole quantità possono formarsi in natura dalla decomposizione e dalla combustione di composti organici contenenti cloro.
Durante la Prima guerra mondiale è stato impiegato come arma chimica.
Il fosgene è un veleno particolarmente insidioso perché non provoca effetti immediati: in genere, i sintomi si manifestano tra le 24 e le 72 ore dopo l'esposizione. Combinandosi con l'acqua contenuta nei tessuti del tratto respiratorio, il fosgene si decompone in anidride carbonica e acido cloridrico; quest'ultimo dissolve le membrane delle cellule esposte, facendo sì che le vie respiratorie si riempiano di liquido; la morte sopraggiunge per combinazione di emorragie interne, shock e insufficienza respiratoria; a differenza di altri gas, il fosgene non viene assorbito attraverso la pelle e il suo effetto si produce solo per inalazione.
Storia
Il fosgene è stato sintetizzato per la prima volta dal chimico John Davy nel 1812.[2] Inizialmente fu usato come arma chimica, durante la prima guerra mondiale, dai francesi nel 1915;[3] dapprima i tedeschi iniziarono ad aggiungerne piccole quantità al cloro per aumentarne la tossicità per poi usarlo al 50% con il cloro per ridurre la densità del fosgene alle basse temperature che ne rendeva difficile la propagazione in forma di nube.[4].
Si calcola che nella prima guerra mondiale i morti dovuti all'uso del fosgene siano stati circa 100.000.
Il Regio Esercito ha utilizzato il fosgene in Libia e durante la guerra d'Etiopia sia contro militari sia contro civili[5].
Produzione e utilizzi
Industrialmente il fosgene è prodotto facendo fluire ossido di carbonio e cloro gassosi su un letto di carbone ad alta porosità che agisce da catalizzatore.
La reazione che avviene è
La reazione è esotermica, ovvero avviene con sviluppo di calore, quindi il reattore deve essere raffreddato continuamente per allontanare il calore che viene prodotto. In genere la reazione viene condotta a temperature comprese tra 50 °C e 150 °C; sopra 200 °C il fosgene torna a decomporsi in cloro e ossido di carbonio.
Un'altra reazione in cui viene prodotto fosgene è quella tra tetraclorometano e acqua ad alte temperature
Per via dei problemi di sicurezza legati al suo trasporto e alla sua conservazione, quasi sempre il fosgene è prodotto e utilizzato nello stesso impianto chimico.
La luce, in presenza di ossigeno atmosferico, è in grado di convertire il cloroformio in fosgene, per questa ragione il cloroformio è sempre conservato in boccette ambrate e ben tappato. Talvolta le soluzioni di cloroformio vengono stabilizzate utilizzando dell'etanolo che inibirebbe la formazione di fosgene.
Il fosgene è principalmente impiegato come materia prima nella produzione di polimeri, tra cui i poliuretani, i policarbonati e le poliuree, oltre che nella produzione del kevlar.
Viene usato anche per produrre isocianati e cloruri acilici, intermedi nelle produzioni di pesticidi, coloranti e molecole di interesse farmaceutico.
Tramite l'uso del fosgene è possibile isolare dai loro minerali alcuni metalli, tra cui alluminio e uranio, ma si tratta di processi poco usati per via della pericolosità della sostanza.
Note
- ^ scheda del fosgene su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ (EN) John Davy, On a gaseous compound of carbonic oxide and chlorine, in Philosophical Transactions of the Royal Society of London, vol. 102, 1812, pp. 144–151, DOI:10.1098/rstl.1812.0008, JSTOR 107310.
- ^ (EN) Mary Jo Nye, Before big science: the pursuit of modern chemistry and physics, 1800–1940, Harvard University Press, 1999, p. 193, ISBN 0-674-06382-1.
- ^ (EN) Edwin Kiester, An Incomplete History of World War I, vol. 1, Murdoch Books, 2007, p. 74, ISBN 978-1-74045-970-9.
- ^ A. Del Boca, I gas di Mussolini, Editori Riuniti, Roma, 1996 ISBN 978-88-359-5859-8
Voci correlate
Altri progetti
 Wikimedia Commons contiene immagini o altri file su fosgene
Wikimedia Commons contiene immagini o altri file su fosgene
Collegamenti esterni
- (EN) phosgene, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Davy's account of his discovery of phosgene, su web.lemoyne.edu.
- (EN) International Chemical Safety Card 0007, su ilo.org.
- (EN) NIOSH Pocket Guide to Chemical Hazards, su cdc.gov.
- (EN) U.S. CDC Emergency Preparedness & Response, su bt.cdc.gov. URL consultato il 25 novembre 2007 (archiviato dall'url originale il 17 ottobre 2005).
- (EN) U.S. EPA Acute Exposure Guideline Levels, su epa.gov.
- (EN) Regime For Schedule 3 Chemicals And Facilities Related To Such Chemicals, OPCW website
- (EN) CBWInfo website, su cbwinfo.com. URL consultato il 25 novembre 2007 (archiviato dall'url originale il 18 febbraio 2006).
- (EN) Use of Phosgene in WWII and in modern-day warfare (Refer to Section 4.C of the article)
| Controllo di autorità | Thesaurus BNCF 33214 · LCCN (EN) sh96001291 · GND (DE) 4174339-8 · BNF (FR) cb12546210f (data) · J9U (EN, HE) 987007542042105171 |
|---|


