Strongiloidosi
| Strongiloidosi | |
|---|---|
 | |
| Specialità | infettivologia e elmintologo |
| Eziologia | Strongyloides stercoralis |
| Classificazione e risorse esterne (EN) | |
| ICD-9-CM | 127.2 |
| ICD-10 | B78 |
| MeSH | D013322 |
| MedlinePlus | 000630 |
| eMedicine | 999614 e 229312 |
La strongiloidosi o strongiloidiasi è una parassitosi che colpisce gli esseri umani causata dal nematode Strongyloides stercoralis, o a volte dallo S. fülleborni.[1] Appartengono al gruppo dei vermi cilindrici. Questi vermi intestinali possono causare svariati sintomi, principalmente sintomi cutanei, dolore addominale, diarrea e perdita di peso. In alcune persone, specialmente quelle che assumono corticosteroidi o altri farmaci immunosoppressori, lo Strongyloides può causare una sindrome da iperinfestazione che, non trattata, può avere decorso fatale. Si può formulare la diagnosi tramite analisi del sangue e delle feci.
La strongiloidosi è un'elmintiasi trasmessa dalle feci o dal terreno disseminato di feci di animali infestati. Ha una prevalenza molto bassa nelle società in cui la contaminazione fecale del suolo è rara. Appartiene al gruppo delle malattie tropicali neglette, da alcuni considerata la più negletta delle malattie neglette e vengono compiuti sforzi a livello globale mirati a sradicare questa malattia.[2][3]
Storia[modifica | modifica wikitesto]
La malattia è stata identificata per la prima volta nel 1876 dal medico francese Louis Alexis Normand, mentre lavorava all'ospedale navale di Toulon. Egli individuò dei vermi adulti e li inviò a Arthur Réné Jean Baptiste Bavay, ispettore capo per la sanità, il quale osservò che questi erano le forme adulte delle larve ritrovate nelle feci. Nel 1883 il parassitologo tedesco Rudolf Leuckart fece delle osservazioni sul ciclo vitale del parassita e il medico belga Paul Van Durme (lavorando su osservazioni del parassitologo tedesco Arthur Looss) descrisse le modalità di infezione tramite la pelle. Il parassitologo tedesco Friedrich Fülleborn descrisse l'autoinfezione e il modo in cui la strongiloidosi coinvolgeva l'intestino. L'interesse per la malattia aumentò negli anni '40 quando si scoprì che gli individui che erano stati contagiati all'estero e ricevevano immunosoppressori sviluppavano sindrome da iperinfestazione.[4]
Epidemiologia[modifica | modifica wikitesto]
In generale, le informazioni sui tassi di infezione / prevalenza del parassita sono scarse e vari studi suggeriscono che l'infezione da S. stercoralis è altamente sottostimata, specialmente nell'Africa sub-sahariana e nel sud-est asiatico.
È un'infezione molto rara nei paesi sviluppati ed è meno diffusa nelle aree urbane che nelle aree rurali dei paesi poveri delle risorse, con l'eccezione delle zone di baraccopoli nelle città più grandi. Si stima che la malattia colpisca 100-200 milioni di persone in tutto il mondo in 70 paesi. In Africa, la gamma di tassi di infezione nelle comunità varia dallo 0,1% nella Repubblica Centrafricana fino al 91,8% in Gabon. Nell'America centro-meridionale, Haiti registra una prevalenza dell'1,0%, mentre in Perù il tasso di infezione raggiunge il 75,3%. È interessante notare che nel sud-est asiatico, un'altra parte altamente endemica del mondo, diversi paesi riportano tassi di infezione entro una gamma relativamente bassa. In Cambogia, il tasso di infezione è del 17,5%, Tailandia del 23,7% e Laos del 26,2%. In Europa e negli Stati Uniti l'infezione è stata riscontrata in limitati gruppi di popolazione e colpisce prevalentemente individui che perseguono attività agricole, specie nella coltivazione del riso, o minatori. Inoltre, nei paesi sviluppati, la strongiloidosi rimane un problema per gli immigrati, turisti e militari ritorno da aree endemiche.[5][6][7][8][9][10][11]
Questo fatto ha implicazioni per i servizi medici nei paesi sviluppati e può richiedere uno screening sistematico dopo le visite a paesi endemici e prima di iniziare un trattamento immunosoppressivo.[12][13]
La vera prevalenza della strongiloidosi è probabilmente sottostimata anche perché l'infezione è spesso subclinica. Globalmente, i tassi di prevalenza di strongiloidosi raggiungono il 40% in certe aree dove coesistono terreno adeguatamente umido e smaltimento improprio di rifiuti umani, in particolare l'Africa occidentale, i Caraibi e il Sud-Est asiatico, nonché la Colombia, le zone tropicali del Brasile.
Sebbene l'infezione da Strongyloides sia stata riscontrata in tutte le età, l'infezione può verificarsi più frequentemente all'inizio dell'infanzia, poiché i bambini sono più propensi a giocare all'aperto in terreni contaminati a piedi nudi. L'età avanzata è anche un fattore di rischio per strongiloidosi diffuse, poiché può essere associata a uno stato immunosoppressivo.
Trasmissione[modifica | modifica wikitesto]
Le infezioni zoonotiche delle specie Strongyloides sono normalmente contratte per contatto con sabbia o terreno che contiene escrementi di animali infetti. Le infezioni sono segnalate anche tra veterinari e operatori di laboratorio che lavorano in climi temperati e sono esposti a larve che hanno infestato cavalli.
Il più delle volte la trasmissione avviene con le larve che penetrano la pelle dei piedi(camminare non protetti in un'area contaminata, spesso su una spiaggia per contatto della pelle con la sabbia). Visto che la diffusione è fecale la trasmissione può avvenire anche sessualmente (sesso anale)[14]. Sono stati descritti casi di trasmissione con il trapianto di organi.[15]
Clinica[modifica | modifica wikitesto]
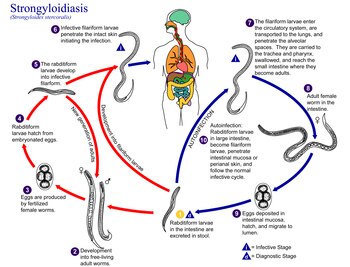
La strongiloidosi può manifestarsi con sintomi di almeno cinque tipi. Sebbene biologicamente affine alla anchilostomiasi e alla oncocercosi, la strongiloidosi o strongiloidiasi è ben distinta nella sua espressione clinica. Sebbene solitamente lieve, l'infezione può essere grave e pericolosa per la vita dell'uomo in caso di immunodeficienza (malattie ematologiche, terapie immunosoppressive). La strongiloidosi può causare sintomi intermittenti che colpiscono principalmente l'intestino (dolore addominale e diarrea intermittente o persistente), i polmoni (tosse, respiro sibilante, bronchite cronica) o la pelle (prurito, orticaria). I casi asintomatici possono ospitare i parassiti anche per molti anni, ignari dell'infezione. Per questo motivo è estremamente importante sospettare, diagnosticare e curare l'infezione.
Al contagio si possono verificare sintomi respiratori (sindrome di Löffler). L'infezione può diventare cronica e manifestarsi principalmente con sintomi a carico dell'apparato digerente. Quando le larve migrano attraverso il corpo possono verificarsi sintomi respiratori, cutanei e digestivi. Infine, la sindrome da iperinfestazione può causare sintomi a carico di molti apparati, incluso il sistema nervoso centrale.[16][17]
Forma senza complicanze[modifica | modifica wikitesto]
È di frequente asintomatica.
I sintomi a carico dell'apparato gastrointestinale includono dolore addominale e diarrea. I sintomi polmonari (inclusa la sindrome di Loeffler) possono verificarsi durante la migrazione polmonare delle larve filariformi. Le manifestazioni cutanee includono rash e orticaria nella zona perianale e attorno alla vita, nonché larva currens, una condizione di bruciore cutaneo causata dalla rapida migrazione intradermica degli strongiloidi.[18] Generalmente si verifica anche eosinofilia. La strongiloidosi può diventare cronica e passare ad una fase completamente asintomatica.
Forma disseminata[modifica | modifica wikitesto]
La strongiloidosi disseminata si verifica quando pazienti affetti da strongiloidosi cronica diventano immunosoppressi. Si presenta con dolore addominale, distensione addominale, shock, complicazioni polmonari e neurologiche e setticemia, ed è potenzialmente fatale. I vermi entrano nel flusso sanguigno attraverso la parete intestinale, permettendo allo stesso tempo il passaggio nel sangue di batteri intestinali come l'Escherichia coli. Questo può causare sintomi come la sepsi (infezione del flusso sanguigno),[19] e i batteri possono diffondersi ad altri organi dove causano infezioni localizzate, tra cui la meningite.[20]
La diffusione può verificarsi anche molti decenni dopo l'infezione iniziale[21] ed è stata associata ad alte dosi di corticosteroidi, trapianto di organi, HIV,[22][23] lebbra lepromatosa, sifilide terziaria, anemia aplastica, malnutrizione, tubercolosi avanzata e avvelenamento da radiazioni.[24] Spesso si raccomanda uno screening per la strongiloidosi cronica preventiva nei pazienti che devono iniziare una terapia a base di immunosoppressori; tuttavia, questo non è sempre pratico e nei paesi sviluppati l'incidenza della strongiloidosi è così bassa che un tale screening non determina un abbattimento di costi, tranne che nelle zone endemiche.
È importante notare che nella forma disseminata della patologia non necessariamente si sviluppa eosinofilia. L'assenza di eosinofilia può essere indice di una cattiva prognosi.[25]
Diagnosi[modifica | modifica wikitesto]
Qualsiasi diarrea a lungo termine, che si evolve attraverso successive convulsioni, con eosinofilia richiederà la conferma parassitologica con esami di laboratorio. La diagnosi si basa sull'individuazione al microscopio delle larve (rhabditiformi e a volte filariformi) nelle feci o nel fluido duodenale. Può essere necessario l'esame di numerosi campioni, e a volte neanche questo è sufficiente, perché l'esame diretto delle feci non ha una buona sensibilità (con un singolo campione si riescono ad individuare larve nel 25% circa dei casi).[26] Possono volerci 4 settimane dall'infezione iniziale perché le larve passino nelle feci.
Le feci possono essere esaminate tramite vetrino portaoggetti:
- direttamente;
- dopo concentrazione (formalina - etil acetato);
- dopo recupero delle larve con la tecnica dell'imbuto di Baermann;
- dopo coltura con la tecnica del filtro di carta di Harada-Mori;
- dopo cultura in piastra di Petri con agar agar.
Le tecniche di coltura sono le più sensibili, ma non sono normalmente disponibili nei paesi occidentali. Nel Regno Unito, le culture sono disponibili alla Scuola di medicina tropicale di Liverpool e a quella di Londra. Bisogna effettuare un esame diretto delle feci appena raccolte e non permettere che si raffreddino perché questo causa la schiusa delle uova dell'anchilostoma e le sue larve sono molto difficili da distinguere dagli strongiloidi. L'associazione con anchilostomi rende spesso difficile la diagnosi.
Nel 70% dei casi la ricerca degli strongiloidi nelle feci risulta negativa. Se si sospetta un'infezione grave, è importante effettuare campionamenti frequenti delle feci nonché una biopsia duodenale. Il fluido duodenale può essere esaminato con tecniche come l'entero-test o l'aspirazione duodenale.[27] In pazienti con strongilodosi disseminata le larve possono essere individuate nell'espettorato. Nei casi di strogiloidosi si trova anche un alto livello di cellule polinucleari eosinofile nel sangue.
Un esame che può risultare utile è la ricerca di anticorpi col metodo ELISA.[28] In pazienti immunocompressi l'esame sierologico può manifestare reattività crociata con altri parassiti, rimanere positivo per anni anche a seguito di trattamento andato a buon fine o dare un falso negativo.[29] I pazienti infetti hanno solitamente una conta elevata degli eosinofili, con una conta media degli eosinofili di 1000 in una serie.[30] Quando al sospetto clinico si aggiungono la presenza di anticorpi e eosinofilia periferica, l'infezione è fortemente probabile.
Trattamento[modifica | modifica wikitesto]
Il farmaco di elezione per il trattamento della strongiloidosi senza complicazioni è l'ivermectina. L'ivermectina non uccide le larve degli strongiloidi, ma solo i vermi adulti. Di conseguenza, può rendersi necessario ripetere il trattamento per eradicare completamente l'infezione. La somministrazione si ripete solitamente dopo circa due settimane, ovvero la durata del ciclo auto-infettivo, tuttavia potrebbe essere necessario somministrare dosi aggiuntive per uccidere gli strongiloidi nel sangue o le larve negli intestini o nei diverticoli. Altri farmaci efficaci sono l'albendazolo e il tiabendazolo (25 mg/kg due volte al giorno per 5 giorni, per un massimo di 400 mg). Si dovrebbe somministrare il trattamento a tutti i pazienti a rischio di strongiloidosi disseminata. La durata ottimale del trattamento per pazienti con infezione disseminata non è ancora chiara.
Il trattamento della strongiloidosi può essere difficile ed è noto che gli strongiloidi sono capaci di vivere all'interno del corpo umano per decenni, persino dopo il trattamento.[31] Per questa ragione è necessario continuare il trattamento dopo la scomparsa dei sintomi. Gli abiti e le lenzuola dei soggetti infetti devono essere lavati con detersivo in polvere a base di enzimi e asciugate ad alta temperatura quotidianamente.
Prevenzione[modifica | modifica wikitesto]
Nessuna strategia di sanità pubblica è stata sviluppata per controllare la strongiloidosi. Come per l'anchilostomiasi opportune misure di profilassi ambientale e comportamentale sono associate ad una importante riduzione della prevalenza. Indossare scarpe alte, specialmente in zone fangose, così come pulizia e asciugatura immediate e vigorose della pelle, in caso di contatto con il fango, sono sufficienti per prevenire la trasmissione. La strongiloidosi è quasi scomparsa nei paesi in cui sono migliorati i servizi igienico-sanitari e lo smaltimento dei rifiuti umani.
Nelle aree in cui il trattamento di massa con ivermectina è stato usato per controllare l'oncocercosi o la filariosi linfatica, la prevalenza della strongiloidosi è probabilmente ridotta, ma sono necessarie ulteriori indagini.
Note[modifica | modifica wikitesto]
- ^ Strongyloidiasis: Background, Pathophysiology, Etiology, 4 gennaio 2019. URL consultato il 23 gennaio 2019.
- ^ Annette Olsen, Lisette Lieshout e Hanspeter Marti, Strongyloidiasis — The most neglected of the neglected tropical diseases?, vol. 103, 1º aprile 2009. URL consultato il 2 agosto 2018.
- ^ Neglected Tropical Diseases, su cdc.gov, 6 giugno 2011. URL consultato il 28 novembre 2014.
- ^ Cox FE, History of Human Parasitology, in Clin. Microbiol. Rev., vol. 15, n. 4, ottobre 2002, pp. 595-612, DOI:10.1128/CMR.15.4.595-612.2002, PMC 126866, PMID 12364371. URL consultato il 26 luglio 2018 (archiviato dall'url originale il 23 ottobre 2011).
- ^ WHO: Strongyloidiasis, su who.int.
- ^ (EN) Daniel Greaves, Sian Coggle e Christopher Pollard, Strongyloides stercoralis infection, in BMJ, vol. 347, 30 luglio 2013, pp. f4610, DOI:10.1136/bmj.f4610. URL consultato il 28 luglio 2018.
- ^ (EN) Lluís Valerio, Sílvia Roure e Gema Fernández-Rivas, Strongyloides stercoralis, the hidden worm. Epidemiological and clinical characteristics of 70 cases diagnosed in the North Metropolitan Area of Barcelona, Spain, 2003–2012, in Transactions of The Royal Society of Tropical Medicine and Hygiene, vol. 107, n. 8, 19 giugno 2013, pp. 465-470, DOI:10.1093/trstmh/trt053. URL consultato il 28 luglio 2018.
- ^ (EN) P. R. Sanchez, Endemic strongyloidiasis on the Spanish Mediterranean coast, in QJM, vol. 94, n. 7, 1º luglio 2001, pp. 357-363, DOI:10.1093/qjmed/94.7.357. URL consultato il 28 luglio 2018.
- ^ (EN) GENTA, ROBERT M., GATTI, SIMONA e LINKE, MICHAEL J., Endemic Strongyloidiasis in Northern Italy: Clinical and Immunological Aspects, in QJM: An International Journal of Medicine, vol. 68, n. 3-4, 1988-09, DOI:10.1093/oxfordjournals.qjmed.a068235. URL consultato il 28 luglio 2018.
- ^ (EN) Andrea Angheben, Manuela Mistretta e Maria Gobbo, Acute Strongyloidiasis in Italian Tourists Returning From Southeast Asia, in Journal of Travel Medicine, vol. 18, n. 2, 1º marzo 2011, pp. 138-140, DOI:10.1111/j.1708-8305.2010.00496.x. URL consultato il 28 luglio 2018.
- ^ Strongoloidosi (PDF) [collegamento interrotto], su sisp.aulss9.veneto.it.
- ^ Fabian Schär, Ulf Trostdorf e Federica Giardina, Strongyloides stercoralis: Global Distribution and Risk Factors, in PLoS Neglected Tropical Diseases, vol. 7, n. 7, 11 luglio 2013, DOI:10.1371/journal.pntd.0002288. URL consultato il 28 luglio 2018.
- ^ Santhosh Puthiyakunnon, Swapna Boddu e Yiji Li, Strongyloidiasis—An Insight into Its Global Prevalence and Management, in PLoS Neglected Tropical Diseases, vol. 8, n. 8, 14 agosto 2014, DOI:10.1371/journal.pntd.0003018. URL consultato il 28 luglio 2018.
- ^ F Sorvillo, K Mori e W Sewake, Sexual transmission of Strongyloides stercoralis among homosexual men., in British Journal of Venereal Diseases, vol. 59, n. 5, 1983-10, p. 342. URL consultato il 28 luglio 2018.
- ^ (EN) Keith W. Hamilton, Peter L. Abt e Misha A. Rosenbach, Donor-Derived Strongyloides stercoralis Infections in Renal Transplant Recipients, in Transplantation, vol. 91, n. 9, 2011-05, pp. 1019-1024, DOI:10.1097/TP.0b013e3182115b7b. URL consultato il 28 luglio 2018.
- ^ Montes M, Sawhney C, Barros N, Strongyloides stercoralis: there but not seen, in Curr Opin Infect Dis, vol. 23, n. 5, Oct 2010, pp. 500-4, DOI:10.1097/QCO.0b013e32833df718, PMC 2948977, PMID 20733481.
- ^ Marcos LA, Terashima A, Dupont HL, Gotuzzo E, Strongyloides hyperinfection syndrome: an emerging global infectious disease, in Trans R Soc Trop Med Hyg, vol. 102, n. 4, Apr 2008, pp. 314-8, DOI:10.1016/j.trstmh.2008.01.020, PMID 18321548.
- ^ Robert P. Arthur e Shelley WB, Larva Currens, in AMA Archives of Dermatology, vol. 78, n. 2, 1º agosto 1958, pp. 186-90, DOI:10.1001/archderm.1958.01560080044007, PMID 13558704.
- ^ UC Ghoshal, Ghoshal, U, Jain, M, Kumar, A, Aggarwal, R, Misra, A, Ayyagari, A e Naik, SR, Strongyloides stercoralis infestation associated with septicemia due to intestinal transmural migration of bacteria, in Journal of Gastroenterology and Hepatology, vol. 17, n. 12, dicembre 2002, pp. 1331-3, DOI:10.1046/j.1440-1746.2002.02750.x, PMID 12423282.
- ^ Graeff-Teixeira C, da Silva AC, Yoshimura K, Update on Eosinophilic Meningoencephalitis and Its Clinical Relevance, in Clinical Microbiology Reviews, vol. 22, n. 2, Apr 2009, pp. 322-48, DOI:10.1128/CMR.00044-08, PMC 2668237, PMID 19366917.
- ^ Gill GV, Beeching NJ, Khoo S, A British Second World War veteran with disseminated strongyloidiasis, in Trans R Soc Trop Med Hyg, vol. 98, n. 6, 2004, pp. 382-6, DOI:10.1016/j.trstmh.2003.11.002, PMID 15099996.
- ^ Kramer MR, Gregg PA, Goldstein M, Llamas R, Krieger BP, Disseminated strongyloidiasis in AIDS and non-AIDS immunocompromised hosts: diagnosis by sputum and bronchoalveolar lavage, in South Med J, vol. 83, n. 10, 1990, pp. 1226-9, DOI:10.1097/00007611-199010000-00024, PMID 2218668.
- ^ Gompels MM, Todd J, Peters BS, Main J, Pinching AJ, Disseminated strongyloidiasis in AIDS: uncommon but important, in AIDS, vol. 5, n. 3, 1991, pp. 329-32, DOI:10.1097/00002030-199103000-00015, PMID 2059374.
- ^ Purtilo DT, Meyers WM, Connor DH, Fatal strongyloidiasis in immunosuppressed patients, in Am J Med, vol. 56, n. 4, 1974, pp. 488-93, DOI:10.1016/0002-9343(74)90481-1, PMID 4818417.
- ^ Full Text:Hyperinfection by Strongyloides Stercoralis, su omjournal.org. URL consultato il 13 marzo 2015.
- ^ (EN) Marisel Segarra-Newnham, Manifestations, Diagnosis, and Treatment of Strongyloides stercoralis Infection, in Annals of Pharmacotherapy, vol. 41, n. 12, 1º dicembre 2007, pp. 1992-2001, DOI:10.1345/aph.1K302, ISSN 1060-0280, PMID 17940124.
- ^ A new technique for sampling duodenal contents: demonstration of upper small-bowel pathogens., in Am J Trop Med Hyg, vol. 19, Mar 1970, pp. 349-52, PMID 5443084.
- ^ (EN) S. M. Carroll, K. T. Karthigasu e D. I. Grove, Serodiagnosis of human strongyloidiasis by an enzyme-linked immunosorbent assay, in Transactions of The Royal Society of Tropical Medicine and Hygiene, vol. 75, n. 5, 1º gennaio 1981, pp. 706-709, DOI:10.1016/0035-9203(81)90156-5, ISSN 0035-9203, PMID 7036430.
- ^ Strongyloidiasis: a review and update by case example, in Clin Lab Sci, vol. 21, 2008, pp. 82-8, PMID 18507302.
- ^ (EN) Reto Nuesch, Lukas Zimmerli, Rolf Stockli, Niklaus Gyr e F.r. Christoph Hatz, Imported Strongyloidosis: A Longitudinal Analysis of 31 Cases, in Journal of Travel Medicine, vol. 12, n. 2, 1º marzo 2005, pp. 80-84, DOI:10.2310/7060.2005.12204, ISSN 1708-8305. URL consultato il 26 luglio 2018 (archiviato dall'url originale il 5 maggio 2016).
- ^ http://www.dva.gov.au/sites/default/files/files/publications/health/strongyloides_brochure.pdf
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su strongiloidiasi
Wikimedia Commons contiene immagini o altri file su strongiloidiasi
| Controllo di autorità | Thesaurus BNCF 48006 |
|---|