Salda d'amido
La salda d'amido è un gel a base di amido, utilizzato in laboratorio di analisi chimica come indicatore redox nelle titolazioni iodometriche e iodimetriche per via della sua capacità di formare complessi di colore blu scuro con lo iodio[1]. Si ottiene solubilizzando in acqua calda l'amido che gelifica una volta fatta raffreddare la soluzione[2].
Preparazione[modifica | modifica wikitesto]
Si bagnano 2 grammi di amido in polvere con 15-20 mL di acqua fredda e si versa il tutto in 100 mL di acqua bollente sotto costante agitazione. Si lascia bollire per qualche minuto, dopodiché si fa raffreddare per ottenere il gel. La salda d'amido è una sostanza sensibile alle alte temperature e che decompone per azione batterica, va quindi conservata lontana da fonti di calore e in recipienti di vetro scuro, in modo da non far passare la luce. Nella fase di preparazione possono essere aggiunti opportuni battericidi[3], come ioduro mercurico o acido salicilico[4].
Formazione del complesso[modifica | modifica wikitesto]
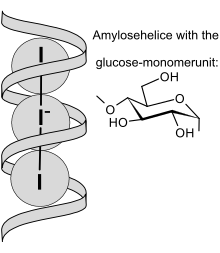
In soluzione acquosa e in presenza di iodio molecolare (I2) e dello ione ioduro (I−) si ha la formazione dello ione triioduro (I3−)
Si ritiene che tale ione venga adsorbito dalla frazione di amilosio presente nella salda d'amido, venendo incluso nella struttura ad elica con la formazione di un complesso di colore blu-violaceo[5]. I meccanismi chimici per cui avviene l'adsorbimento, tuttavia, non sono ancora del tutto chiari[6].
Note[modifica | modifica wikitesto]
- ^ (EN) Iodometry - end point detection with starch, su titrations.info, Titration and titrimetric methods. URL consultato l'11 febbraio 2015.
- ^ Alessandro Bruni, Farmacognosia generale e applicata, Padova, Piccin Nuova Libraria S.p.A., 1999, p. 173, ISBN 88-299-1500-9. URL consultato l'11 febbraio 2015.
- ^ Indicatori (PDF), su chimica.unipd.it, Sito web del Dipartimento di Scienze Chimiche dell’Università degli Studi di Padova. URL consultato l'11 febbraio 2015 (archiviato dall'url originale l'11 febbraio 2015).
- ^ (EN) Solutions used in iodometric titrations, Starch solution, su titrations.info, Titration and titrimetric methods. URL consultato l'11 febbraio 2015.
- ^ I. Rossetti, G. Cappelletti e C. Crippa, Determinazione del Cu in pigmenti (PDF), su orientachimica.unimi.it, Orienta Chimica, sito web del Dipartimento di Chimica dell'Università degli Studi di Milano. URL consultato il 12 febbraio 2015 (archiviato dall'url originale il 12 febbraio 2015).
- ^ (EN) Fred Senese, How does starch indicate iodine?, su antoine.frostburg.edu, Antoine, sito web dei Dipartimenti di Chimica, Fisica, Ingegneria e Biologia della Frostburg State University. URL consultato il 12 febbraio 2015.
Voci correlate[modifica | modifica wikitesto]
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) Barnet Naiman, Preservation of starch indicator, in Journal of Chemical Education, vol. 14, n. 3, American Chemical Society, marzo 1937, DOI:10.1021/ed014p138.1, ISSN 0021-9584. URL consultato l'11 febbraio 2015.
