Cianina
Cianina è il nome non-sistematico di una famiglia di coloranti sintetici che appartiene alla categoria dei polimetini. Il nome "cianina" deriva dalla parola "ciano", una sfumatura tra il blu e il verde e deriva dalla parola greca κυάνεος/κυανοῦς (kyaneos/kyanous), ovvero "blu scuro".
Le cianine erano e sono tuttora in uso nelle industrie, solo recentemente hanno visto una applicazione nelle biotecnologie per marcature o analisi specifiche. Possiedono un carattere fluorescente che copre lo spettro che va dall'infrarosso all'ultravioletto, in basa alla struttura chimica. Attualmente ritroviamo in letteratura un gran numero di coloranti che rientrano in questa famiglia.
Struttura[modifica | modifica wikitesto]

I = Streptocianine,
II = Emicianine,
III = Cianine chiuse
Esistono tre tipologie di cianine:[1]
- Streptocianine o cianine a catena aperta:
- R2N+=CH[CH=CH]n-NR2 (I)
- Emicianine:
- Aril=N+=CH[CH=CH]n-NR2 (II)
- Cianine a catena chiusa:
- Aril=N+=CH[CH=CH]n-N=Aril (III)
dove due atomi di azoto sono legati da una catena di polimetini.[2] Entrambi gli azoto prendono indipendentemente parte in un ciclo eteroaromatico, come pirrolo, imidazolo, tiazolo, piridina, indolo, chinolina, benzotiazolo, etc.
Storia e usi in industria[modifica | modifica wikitesto]
Le cianine furono sintetizzate per la prima volta più di un secolo fa. Furono adoperate immediatamente per aumentare l'intervallo di sensibilità per emulsioni fotografiche, ad esempio aumentare il numero di lunghezze d'onda che formano un'immagine su una pellicola, così da renderla pancromatica. Le cianine sono attualmente usate anche per CD-R e DVD-R. Quelle sfruttate sono principalmente di colore verde o blu chiaro e hanno una bassa stabilità chimica; questo rende i dischi provvisti di cianine instabili inutilizzabili per l'archiviazione classica fornita da CD e DVD, poiché i files diventerebbe illeggibili dopo pochi anni. Tuttavia recenti dischi di cianine sono stati provvisti di stabilizzanti che rallentano il deterioramento in maniera significativa. In media possiedono una vita di archiviazione che raggiunge e supera i 75 anni. Altri coloranti usati in CD-R sono la ftalocianina e azocomposti.
Cianine per le biotecnologie[modifica | modifica wikitesto]
Le Cianine sono generalmente sintetizzate da 2, 3, 5 or 7 strutture di metini, con gruppi funzionali su uno od entrambi gli atomi di azoto delle catene, così da poter essere legati chimicamente agli acidi nucleici o alle proteine. La marcatura è effettuata con finalità di quantificazione o visualizzazione. Alcune applicazioni biologiche possibili includono l'ibridazione genomica comparativa, i microarray usati in trascrittomica e vari studi applicati alla proteomica, come ad esempio la localizzazione di RNA,[3] l'interazione molecolare studiata tramite trasferimento energetico di fluorescenza (FRET) e saggi immunometrici fluorescenti.
Le cianine sono disponibili con varie modificazione, come ad esempio provvisti di sostituenti metilici, etilici o butilici, oppure con gruppi carbossilici, acetilmetossilici o sulfurei (che donano idrofilicità alla molecola).[4]
| Sonda | Ex (nm) | Em (nm) | PM | Resa quantica |
|---|---|---|---|---|
| Cy2 | 489 | 506 | 714 | QY 0.12 |
| Cy3 | (512);550 | 570;(615) | 767 | QY 0.15 |
| Cy3B | 558 | 572;(620) | 658 | QY 0.67 |
| Cy3.5 | 581 | 594;(640) | 1102 | QY 0.15 |
| Cy5 | (625);650 | 670 | 792 | QY 0.27[5] |
| Cy5.5 | 675 | 694 | 1128 | QY 0.28[6] |
| Cy7 | 743 | 767 | 818 | QY 0.28 |
Ex (nm): Lunghezza d'onda di eccitazione in nanometri
Em (nm): Lunghezza d'onda di emissione in nanometri
PM: Peso Molecolare
QY: Resa quantica
Principali cianine[modifica | modifica wikitesto]
Le cianine (Cy) rimpiazzano efficacemente i coloranti convenzionali come la Fluoresceina (FITC) e la rodamina (TRITC, RRX), dimostrandosi più brillante e con una fluorescenza più stabile.
- Cy 3 e Cy5 sono i più adoperati, tipicamente sfruttati assieme per una rilevazione in due colori.
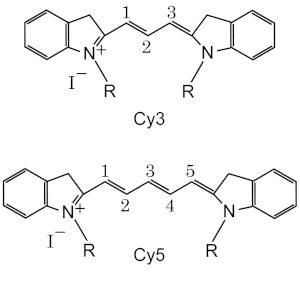
Cy3 fluoresce tra il giallo e il verde (~550 nm di eccitazione, ~570 nm di emissione), mentre Cy5 è fluorescente nel rosso (~650 di eccitazione, 670 nm di emissione).[7] Cy3 può essere seguito tramite vari fluorometri, sensori di immagine e microscopi con filtri standard per la tetrametilrodamina (TRITC). Grazie al tipico coefficiente di estinzione molare, questo colorante può essere facilmente rilevato già ad occhio nudo sia su supporti in gel, sia in soluzione. Cy5 è divenuto tanto popolare da rimpiazzare tutti i coloranti sul rosso-lontano grazie all'elevato coefficiente di estinzione molare (può essere rilevato fino ad 1nmol di campione ad occhio nudo su gel elettroforesi) e grazie al suo massimo di emissione nella regione rossa, dove molti CCD detector hanno il massimo di sensibilità e i campioni biologici hanno il minimo rumore di fondo.
Gli scanner hanno ora in uso laser a varie lunghezze d'onda (tipicamente 532 nm e 635 nm) e filtri per lunghezze d'onda (550-600 nm e 655-695 nm) per ridurre le contaminazione di fondo. Essi sono, dunque, in grado di distinguere facilmente i colori da Cy3 e da Cy5 e riescono anche a quantificare la marcatura di Cy3 e Cy5 in un campione (detection multiparametrica).
- Altre cianine utili:
Cy3.5 può rimpiazzare la SolfoRodamina 101.
Cy5.5 è un colorante che emette nell'infrarosso-vicino (near-infrared) con un massimo di eccitazione/emissione intorno a 678/694 nm).
Cy7 è un colorante infrarosso-vicino invisibile ad occhio nudo (Massimo di eccitazione/emissione a 750/776 nm). È usato per applicazioni di imaging in vivo, così come anche il colorante Cy7.5.
Solfo–Cianine portano con sé generalmente uno o due gruppi sulfurei, in maniera tale da essere solubili in acqua. Esistono forme tri- e quadri-solfonati per applicazioni in cui è necessaria una maggiore solubilità. La PEGilazione è un'altra modificazione possibile che conferisce idrofilicità non solo alla molecola colorante, ma anche alla molecola marcata.
Nomenclatura e struttura[modifica | modifica wikitesto]
La nomenclatura standard descrive esattamente la struttura chimica della molecola. Cy3 e Cy5 sono nomi non-standard assegnati la prima volta da Ernst, et al. nel 1989, non danno alcuna informazione circa la struttura chimica. Negli scritti originali, il numero indicava soltanto il numero di metini senza, però, specificare quali gruppi laterali fossero presenti; questo ha portato in letteratura all'assegnazione di varie strutture chimiche differenti per Cy5 e Cy3.
Le catene laterali non devono necessariamente essere identiche; nei coloranti attuali vengono sfruttate corte catene alifatiche, sulle cui estremità (una o su entrambe) sono posti dei gruppi funzionali estremamente reattivi come N-idrossisuccinimmide o maleimide.
Cy alternative[modifica | modifica wikitesto]
Sono stati sviluppati molti analoghi degli standard Cy 2 / 3 / 3.5 / 5 / 5.5 / 7 / 7.5, su cui sono presenti differenti modificazioni: coloranti Alexa Fluor, coloranti Dylight, FluoProbes, Sulfo-Cianine[8], coloranti Seta[9], IRIS da Cyanine Technologies[10] e molti altri possono essere usati indifferentemente con coloranti della serie Cy nella stragrande maggioranza delle applicazioni biochimiche, con anche molti vantaggi in solubilità, fluorescenza o fotostabilità.[11][12]
Suscettibilità del Cy5 all'ozono[modifica | modifica wikitesto]
Nel 2003, i ricercatori della Inpharmatics e di Agilent hanno pubblicato, sulla rivista Analytical Chemistry, un articolo circa il fatto che i microarrays che sfruttavano Cy5 mostravano una qualità dei dati variabile in progressivo peggioramento, ciò a causa della presenza dell'ozono ambientale. L'esposizione a livelli di ozono superiori a 5-10 ppm per 10-30 secondi causava una caduta della riproducibilità dei dati acquisiti con Cy5-microarrays. Livelli di ozono ancora superiori (>100 ppb) causano danni anche su Cy3.[13] Esistono sul mercato strumenti che sembra riescano ad allontanare l'ozono ambientali entro determinati limiti, ma non è stata ancora verificata l'effettiva efficacia.
Applicazioni[modifica | modifica wikitesto]

Le cianine sono adoperate per marcare proteine, anticorpi, peptidi, sonde per acidi nucleici e qualsiasi altro tipo di biomolecola adoperata in varie tecniche di detection basate sulla fluorescenza, come ad esempio la citometria a flusso, microscopia (principalmente nello spettro del visibile, ma anche in UV e IR), saggi in micropiastre, microarray e molto altro.
Marcatura di acidi nucleici[modifica | modifica wikitesto]
In esperimenti di microarray, il DNA o l'RNA può essere marcato sia con Cy3 sia con Cy5, in quanto portano il gruppo reattivo N-idrossisuccinimmidil estere (NHS-estere). Dal momento che questo gruppo reagisce senza difficoltà soltanto con ammine alifatiche, di cui gli acidi nucleici sono sprovvisti, è necessario modificare precedentemente il campione con gruppi amminoallilici. Questa operazione è effettuata incorporando nucleotidi modificati durante reazioni di amplificazione. Una buona resa è ottenuta quando si raggiunge una marcatura ogni 60 basi, poiché marker troppo vicini tra loro provocherebbero un effetto di smorzamento del segnale (quenching effect).
Marcatura di proteine[modifica | modifica wikitesto]
Anche per questa operazione, come per gli acidi nucleici, la marcatura è possibile grazie al gruppo reattivo terminale NHS-estere o al gruppo maleimide, poiché reagiscono con i gruppi tiolici dei residui di cisteina.
Cy5 è sensibile ai campi elettrici, infatti può subire variazioni nell'emissione (sia in positivo, sia in negativo) a causa di conformazioni differenti della proteina a cui è legato (diversi gruppi carichi esposti). La velocità di questa variazione può essere misurata per la determinazione di parametri cinetici enzimatici, sfruttando esperimenti di FRET.
Cy3 e Cy5 sono adoperati in proteomica per marcare due campioni distinti e poterli mescolare, in maniera tale da poter condurre un unico esperimento e avere sempre i due campioni riconoscibili.[14][15] Questa possibilità elimina la variabilità causata da differenti condizioni sperimentali, inevitabili quando si lanciano due esperimenti in tempi differenti. Questa variabilità generalmente impedisce l'uso di software automatici per l'acquisizione dei dati dopo l'esperimento, viceversa tramite questa marcatura l'automatizzazione diviene molto semplice.
Note[modifica | modifica wikitesto]
- ^ Eunha Kim e Seung Bum Park, Discovery of New Synthetic Dyes: Targeted Synthesis or Combinatorial Approach?, in Alexander P. Demchenko (a cura di), Advanced Fluorescence Reporters in Chemistry and Biology I: Fundamentals and Molecular Design Volume 8 of Springer Series on Fluorescence, Berlin, Springer, 2010, p. 172, ISBN 978-3-642-04702-2.
- ^ Ernst LA, Gupta RK, Mujumdar RB, Waggoner AS, Cyanine dye labeling reagents for sulfhydryl groups, in Cytometry, vol. 10, n. 1, Jan 1989, pp. 3–10, DOI:10.1002/cyto.990100103, PMID 2917472.
- ^ Blower MD, Feric E, Weis K, Heald R, Genome-wide analysis demonstrates conserved localization of messenger RNAs to mitotic microtubules, in The Journal of Cell Biology, vol. 179, n. 7, Dic 2007, pp. 1365–73, DOI:10.1083/jcb.200705163, PMC 2373496, PMID 18166649.
- ^ CYanine dyes
- ^ Mujumdar B, Ernst A, Mujumdar SR, Lewis CJ, Waggoner AS, Cyanine dye labeling reagents: Sulfoindocyanine succinimidyl esters, in Bioconjugate Chemistry, vol. 4, n. 2, Mar 1993, pp. 105–111, DOI:10.1021/bc00020a001.
- ^ Umezawa K, Matsui A, Nakamura Y, Citterio D, Suzuki K, Bright, color-tunable fluorescent dyes in the Vis/NIR region: establishment of new "tailor-made" multicolor fluorophores based on borondipyrromethene, in Chemistry, vol. 15, n. 5, 2009, pp. 1096–106, DOI:10.1002/chem.200801906, PMID 19117043.
- ^ Jackson ImmunoResearch, Cyanine Dyes (Cy2, Cy3, and Cy5), su jacksonimmuno.com. URL consultato il 31 ottobre 2008.
- ^ Cyandye, LLC, su cyandye.us. URL consultato il 14 settembre 2017 (archiviato dall'url originale il 3 ottobre 2018).
- ^ SETA BioMedicals
- ^ cyanines.eu, https://archive.today/20150126174359/http://www.cyanines.eu/life-science/products/iris-dyes (archiviato dall'url originale il 26 gennaio 2015).
- ^ FluoProbes488 comparison to FITC, Cyanine2
- ^ FluoProbes547H comparison in Confocal Microscopy
- ^ Fare TL, Coffey EM, Dai H, He YD, Kessler DA, Kilian KA, Koch JE, LeProust E, Marton MJ, Meyer MR, Stoughton RB, Tokiwa GY, Wang Y, Effects of atmospheric ozone on microarray data quality, in Analytical Chemistry, vol. 75, n. 17, Set 2003, pp. 4672–5, DOI:10.1021/ac034241b, PMID 14632079.
- ^ Unlü M, Morgan ME, Minden JS, Difference gel electrophoresis: a single gel method for detecting changes in protein extracts, in Electrophoresis, vol. 18, n. 11, Ott 1997, pp. 2071–7, DOI:10.1002/elps.1150181133, PMID 9420172.
- ^ Osterman IA, Ustinov AV, Evdokimov DV, Korshun VA, Sergiev PV, Serebryakova MV, Demina IA, Galyamina MA, Govorun VM, Dontsova OA, A nascent proteome study combining click chemistry with 2DE (PDF), in Proteomics, vol. 13, n. 1, Gen 2013, pp. 17–21, DOI:10.1002/pmic.201200393, PMID 23161590. URL consultato il 14 settembre 2017 (archiviato dall'url originale il 30 giugno 2015).
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Cianina
Wikimedia Commons contiene immagini o altri file su Cianina
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) cyanine dye, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | J9U (EN, HE) 987009349860405171 · NDL (EN, JA) 00570869 |
|---|