Discussione:Fosfato
| ...da fare in Fosfato
aggiorna cache · modifica Annota in questo spazio le cose da fare per migliorare la voce o segui i suggerimenti già indicati. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Untitled[modifica wikitesto]Da integrare nella da un redirect risolto tagliando la testa al toro. (alcuni dati vanno in acito fosforico )--BW Insultami 10:07, 6 nov 2007 (CET) {{nota disambigua|il gruppo funzionale|[[Gruppo fosfato]]}}
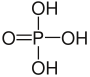
L'anione Fosfato deriva dalla dissociazione dell'acido fosforico, o acido orto-fosforico, il più importante degli acidi del fosforo. L'acido fosforico è un acido triprotico, ovvero possiede tre atomi di idrogeno acidi che possono essere sostituiti da altri atomi nei suoi sali, che vengono quindi classificati come diidrogenofosfati, idrogenofosfati o fosfati in funzione del numero di ioni idrogeno residui. A temperatura ambiente è un solido che si presenta in forma di cristalli incolori; tuttavia è difficile ottenerlo puro; viene pertanto commercializzato in forma di soluzione acquosa concentrata fino all'80%. Si scioglie abbastanza bene anche nell'etanolo. Viene prodotto per azione di un acido forte (ad esempio acido solforico, acido nitrico o acido cloridrico) su rocce e minerali fosfatici, principalmente l'apatite Ca5(PO4)3[F, OH, Cl]; oppure per reazione diretta tra fosforo bianco e ossigeno a dare anidride fosforica P2O5, la quale viene successivamente idratata ad acido metafosforico, acido pirofosforico e acido ortofosforico, in ordine di idratazione crescente. La maggior parte dell'acido fosforico prodotto è destinato alla produzione di fertilizzanti fosfatici; è inoltre una materia prima per la produzione di detergenti e composti antiruggine. Protegge il ferro e lo zinco dalla corrosione attraverso un processo di passivazione. Trova infine impiego come additivo nell'industria alimentare, in special modo nelle bevande gassate (soprattutto la cola); il suo codice identificativo secondo le norme dell'Unione europea è E 338. A livello analitico, la ricerca dell'acido fosforico e dei fosfati in ambiente acquoso si basa sulla loro reazione con l' eptamolibdato d'ammonio tetraidrato in ambiente riducente, che dà origine al complesso blu di molibdeno dall'intenso e tipico colore blu, e sulla capacità di formare con l'ammoniaca e con ioni magnesio un fosfato misto MgNH4PO4 bianco insolubile, che precipita. Possiamo anche ricercare i fosfati in ambiente acido: si aggiunge acido nitrico alla soluzione contenente fosfati e si agita con una bacchetta a bagnomaria a circa ottanta gradi. Ad ottanta gradi infattti l'acido nitrico si libera in soluzione ioni ammonio indispensabili alla reazione coll'eptamolibdato di ammonio idrato, che reagisce con il fosfato in soluzione, andando a formare del fosfomolibdato di ammonio, un precipitato di colore giallo che precipita secondo la reazione: H2PO4 - + 22H+ + 12MoO4- + 3NH4+ → (NH4)3PO4 • 12MoO3↓ + 12 H2O.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Da fare[modifica wikitesto]
Più che un redirect era un copia-incolla. Quali sarebbero i dati che vanno in acido fosforico? --$whiles: talk 15:34, 6 nov 2007 (CET)
- Da "la maggior parte dell'acido fosforico prodotto" in giù, quasi tutto. più le concentrazioni, ma sarebbero da controllare. --BW Insultami 17:33, 8 nov 2007 (CET)
- Quella era la vecchia pagina, basata da un copia-incolla da acido fosforico... l'ho riscritta basandomi sulle informazioni di en.wikipedia, non so se intendi questo --$whiles: talk 20:33, 9 nov 2007 (CET)
i fosfati sono solubili in acqua[modifica wikitesto]
I fosfati sono solubili in acqua? Non mi sembra affatto corretta questa affermazione. Nei libri di testo ad es:(Kotz, Nivaldo J Tro) i fosfati sono riportati proprio come insolubili, ad eccezione dei fosfati contententi metalli alcalini e lo ione ammonio.
Collegamenti esterni modificati[modifica wikitesto]
Gentili utenti,
ho appena modificato 1 collegamento/i esterno/i sulla pagina Fosfato. Per cortesia controllate la mia modifica. Se avete qualche domanda o se fosse necessario far sì che il bot ignori i link o l'intera pagina, date un'occhiata a queste FAQ. Ho effettuato le seguenti modifiche:
- Aggiunta del link all'archivio https://web.archive.org/web/20140223010153/http://itisravenna.dyndns.org/corso/chim/qualitativa/ricerca_anioni.htm per http://itisravenna.dyndns.org/corso/chim/qualitativa/ricerca_anioni.htm
Fate riferimento alle FAQ per informazioni su come correggere gli errori del bot
Saluti.—InternetArchiveBot (Segnala un errore) 03:56, 6 mar 2018 (CET)