Colesterolemia: differenze tra le versioni
Trasferimenti da Colesterolo |
Trasferimento da Colesterolo |
||
| Riga 88: | Riga 88: | ||
<!--Il grafico accanto illustra le componenti.--> |
<!--Il grafico accanto illustra le componenti.--> |
||
== I possibili pericoli per la salute della bassa colesterolemia == |
|||
Nonostante l'enorme mole di dati a favore dell'importanza della elevata colesterolemia come fattore di rischio cardiovascolare, numerose pubblicazioni sottolineano il pericolo di una bassa colesterolemia totale o contestano l'importanza che viene assegnata al colesterolo come fattore di rischio CV.<ref>{{cita web|url=http://www.thincs.org/news.htm|titolo=The International Network of Cholesterol Skeptics" - News|accesso=25 novembre 2008|lingua=en}}</ref><ref>{{Cita pubblicazione|autore=U. Ravnskov|anno=2016|titolo=Lack of an association or an inverse association between low-density-lipoprotein cholesterol and mortality in the elderly: a systematic review|rivista=BMJ|numero=e010401|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4908872/}}</ref><ref>{{Cita pubblicazione|autore=J.M. Bae|anno=2012|titolo=Low cholesterol is associated with mortality from cardiovascular diseases: a dynamic cohort study in Korean adults|rivista=J. Korean Med. Sci.|volume=27|pp=58-63|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3247776/}}</ref><ref name=":8">{{Cita pubblicazione|autore=H. Petursson|anno=2012|titolo=Is the use of cholesterol in mortality risk algorithms in clinical guidelines valid? Ten years prospective data from the Norwegian HUNT 2 study|rivista=J. Eval. Clin. Pract.|volume=18|pp=159-168|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3303886/}}</ref> Immich<ref>{{cita pubblicazione|autore=H. Immich|anno=1997|titolo=Cholesterin und Koronarsklerose|rivista=Versicherungsmedizin|volume=49|p=86 ss|lingua=de}}</ref> si è dedicato allo studio di ''Framingham'' e ha notato, nel [[1997]], che questo studio parlava già negli [[anni 1960|anni sessanta]] di ''nessuna correlazione statisticamente significativa tra colesterolemia totale e sclerosi coronaria''. Si è però evidenziato nei paragrafi precedenti come il rischio CV sia correlato soprattutto con le LDL e con il rapporto LDL/HDL. |
|||
Ricordando che gli studi epidemiologici non hanno il potere di dimostrare un rapporto di causa-effetto tra gli elementi osservati, possiamo, a titolo di esempio, prendere in considerazione lo studio ''Norvegian HUNT2'', che si è posto l'obiettivo di valutare la validità delle attuali linee guida sulla prevenzione cardiovascolare attraverso l'esame delle relazioni tra colesterolemia totale e mortalità totale, CV e coronarica, nella popolazione norvegese, arruolando oltre 52.000 individui di entrambi i sessi, di età compresa fra i 20 e 74 anni ed esente da malattie CV.<ref name=":8" /> Dallo studio del 2012, è emerso che fra i maschi la mortalità totale e quella CV sono maggiori sia nei soggetti con più alta colesterolemia totale che in quelli con i valori più bassi (cosiddetta, [[correlazione (statistica)|correlazione ad U]]). Nel gruppo femminile vi è una relazione inversa tra livelli di colesterolo totale e mortalità totale e CV e una relazione ad U per la mortalità coronarica: questi dati contraddicono l'assunto di una correlazione positiva tra colesterolemia totale e mortalità CV, finora assunta. Tuttavia, per l'interpretazione dei dati, devono essere tenute in considerazione le caratteristiche individuali e sociali del campione: lo studio ''Norvegian HUNT2'' prende in esame una popolazione etnicamente omogenea, considera unicamente il colesterolo totale, include un numero importante di soggetti di età <35 anni (quindi a basso rischio di mortalità) e non ha valutato l'eventuale uso di terapie preventive (es. antidislipidemici). In conclusione, gli autori ritengono che l'importanza attribuita alla colesterolemia totale possa essere sovrastimata e che sia più opportuno che le linee guida prendano in considerazione solo la mortalità coronarica e che il colesterolo totale venga sostituito con altre frazioni lipoproteiche o con il rapporto colesterolo totale/HDL, peraltro parametri già in uso |
|||
Nella metanalisi di Jacobs ([[1992]]),<ref name=":7">{{Cita pubblicazione|autore=D. Jacobs|anno=1992|titolo=Report of the Conference on Low Blood Cholesterol: Mortality Associations|rivista=Circulation|volume=86|pp=1046-1060|url=http://circ.ahajournals.org/content/86/3/1046.long}}</ref> gli uomini e, in minor misura le donne, con concentrazioni sieriche di colesterolo totale <4,2 mmol/l (<160 mg/dL) o >6,2 mmol/l (>240 mg/dl) mostravano un aumento della mortalità totale di circa il 14%-20% rispetto ai soggetti con valori compresi tra 4,2 e 5,2 mmol/L (160–199 mg/dL) (correlazione a U). Nella stessa metanalisi, il rischio di mortalità CV negli uomini, rispetto alla classe di riferimento 160-199 mg/dl (pari a un rischio = 1), era di 1,5 per la classe >240 mg/dl e 1,04 per la classi <160 mg/dl (correlazione a J); nel sesso femminile il rischio di morte CV non variava entro l'intero range di valori di colesterolo totale considerati. La più recente metanalisi del ''Prospective Studies Collaboration'' (2007), che ha preso in esame 61 studi prospettici osservazionali (circa 900.000 individui), ha confermato una debole associazione a J per la mortalità CV (escluso infarto e stroke) tra i 40 e i 70 anni (ma non oltre gli 80 anni) e ha registrato l'associazione inversa tra livelli di colesterolo totale e mortalità non-CV.<ref>{{Cita pubblicazione|autore=Prospective Studies Collaboration|anno=2007|titolo=Blood cholesterol and vascular mortality by age, sex, and blood pressure: a meta-analysis of individual data from 61 prospective studies with 55,000 vascular deaths|rivista=Lancet|volume=370|numero=|pp=1829-1839|url=http://www.thelancet.com/pdfs/journals/lancet/PIIS0140-6736(07)61778-4.pdf}}</ref> Tale relazione negativa si presentava più debole se venivano esclusi dall'analisi i primi 5 anni degli studi, come, del resto, risulta anche da numerosi lavori clinici sulla correlazione tra cancro e bassa colesterolemia.<ref>{{Cita pubblicazione|autore=J. Ahn|anno=2009|titolo=Prediagnostic total and high-density lipoprotein cholesterol and risk of cancer|rivista=Cancer Epidemiol. Biomarkers Prev|volume=18|numero=|pp=2814-2821|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3534759/}}</ref><ref>{{Cita pubblicazione|autore=M. Eichholzer|anno=2000|titolo=Association of low plasma cholesterol with mortality for cancer at various sites in men: 17-y follow-up of the prospective Basel study|rivista=Am. J. Clin. Nutr|volume=71|numero=|pp=569-574|url=http://ajcn.nutrition.org/content/71/2/569.full}}</ref> In questi ultimi il rapporto negativo tra bassi valori di colesterolo e cancro è evidente soprattutto nei primi anni, per poi indebolirsi o scomparire: la spiegazione (ipotetica) spesso avanzata è che la bassa colesterolemia possa sottendere un cancro subclinico che si manifesterebbe appunto nei primi anni degli studi, anche se non si può escludere l'intervento di altri fattori confondenti. |
|||
Sebbene il problema sia reale e ancora irrisolto, l'eccesso di mortalità totale e di motalità per cancro potrebbe essere parzialmente spiegato dalla preesistenza, al basale, di malattie subcliniche e dalla coesistenza di altri fattori aggressivi sconosciuti o non misurati, correlati sia alla bassa colesterolemia che alla mortalità.<ref>{{Cita pubblicazione|autore=J. Ahn|anno=2009|titolo=Prediagnostic total and high-density lipoprotein cholesterol and risk of cancer|rivista=Cancer Epidemiol. Biomarkers Prev.|volume=18|pp=2814-2821|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3534759/}}</ref><ref>{{Cita pubblicazione|autore=A.M. Tonkin|anno=2009|titolo=The evidence on trial: cholesterol lowering and cancer|rivista=Heart Asia|volume=1|pp=:6-10|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4898325/}}</ref><ref>{{Cita pubblicazione|autore=Y. Takata|anno=2014|titolo=Serum total cholesterol concentration and 10-year mortality in an 85-year-old population|rivista=Clin Interv Aging|volume=9|pp=293-300|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3928456/}}</ref> Ad esempio, nello studio prospettico ''Honolulu Heart Program'', condotto su circa 8000 uomini di ascendenza giapponese, residenti a [[Oahu]] ([[Hawaii]]), nel ''follow-up'' a 16 anni, nei soggetti in cui la colesterolemia si era ridotta dai livelli medi a quelli bassi, vi era un aumento della mortalità totale e un maggior numero di morti per alcuni tipi di cancro e per malattie epatiche, mentre nei soggetti che avevano mantenuto una bassa colesterolemia stabile, tale eccesso di mortalità non era riscontrabile; dopo 23 anni di ''follow-up'', negli individui con colesterolo totale <180 mg/dl, in assenza di elevato consumo di alcool, di fumo e di ipertensione la bassa colesterolemia non era associata né alla mortalità totale né a quella per cancro. |
|||
Se esistono dubbi sul "pericolo" di una bassa colesterolemia "naturale", diverso è il discorso della bassa colesterolemia ottenuta con il trattamento terapeutico: i più recenti studi con le statine hanno dimostrato che, in soggetti ad alto rischio cardiovascolare, valori anche molto bassi di LDL (70–80 mg/dl) si accompagnano a riduzione degli eventi cardiovascolari, senza che la mortalità totale aumenti oppure, come nel caso dello studio HPS, facendo registrare una sua diminuzione.<ref>{{Cita pubblicazione|autore=H. Soran|anno=2017|titolo=Evidence-based goals in LDL-C reduction|rivista=Clin. Res. Cardiol..|volume=106|pp=237–248|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5360845/}}</ref><ref>{{Cita pubblicazione|autore=Heart Protection Study Collaborative Group|anno=2011|titolo=Effects on 11-year mortality and morbidity of lowering LDL cholesterol with simvastatin for about 5 years in 20,536 high-risk individuals: a randomised controlled trial|rivista=Lancet|volume=378|pp=2013-2020|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3242163/}}</ref><ref>{{Cita pubblicazione|autore=K.R. Solomon|anno=2011|titolo=The complex interplay between cholesterol and prostate malignancy|rivista=Urol. Clin. North. Am.|volume=38|pp=243-259|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3146741/}}</ref>Resta da chiarire se questi risultati dipendano dalla sola riduzione della colesterolemia o invece dall'azione pleiotropica delle statine o dall'insieme dei due fattori (vedi [[ipercolesterolemia]]). |
|||
== Note == |
== Note == |
||
Versione delle 15:54, 21 ott 2017
Per colesterolemia si intende la concentrazione del colesterolo nel plasma. Poiché il colesterolo, a causa della sua insolubilità in acqua, circola esclusivamente incorporato nelle lipoproteine plasmatiche, la colesterolemia viene distinta in colesterolemia totale (TC), LDL, non-HDL (colesterolo totale - HDL) e HDL. Livelli elevati dei primi tre parametri sono considerati dannosi per la salute, mentre alla colesterolemia HDL è attribuito un ruolo protettivo. Il colesterolo non-HDL include VLDL, lDL e LDL; in generale i livelli plasmatici del colesterolo non-HDL corrispondono al valore delle LDL + 30 mg/dl.[1]
Valori di riferimento
I valori di riferimento per i parametri medici vengono normalmente rilevati da un campione di persone sane. Del parametro rilevato si determinano media aritmetica semplice m e la deviazione standard , una misura per la dispersione dei singoli valori. Il valore di riferimento è di solito
m±2 che include circa il 97% della popolazione sana.
Esempio: per l'intera popolazione tedesca è m=210, =30; perciò l'intervallo di valori normali sarà 210 +/- 60 = da 150 a 270 mg/dl. Poiché questi valori "normali" sono eccessivamente alti, per la determinazione dei livelli ottimali di colesterolemia nella Consensus Conference del 1984 e nelle successive linee guida ATP (National Cholesterol Education Program Adult Treatment Panel) si è preferito seguire il criterio del rischio di CHD, per cui sono considerati elevati quei valori per i quali il rischio coronarico è elevato. Il Pschyrembel, la "bibbia" dei medici tedeschi, dà un valore di riferimento colesterolemico da 115 a 220 mg/dl.[2]
Su raccomandazioni dell'organizzazione mondiale della sanità (OMS), i valori consigliati di colesterolemia nella popolazione generale sono:[3] [4]
- colesterolemia totale inferiore a 200 mg/dl (limiti più restrittivi sono suggeriti dalle linee guida della Società Europea di Cardiologia per i soggetti con più fattori di rischio)[5]
Numerosi studi epidemiologici (MRFIT, CARDIA, CHH, Progetto CUORE) hanno, infatti, dimostrato che, nella popolazione generale, la più bassa mortalità totale e cardiovascolare si registra negli individui con colesterole totale < 200 mg/dl, pressione arteriosa < 120/80, indice di massa corporea (BMI) < 25 Kg/m2, non fumatori e non diabetici.[6]
Fondamentale è anche la suddivisione tra frazione di colesterolo LDL e HDL: tanto più il rapporto è favorevole alla prima, tanto più alto è il rischio di malattie cardiovascolari. Il rapporto ottimale colesterolo totale/HDL è non superiore a 5 per gli uomini e a 4,5 per le donne. Questo fatto è ben documentato da studi epidemiologici recenti, che non focalizzandosi solo su uno dei due tipi di colesterolo, guardano alla loro percentuale relativa e al colesterolo LDL totale. L'unione dei due parametri consente una buona predittività dei rischi di malattie cardiovascolari.[7]
Influenza di età, sesso e area geografica


I diversi parametri lipidici variano in base a età, sesso, etnia e area geografica.[8] La colesterolemia totale aumenta in entrambi i sessi dalla nascita fino alla tarda infanzia, quindi subisce una modica riduzione durante l'adolescenza, per poi tornare a crescere nell'età adulta, fino a raggiungere un plateau dopo gli anni 50-55, seguito da una modesta diminuzione. I valori di colesterolemia sono superiori nell'uomo dai 20-25 anni fino a 50-55, prima e dopo prevalgono quelli delle donne. Le LDL mostrano un incremento continuo, mentre le HDL subiscono poche variazioni con l'età.[9][10][11]
Numerosi studi hanno dimostrato che le differenze nei livelli medi di colesterolemia tra le varie nazioni dipendono in larga misura dalla dieta,[12][13][14] dal momento che i migranti tendono ad assumere la stessa colesterolemia media del paese ospitante.[15][16] Non vanno, comunque, ignorate le possibili differenze genetiche tra le diverse popolazioni, come nel caso dei popoli scandinavi nei quali è prevalente l'apolipoproteina E4, che comporta una colesterolemia più elevata, o degli Africani nei quali si registra una maggiore prevalenza delle mutazioni del gene PCSK9 (proprotein convertase subtilisin kexin 9).[17][18]
Colesterolemia e alimentazione
Contrariamente a quanto si pensa, non è tanto il colesterolo introdotto con l'alimentazione ad aumentare la colesterolemia, quanto piuttosto il consumo di alcuni acidi grassi saturi (SFA), contenuti negli alimenti, anche se non tutti i grassi saturi agiscono nello stesso modo. I grassi saturi C12:0-C16:0, in particolar modo l'acido miristico (C14:0), aumentano il livello di LDL, mentre i trans-saturi inibiscono l'assorbimento degli omega-3, i quali aumentano le HDL.[7] Al contrario, gli acidi grassi monoinsaturi (MUFA) e polinsaturi (PUFA) abbassano i livelli plasmatici di LDL. A questo proposito le raccomandazioni dell'American Heart Association Nutrition Committee prevedono di limitare l'introito giornaliero di colesterolo a <300 mg, quello di SFA a <7% del totale calorico, con gli acidi grassi trans-insaturi (TFA) a <1% delle calorie totali.[19] Le raccomandazioni (2010) della FAO/WHO (Food and Agriculture Organization/World Health Organization) includono: consumo di grassi totali pari al 20-35% dell'apporto calorico giornaliero, SFA < 10%, PUFA totali 6-11%, n-6 PUFA 2,5-9%, n-3 PUFA 0,5-2%, TFA < 1%.
Colesterolo alimentare. Gli effetti del colesterolo della dieta sulla colesterolemia sono complessi, per il fatto che la relazione tra questi due parametri è influenzata da numerosi fattori: composizione della dieta (contenuto in acidi grassi totali, SFA, MUFA e PUFA; fibre; fito- e sitosteroli; ecc.), consumo abituale medio di colesterolo (nei bassi consumatori l’assorbimento è maggiore), variazioni individuali nella capacità di assorbimento intestinale (iper- e ipo-assorbenti) e nella sensibilità della regolazione della sintesi endogena di colesterolo (iper- verso ipo-responders). Si spiega così il fatto che alcuni popoli che si nutrono prevalentemente di prodotti animali come gli Inuit delle regioni polari o i Masai delle steppe africane hanno delle colesterolemie minori di europei o statunitensi. Nel 15-25% della popolazione la soppressione della sintesi endogena è particolarmente marcata (soggetti iper-rispondenti) e la colesterolemia non aumenta con l'aumentare del consumo di colesterolo alimentare. Particolarmente iper-rispondente si è rivelata la popolazione dei Masai: la colesterolemia e la prevalenza dell’aterosclerosi sono basse nonostante che l'apporto di colesterolo possa raggiungere i 2000 mg /die per l’elevato consumo di prodotti derivati dagli zebù.[20]
Il Ministero della Salute tedesco, tra il 1987 e il 1988, ha condotto uno studio epidemiologico di tipo osservazionale (studio di popolazione), il Verbundstudie Ernahrungserhebung und Risikofaktoren-Analytic (VERA) o Nutrition Survey and Risk Factor Analysis Study, che ha preso in esame le abitudini nutrizionali e ha effettuato rilevazioni antropometriche ed ematochimiche. Lo studio VERA (1993), che ha riguardato circa 2000 individui adulti, non ha rilevato alcuna correlazione tra contenuto abituale di colesterolo nella dieta (latte, panna, uova, burro, grassi animali ecc.) e colesterolemia.[21]

Indipendentemente da queste considerazioni preliminari basate sugli studi epidemiologici, gli studi sperimentali in volontari, durante i quali è stata somministrata una quantità certa di colesterolo e sono stati misurati i livelli di colesterolemia, hanno registrato, almeno sino a 1000 md/die di colesterolo,[22] una relazione direttamente proporzionale tra colesterolo della dieta e colesterolemia.[23] Tuttavia, grazie ai meccanismi omeostatici che regolano l’assorbimento e la sintesi del colesterolo, secondo una metanalisi del 2001,[24] la colesterolemia totale aumenta in media soltanto di circa 2,2 mg/100ml per ogni incremento di 100 mg/die di colesterolo dietetico, sebbene anche in questo caso le oscillazioni siano marcate,[20] il colesterolo LDL aumenta di 1,93/100 ml e quello HDL di 0,3 mg/100 ml e il rapporto colesterolemia totale/HDL aumenta di 0,02. Un incremento della colesterolemia di queste proporzioni è relativamente modesto, se si considera che la colesterolemia totale normale oscilla intorno ai 200 mg/100 ml, ma non per questo è da ritenersi irrilevante: dai dati epidemiologici (sia pure con tutti i loro limiti) risulta che 1 mg/100ml di aumento della colesterolemia totale innalza il rischio cardio-vascolare di circa l’1%.
Una metanalisi del 1992 mette in evidenza come l'innalzamento della colesterolemia in risposta ai più elevati contenuti di colesterolo dietetico (>1000 mg/die) segua un andamento curvilineare, nel senso che la variazione della colesterolemia è progressivamente più contenuta.[25]
Sulla base di queste evidenze il Dietary Guidelines Advisory Committee del 2015 afferma che non esistono apprezzabili relazioni tra consumo di colesterolo dietetico e colesterolemia,[26] mentre le linee guida Dietary Guidelines for Americans 2015-2020 consigliano il più basso consumo possibile di colesterolo.[27]

Grassi alimentari. Dagli studi sperimentali è emerso che la percentuale di calorie giornaliere assunte in forma di SFA è strettamente correlata con l'aumento della colesterolemia: sono state elaborate alcune equazioni (es. Keys, Hegsted) che permettono di calcolare le variazioni della colesterolemia in funzione del contenuto di SFA e PUFA della dieta.[28]
L'OMS, nel suo Food and health in Europe: a new basis for action[29] del 2004, sintetizza i risultati degli studi su colesterolo e alimentazione: gli SFA influiscono, anche se in maniera diversa, sul livello del colesterolo, aumentando le LDL e in minor misura le HDL.[30] Nel dettaglio:
- l'acido miristico (C14:0), contenuto nel latte vaccino intero (non scremato), è il più forte stimolatore della produzione di LDL
- l'acido laurico, (C12:0), contenuto negli olii e grassi di piante tropicali e nel latte in piccole quantità, l'acido palmitico (C16:0), contenuto nei grassi animali (carne, pesce e molluschi) e in oli e grassi da piante tropicali, e alcuni acidi trans-insaturi (C18:1n-9) sono forti stimolatori della produzione di LDL[31]
- l'acido stearico (C18:0), contenuto nel grasso di manzo e nel lardo di suino, non aumenta il colesterolo LDL[32]
L'aumento della concentrazione delle LDL indotto da questi SFA è dipendente sia da una maggiore produzione epatica di lipoproteine, sia dalla downregulation dei recettori LDL.[28]
Gli acidi trans-insaturi (TFA) aumentano le LDL, sono senza effetto sulle HDL e riducono l'apporto di acidi grassi polinsaturi, soprattutto di omega-3. Tali grassi (principalmente l'acido elaidico C18:1n-9, derivato dall'acido linoleico) sono generati soprattutto nell'idrogenazione dei grassi insaturi, processo utilizzato per la produzione di margarine industriali a partire da oli vegetali. Gli acidi polinsaturi (PUFA) e quelli monoinsaturi (MUFA) abbassano i livelli delle LDL e innalzano modestamente quelli delle HDL. In particolare l'effetto sulle HDL è tale che SFA > MUFA > PUFA.[28] I PUFA riducono il rapporto LDL/HDL, mentre i MUFA hanno effetto ridotto o non hanno effetto.[33] È dunque la qualità dei grassi, e non il loro apporto totale, a determinare il rapporto LDL/HDL. Tuttavia anche un eccesso di PUFA può essere dannoso, in quanto i doppio legami sono altamente reattivi e, quando esposti all'aria e al calore, combinandosi con l'ossigeno, possono formare perossidi.
Colesterolemia e stress
Esiste un teoria secondo la quale fattori psicologici, e in particolare lo stress emotivo, influenzerebbero la colesterolemia. I suoi sostenitori affermano che ne sarebbe responsabile l'aumento di ormoni e neuroormoni come adrenalina, noradrenalina e cortisolo. In particolare è stato sottolineato come il cortisolo, promuovendo la lipolisi, inibisca l'elaborazione di LDL da parte del fegato (il che fa aumentare la colesterolemia e peggiora la relazione LDL/HDL)[34].
Colesterolemia e rischio cardio-vascolare
Sono stati i grandi studi osservazionali prospettici (vedi paragrafo sottostante) a documentare la relazione positiva, di tipo esponenziale, esistente tra colesterolemia e mortalità cardiovascolare, mentre hanno evidenziato una correlazione ad U (o a J) tra mortalità totale e colesterolemia (cioè la mortalità totale aumenta sia per i valori più bassi di colesterolemia totale, sia per quelli più alti).[35][36] L'associazione tra colesterolemia ed eventi ischemici è particolarmente stretta per la cardiopatia ischemica (CAD o coronary atherosclerotic disease); si mantiene positiva per lo stroke (ictus) ischemico dovuto ad aterosclerosi delle grandi arterie, mentre è più debole o assente per lo stroke ischemico lacunare (stroke delle piccole arterie) e per quello embolico. La correlazione è inversa per lo stroke emorragico: la bassa colesterolemia è un fattore di rischio per lo stroke emorragico.[37]

Gli studi epidemiologici non consentono di trarre conclusioni certe sui rapporti causa-effetto tra i fenomeni esaminati, tuttavia le correlazioni statistiche individuate suggeriscono che:
- valori elevati di colesterolemia sono correlati con l'aumento della mortalità dovuta ad alcune malattie, in particolare quelle cardiovascolari su base aterosclerotica (prevalentemente infarto del miocardio e ictus ischemico)
- la mortalità CV cresce costantemente all'aumentare dei livelli di colesterolemia, senza che possa essere identificato un valore soglia
- la colesterolemia corrispondente alla minima mortalità CV è più alta nelle donne (200-240mg/dl) che negli uomini (160–200 mg/dl)
- valori ridotti di colesterolemia, sotto una certa soglia, sono correlati con una più elevata mortalità per cause accidentali (es. suicidi) e per altre malattie (es. cancro polmonare, ictus emorragico); come detto sopra la natura di tale relazione è fortemente discussa (vedi il paragrafo 'I possibili pericoli per la salute della bassa colesterolemia')
Ulteriori domande che attendono risposta definitiva sono:
- la colesterolemia può concorrere allo sviluppo di altre malattie, oltre a quelle cardiovascolari su base ischemica?
- per quali motivi (oltre al ruolo protettivo degli estrogeni) nelle donne il rischio coronarico è correlato con valori di colesterolemia totale più alti che negli uomini?
Sono stati condotti anche alcuni studi epidemiologici di carattere autoptico (Stary e McGill), dai quali è emersa una correlazione positiva tra colesterolemia e gravità ed estensione delle lesioni aterosclerotiche avanzate (tale correlazione non esiste per le strie lipidiche; vedi voce Aterosclerosi).
Sulla base dei soli studi epidemiologici osservazionali non è possibile trarre la conclusione che "basta abbassare la colesterolemia per ridurre il rischio di infarto cardiaco". Una tesi del genere non può in nessun caso essere sostenuta da uno studio epidemiologico osservazionale. Il fatto che da questo tipo di studi risulti che una colesterolemia bassa sia associata a una bassa mortalità coronarica non comporta automaticamente che abbassando una colesterolemia alta si riduca la mortalità.
Per poter giungere a una simile conclusione sono stati necessari studi di intervento terapeutico, randomizzati, in doppio cieco e placebo-controllati (RTC o randomized clinical trials), che hanno valutato come obiettivo finale principale (endpoint primario) l'effetto a lungo termine di una terapia (farmacologica o di altro tipo) sulla mortalità totale e cardiovascolare e sui singoli eventi cardiovascolari, fatali e non. Da una metanalisi di trials randomizzati, in doppio cieco, di durata di almeno 2 anni e con almeno 1000 partecipanti è risultato che, nei circa 170.000 soggetti esaminati nei 26 studi considerati, per ogni mmol di riduzione di colesterolo LDL si ottiene una diminuzione di circa il 20% di eventi, fatali e non, di cardiopatia ischemica, rivascolarizzazione coronarica e ictus ischemico, mentre la mortalità totale si riduce del 10%; nessun effetto si osserva, neanche a concentrazioni molto basse di LDL, sulla mortalità per cancro o per cause non vascolari.[38]
Il rischio di cardiopatia ischemica

Nonostante la stretta correlazione tra colesterolemia totale e mortalità per CHD emersa dagli studi longitudinali, i soli valori di colesterolo totale, a livello individuale, non rappresentano un indice sufficiente per individuare i soggetti a rischio di malattia coronarica, per il fatto che si tratta di una patologia dovuta al concorso di molteplici fattori eziopatogenetici, nessuno dei quali preso singolarmente ha un valore predittivo soddisfacente. Infatti, dallo studio di Framingham è emerso che le curve di distribuzione della colesterolemia, rispettivamente per gli uomini che sviluppano coronaropatia nel corso dei primi 16 anni dello studio e per quelli che ne rimangono esenti, mostrano una notevole sovrapposizione nell'ambito dei livelli di colesterolo totale compresi tra 150 e 300 mg/dl. Inoltre, circa la metà degli eventi coronarici si sono manifestati nei soggetti con colesterolemia < 240 mg/dl: soltanto il 41% degli eventi CHD negli uomini e il 61% nelle donne di età 35-64 erano associati a valori pari o superiori a 240 mg/dl.
Nel tentativo di individuare markers più sensibili per valutare il rischio CHD, l'attenzione è stata rivolta allo studio dell'intero profilo lipidico. Durante l'undicesimo esame biennale del Framingham Study, in 1023 uomini e 1434 donne, liberi da CHD, sono state misurate le concentrazioni sieriche di LDL, HDL, colesterolo totale (CT) e trigliceridi. Considerato isolatamente, il livello delle HDL è il singolo parametro lipidico più specifico, mentre il rapporto tra colesterolo totale e HDL è risultato la variabile lipidica più specifica nell'individuare gli individui a rischio CHD, di quanto non lo fossero il colesterolo totale o le LDL. Il rischio CHD aumenta, per qualsiasi valore di colesterolemia, con il crescere del rapporto CT/HDL. Quando i livelli di colesterolo totale sono al di sotto di 240 mg/dl, il rischio varia ampiamente in dipendenza dei valori delle HDL sieriche. Comunque anche questo marker lipidico risulta insoddisfacente per la determinazione del rischio cardiovascolare e la sua valutazione deve tener conto dell'insieme dei fattori di rischio (rischio globale) presenti nel soggetto in esame.
Sulla base di queste considerazioni appare evidente che sono necessari markers più specifici che non la sola colesterolemia, per determinare il rischio di CHD, così da evitare, in base ai livelli di colesterolo, di allarmare inutilmente soggetti che siano apparentemente a rischio elevato di CHD (falsi positivi) o, al contrario, di rassicurare falsamente individui più a rischio (falsi negativi). La stesura di carte di rischio globale, che tengono conto di un numero maggiore di fattori di rischio, assicura una migliore sensibilità nella valutazione del rischio CHD (vedi valori ottimali di colesterolemia), mentre studi epidemiologici condotti negli ultimi decenni sono stati indirizzati verso la ricerca di nuovi markers.
Linee guida per la prevenzione cardiovascolare e il trattamento della colesterolemia
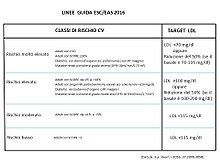

Tutte le esistenti linee guida per la prevenzione delle malattie cardiovascolari (CVD, cardiovascular diseases) prevedono la determinazione del rischio cardiovascolare (CV) individuale mediante l'utilizzo di apposite tabelle che prendono in considerazione diversi fattori di rischio CV (RF, risk factors).
Le maggiori linee guida europee sono quelle redatte dalla Società Europea di Cardiologia (ESC) e dalla Società Europea dell'Aterosclerosi (EAS). Le linee guida ESC/EAS del 2016 indicano, per ciascuna categoria di rischio CV, il target di colesterolo LDL cui deve tendere la terapia ipocolesterolemizzante (statine).[5] Il rischio CV è calcolato sulla base delle tabelle SCORE (Systemic Coronary Risk Estimation).[39] Le linee guida ESC/EAS introducono anche la nuova categoria di 'soggetti a rischio molto elevato'.

Le line guida americane del 2013, elaborate dall’American College of Cardiology (ACC) e dall’American Heart Association (AHA), presentano un’impostazione molto differente sia dalle linee guida ESC/EAS, sia dalle raccomandazioni dell’ATP III (National Cholesterol Education Program Adult Treatment Panel III) del 2002.[40] La differenza maggiore si riconosce nella mancata indicazione di un target di LDL. Basandosi sulla constatazione che gli studi RTC non hanno mai considerato, come endpoint, un valore target di LDL, ACC e AHA preferiscono indicare le categorie di individui per i quali è raccomandata una terapia ad alta, moderata o bassa intensità di statine. Le linee guida ACC/AHA si basano esclusivamente su studi clinici randomizzati e controllati datati dal 1995 in poi; al contrario, quelle ESC/EAS si basano sia sui RTC datati a partire dagli anni 60 sia sugli studi epidemiologici. Nelle linee guida ACC/AHA, per il calcolo del rischio CV individuale, viene preso in considerazione il New Pooled Cohort Equations Risk Calculator (PCERC).[41] Questo sistema differisce dallo SCORE soprattutto per il fatto di includere il diabete e di estendere la previsione a 10 anni agli eventi CV fatali e non, mentre lo SCORE da una parte considera il diabete estraneo alla prevenzione primaria, dall'altra limita la previsione agli eventi CV fatali.
Le linee guida NICE (National Institute for Health and Care Excellence) del Regno Unito utilizzano le tabelle del sistema QRISK2, basate sul database inglese.[42]
I possibili pericoli per la salute della bassa colesterolemia
Nonostante l'enorme mole di dati a favore dell'importanza della elevata colesterolemia come fattore di rischio cardiovascolare, numerose pubblicazioni sottolineano il pericolo di una bassa colesterolemia totale o contestano l'importanza che viene assegnata al colesterolo come fattore di rischio CV.[43][44][45][46] Immich[47] si è dedicato allo studio di Framingham e ha notato, nel 1997, che questo studio parlava già negli anni sessanta di nessuna correlazione statisticamente significativa tra colesterolemia totale e sclerosi coronaria. Si è però evidenziato nei paragrafi precedenti come il rischio CV sia correlato soprattutto con le LDL e con il rapporto LDL/HDL.
Ricordando che gli studi epidemiologici non hanno il potere di dimostrare un rapporto di causa-effetto tra gli elementi osservati, possiamo, a titolo di esempio, prendere in considerazione lo studio Norvegian HUNT2, che si è posto l'obiettivo di valutare la validità delle attuali linee guida sulla prevenzione cardiovascolare attraverso l'esame delle relazioni tra colesterolemia totale e mortalità totale, CV e coronarica, nella popolazione norvegese, arruolando oltre 52.000 individui di entrambi i sessi, di età compresa fra i 20 e 74 anni ed esente da malattie CV.[46] Dallo studio del 2012, è emerso che fra i maschi la mortalità totale e quella CV sono maggiori sia nei soggetti con più alta colesterolemia totale che in quelli con i valori più bassi (cosiddetta, correlazione ad U). Nel gruppo femminile vi è una relazione inversa tra livelli di colesterolo totale e mortalità totale e CV e una relazione ad U per la mortalità coronarica: questi dati contraddicono l'assunto di una correlazione positiva tra colesterolemia totale e mortalità CV, finora assunta. Tuttavia, per l'interpretazione dei dati, devono essere tenute in considerazione le caratteristiche individuali e sociali del campione: lo studio Norvegian HUNT2 prende in esame una popolazione etnicamente omogenea, considera unicamente il colesterolo totale, include un numero importante di soggetti di età <35 anni (quindi a basso rischio di mortalità) e non ha valutato l'eventuale uso di terapie preventive (es. antidislipidemici). In conclusione, gli autori ritengono che l'importanza attribuita alla colesterolemia totale possa essere sovrastimata e che sia più opportuno che le linee guida prendano in considerazione solo la mortalità coronarica e che il colesterolo totale venga sostituito con altre frazioni lipoproteiche o con il rapporto colesterolo totale/HDL, peraltro parametri già in uso
Nella metanalisi di Jacobs (1992),[35] gli uomini e, in minor misura le donne, con concentrazioni sieriche di colesterolo totale <4,2 mmol/l (<160 mg/dL) o >6,2 mmol/l (>240 mg/dl) mostravano un aumento della mortalità totale di circa il 14%-20% rispetto ai soggetti con valori compresi tra 4,2 e 5,2 mmol/L (160–199 mg/dL) (correlazione a U). Nella stessa metanalisi, il rischio di mortalità CV negli uomini, rispetto alla classe di riferimento 160-199 mg/dl (pari a un rischio = 1), era di 1,5 per la classe >240 mg/dl e 1,04 per la classi <160 mg/dl (correlazione a J); nel sesso femminile il rischio di morte CV non variava entro l'intero range di valori di colesterolo totale considerati. La più recente metanalisi del Prospective Studies Collaboration (2007), che ha preso in esame 61 studi prospettici osservazionali (circa 900.000 individui), ha confermato una debole associazione a J per la mortalità CV (escluso infarto e stroke) tra i 40 e i 70 anni (ma non oltre gli 80 anni) e ha registrato l'associazione inversa tra livelli di colesterolo totale e mortalità non-CV.[48] Tale relazione negativa si presentava più debole se venivano esclusi dall'analisi i primi 5 anni degli studi, come, del resto, risulta anche da numerosi lavori clinici sulla correlazione tra cancro e bassa colesterolemia.[49][50] In questi ultimi il rapporto negativo tra bassi valori di colesterolo e cancro è evidente soprattutto nei primi anni, per poi indebolirsi o scomparire: la spiegazione (ipotetica) spesso avanzata è che la bassa colesterolemia possa sottendere un cancro subclinico che si manifesterebbe appunto nei primi anni degli studi, anche se non si può escludere l'intervento di altri fattori confondenti.
Sebbene il problema sia reale e ancora irrisolto, l'eccesso di mortalità totale e di motalità per cancro potrebbe essere parzialmente spiegato dalla preesistenza, al basale, di malattie subcliniche e dalla coesistenza di altri fattori aggressivi sconosciuti o non misurati, correlati sia alla bassa colesterolemia che alla mortalità.[51][52][53] Ad esempio, nello studio prospettico Honolulu Heart Program, condotto su circa 8000 uomini di ascendenza giapponese, residenti a Oahu (Hawaii), nel follow-up a 16 anni, nei soggetti in cui la colesterolemia si era ridotta dai livelli medi a quelli bassi, vi era un aumento della mortalità totale e un maggior numero di morti per alcuni tipi di cancro e per malattie epatiche, mentre nei soggetti che avevano mantenuto una bassa colesterolemia stabile, tale eccesso di mortalità non era riscontrabile; dopo 23 anni di follow-up, negli individui con colesterolo totale <180 mg/dl, in assenza di elevato consumo di alcool, di fumo e di ipertensione la bassa colesterolemia non era associata né alla mortalità totale né a quella per cancro.
Se esistono dubbi sul "pericolo" di una bassa colesterolemia "naturale", diverso è il discorso della bassa colesterolemia ottenuta con il trattamento terapeutico: i più recenti studi con le statine hanno dimostrato che, in soggetti ad alto rischio cardiovascolare, valori anche molto bassi di LDL (70–80 mg/dl) si accompagnano a riduzione degli eventi cardiovascolari, senza che la mortalità totale aumenti oppure, come nel caso dello studio HPS, facendo registrare una sua diminuzione.[54][55][56]Resta da chiarire se questi risultati dipendano dalla sola riduzione della colesterolemia o invece dall'azione pleiotropica delle statine o dall'insieme dei due fattori (vedi ipercolesterolemia).
Note
- ^ Lee Goldman e Andrew I. Schafer, Goldman-Cecil Medicine, 25ª ed., Philadelphia, Elsevier-Saunders, 2016, p. 1395, ISBN 978-1-4557-5017-7.
- ^ Pschyrembel.
- ^ (EN) A. Robertson et al. (a cura di), Food and health in Europe: a new basis for action (PDF), WHO Regional Publications - European Series N° 96, WHO, 2004, pp. 25-27, ISBN 92-890-1363-X.
- ^ Lee Goldman e Andrew I. Schafer, Goldman-Cecil Medicine, 25ª ed., Philadelphia, Elsevier-Saunders, 2016, p. 2713, ISBN 978-1-4557-5017-7.
- ^ a b (EN) Alberico L. Catapano, Ian Graham, Guy De Backer, Olov Wiklund, M. John Chapman, Heinz Drexel, Arno W. Hoes, Catriona S. Jennings, Ulf Landmesser, Terje R. Pedersen, Željko Reiner, Gabriele Riccardi, Marja-Riita Taskinen, Lale Tokgozoglu, W. M. Monique Verschuren, Charalambos Vlachopoulos, David A. Wood, Jose Luis Zamorano, 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias, in European Heart Journal, 27 agosto 2016, DOI:10.1093/eurheartj/ehw272. URL consultato il 31 agosto 2016.
- ^ M.M. Gulizia, Colesterolo e rischio cardiovascolare: percorso diagnostico-terapeutico in Italia (PDF), in G. Ital. Cardiol., 17 (Suppl. 1), 2016, p. S6.
- ^ a b (EN) A. Robertson et al. (a cura di), Food and health in Europe: a new basis for action (PDF), WHO Regional Publications - European Series N° 96, WHO, 2004, pp. 25-27, ISBN 92-890-1363-X.
- ^ F. Farzadfar, National, regional, and global trends in serum total cholesterol since 1980: systematic analysis of health examination surveys and epidemiological studies with 321 country-years and 3.0 million participants, in Lancet, vol. 377, 2011, pp. 578–586.
- ^ The Lipid Research Clinics Program Epidemiology Committee, Plasma lipid distributions in selected North American populations: the Lipid Research Clinics Program Prevalence Study, in Circ, vol. 60, 1979, pp. 427-439.
- ^ G. Heiss, Lipoprotein-cholesterol distributions in selected North American populations: the lipid research clinics program prevalence study (PDF), in Circ., vol. 61, 1980, pp. 302-315.
- ^ W.P. Castelli, Cardiovascular risk factors in the elderly, in Am. J. Cardiol., vol. 63, 1989, pp. 12-19.
- ^ K.L. Khoo, Lipids and coronary heart disease in Asia, in Atherosclerosis, vol. 169, 2003, pp. 1-10.
- ^ X. Wan, Mortality trends for ischemic heart disease in China: an analysis of 102 continuous disease surveillance points from 1991 to 2009, in BMC Public Health, vol. 18, 2017, p. 52.
- ^ J.V. Patel, Impact of migration on coronary heart disease risk factors: comparison of Gujaratis in Britain and their contemporaries in villages of origin in India, in Atherosclerosis, vol. 185, 2006, pp. 297-306.
- ^ H. Kato, Epidemiologic studies of coronary heart disease and stroke in Japanese men living in Japan, Hawaii and California, in Am. J. Epidemiol, vol. 97, 1973, pp. 372–385.
- ^ J. Patel, Impact of migration on coronary heart disease risk factors: comparison of Gujeratis in Britain and their contempories in villages of origin in India, in Atherosclerosis, vol. 185, 2006, pp. 297–306.
- ^ D.M. Hallman, The apolipoprotein E polymorphism: a comparison of allele frequencies and effects in nine populations (PDF), in Am. J. Hum. Genet, vol. 49, 1991, pp. 338-349.
- ^ J. Cohen, Low LDL cholesterol in individuals of African descent resulting from frequent nonsense mutations in PCSK9, in Nat. Genet, vol. 37, 2005, pp. 161–165.
- ^ A.H. Lichtenstein, Diet and lifestyle recommendations revision 2006: a scientific statement from the American Heart Association Nutrition Committee, in Circulation, vol. 114, 2006, pp. 82–96.
- ^ a b K.M. Kostner, Understanding Cholesterol Synthesis and Absorption Is the Key to Achieving Cholesterol Targets (PDF), in Asia Pacific Cardiol, vol. 1, 2007, pp. 7-10.
- ^ (DE) M. Kohlmeier et al., Verbreitung von klinisch-chemischen Risikofaktoren, Niederkleen, VERA-Schriftenreihe Band VII, 1993.
- ^ J.D. Griffin, Dietary cholesterol and plasma lipoprotein profiles: randomized-controlled trials, in Curr. Nutr. Rep., vol. 2, 2013, pp. 274–282.
- ^ A.M. Freeman, Trending Cardiovascular Nutrition Controversies (PDF), in JACC, vol. 19, 2017, pp. 1172-1187.
- ^ R.M. Weggemans, Dietary cholesterol from eggs increases the ratio of total cholesterol to high-density lipoprotein cholesterol in humans: a meta-analysis, in Am. J. Clin. Nutr., vol. 73, 2001, pp. 885-891.
- ^ P.N. Hopkins, Effects of dietary cholesterol on serum cholesterol: a meta-analysis and review, in Am. J. Clin. Nutr., vol. 55, 1992, pp. 1060-1070.
- ^ Scientific Report of the 2015 Dietary Guidelines Advisory Committee https://health.gov/dietaryguidelines/2015-scientific-report/pdfs/scientific-report-of-the-2015-dietary-guidelines-advisory-committee.pdf
- ^ 2015–2020 Dietary Guidelines for Americans, su health.gov.
- ^ a b c M.H. Stipanuk, Biochemical and physiological aspects of human nutrition, Philadelphia, W.B. Saunders Company, 2000, pp. 927-933, ISBN 0-7216-4452-X.
- ^ (EN) A. Robertson et al. (a cura di), Food and health in Europe: a new basis for action (PDF), WHO Regional Publications - European Series N° 96, WHO, 2004, ISBN 92-890-1363-X.
- ^ A.M. Salter, Dietary fatty acids and cardiovascular disease, in Animal, 7:suppl.1, 2013, pp. 163–171.
- ^ (EN) Muller, H. et al., Serum cholesterol predictive equations with special emphasis on trans and saturated fatty acids: an analysis from designed controlled studies, in Lipids, n. 36, 2001, pp. 783–791.
- ^ (EN) YU, S. et al., Plasma cholesterol–predictive equations demonstrate that stearic acid is neutral and monounsaturated fatty acids are hypocholesterolemic, in American journal of clinical nutrition, n. 61, 1995, pp. 1129–1139.
- ^ (EN) A. Robertson et al. (a cura di), Food and health in Europe: a new basis for action (PDF), WHO Regional Publications - European Series N° 96, WHO, 2004, pp. 24-27, ISBN 92-890-1363-X.
- ^ (EN) Rosenman R.H., Psycological Influence on the Variability of Plasma Colesterol, in Homeostasis, n. 34, 1993, pp. 129 - 136.
- ^ a b D. Jacobs, Report of the Conference on Low Blood Cholesterol: Mortality Associations, in Circulation, vol. 86, 1992, pp. 1046-1060.
- ^ Y. Xilin, Independent associations between low-density lipoprotein cholesterol and cancer among patients with type 2 diabetes mellitus, in CMAJ., vol. 179, 2008, pp. 427–437.
- ^ S. Yaghi, Lipids and Cerebrovascular Disease: Research and Practice, in Stroke, vol. 46, 2015, pp. 3322–3328.
- ^ Cholesterol Treatment Trialists’ Collaboration, Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials, in Lancet, vol. 376, 2010, pp. 1670-1681.
- ^ R.M. Conroy, Estimation of ten-year risk of fatal cardiovascular disease in Europe: the SCORE project, in European Heart Journa, vol. 24, 2003, pp. 987-1003.
- ^ N.J. Stone, 2013 ACC/AHA Guideline on the Treatment of Blood Cholesterol to Reduce Atherosclerotic Cardiovascular Risk in Adults, in Circulation, vol. 129, 2014, pp. S1-S45.
- ^ D. Preis, The New Pooled Cohort Equations Risk Calculator, in Can. J. Cardiol, vol. 31, 2015, pp. 613-619.
- ^ S. Rabar, Lipid modification and cardiovascular risk assessment for the primary and secondary prevention of cardiovascular disease: summary of updated NICE guidance (abstract), in BMJ, vol. 349, 2014, p. g4356.
- ^ (EN) The International Network of Cholesterol Skeptics" - News, su thincs.org. URL consultato il 25 novembre 2008.
- ^ U. Ravnskov, Lack of an association or an inverse association between low-density-lipoprotein cholesterol and mortality in the elderly: a systematic review, in BMJ, e010401, 2016.
- ^ J.M. Bae, Low cholesterol is associated with mortality from cardiovascular diseases: a dynamic cohort study in Korean adults, in J. Korean Med. Sci., vol. 27, 2012, pp. 58-63.
- ^ a b H. Petursson, Is the use of cholesterol in mortality risk algorithms in clinical guidelines valid? Ten years prospective data from the Norwegian HUNT 2 study, in J. Eval. Clin. Pract., vol. 18, 2012, pp. 159-168.
- ^ (DE) H. Immich, Cholesterin und Koronarsklerose, in Versicherungsmedizin, vol. 49, 1997, p. 86 ss.
- ^ Prospective Studies Collaboration, Blood cholesterol and vascular mortality by age, sex, and blood pressure: a meta-analysis of individual data from 61 prospective studies with 55,000 vascular deaths (PDF), in Lancet, vol. 370, 2007, pp. 1829-1839.
- ^ J. Ahn, Prediagnostic total and high-density lipoprotein cholesterol and risk of cancer, in Cancer Epidemiol. Biomarkers Prev, vol. 18, 2009, pp. 2814-2821.
- ^ M. Eichholzer, Association of low plasma cholesterol with mortality for cancer at various sites in men: 17-y follow-up of the prospective Basel study, in Am. J. Clin. Nutr, vol. 71, 2000, pp. 569-574.
- ^ J. Ahn, Prediagnostic total and high-density lipoprotein cholesterol and risk of cancer, in Cancer Epidemiol. Biomarkers Prev., vol. 18, 2009, pp. 2814-2821.
- ^ A.M. Tonkin, The evidence on trial: cholesterol lowering and cancer, in Heart Asia, vol. 1, 2009, pp. :6-10.
- ^ Y. Takata, Serum total cholesterol concentration and 10-year mortality in an 85-year-old population, in Clin Interv Aging, vol. 9, 2014, pp. 293-300.
- ^ H. Soran, Evidence-based goals in LDL-C reduction, in Clin. Res. Cardiol.., vol. 106, 2017, pp. 237–248.
- ^ Heart Protection Study Collaborative Group, Effects on 11-year mortality and morbidity of lowering LDL cholesterol with simvastatin for about 5 years in 20,536 high-risk individuals: a randomised controlled trial, in Lancet, vol. 378, 2011, pp. 2013-2020.
- ^ K.R. Solomon, The complex interplay between cholesterol and prostate malignancy, in Urol. Clin. North. Am., vol. 38, 2011, pp. 243-259.
