Valnoctamide: differenze tra le versioni
m portale |
da en.wiki |
||
| Riga 1: | Riga 1: | ||
{{disclaimer|medico}} |
{{disclaimer|medico}} |
||
| ⚫ | |||
{{F|farmaci|maggio 2012}} |
|||
|nome = Valnoctamide |
|||
{{W|farmacologia|maggio 2012}} |
|||
|immagine1_nome = Valnoctamide.svg |
|||
| ⚫ | |||
|immagine1_dimensioni = 250px |
|||
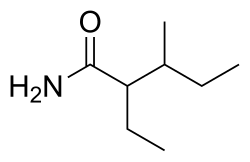
|immagine1_descrizione = Struttura chimica del valnoctamide |
|||
|nome_IUPAC = |
|||
|nomi alternativi = |
|||
|formula = C<sub>8</sub>H<sub>17</sub>NO |
|||
|massa_molecolare = |
|||
|aspetto = Bianco cristallino |
|||
|numero_CAS = 4171-13-5 |
|||
|prefisso_ATC = N05 |
|||
|suffisso_ATC = CM13 |
|||
|PubChem = 20140 |
|||
|DrugBank = |
|||
|smiles = CCC(C)C (CC)c (:[nH2]):[o] |
|||
|densità_condensato = |
|||
|temperatura_di_fusione = |
|||
|temperatura_di_ebollizione = |
|||
|solubilità_acqua = |
|||
|potere_rotatorio_specifico = |
|||
|entalpia_standard_combustione = |
|||
|categoria = |
|||
|teratogenesi = |
|||
|somministrazione = Orale, endovenosa |
|||
|biodisponibilità = 94% |
|||
|legame_proteico = |
|||
|metabolismo = epatico |
|||
|emivita = 10 h |
|||
|escrezione = |
|||
}} |
|||
Il '''valnoctamide''' è un [[farmaco]] utilizzato in [[Francia]] come [[sedativo]] dal [[1964]]<ref name="Harl_1964">{{cite journal | first = F. M. | last = Harl | month = March | year = 1964 | language = French | trans_title = Clinical Study Of Valnoctamide On 70 Neuropsychiatric Clinic Patients Undergoing Ambulatory Treatment | journal = La Presse Médicale | volume = 72 | pages = 753–754 | pmid = 14119722}}</ref>. È un [[Isomeria|isomero conformazionale]] del [[valpromide]], un [[profarmaco]] dell'[[acido valproico]]; a differenza di questo, il valnoctamide non viene, ''[[in vivo]]'', trasformato nel suo [[acido|acido omologo]], l'[[acido valnoctico]]<ref name=not-into-vpa>{{cite journal | first = Abdullah | last = Haj-Yehia | coauthors = Meir Bialer | month = August | year = 1989 | title = Structure-pharmacokinetic relationships in a series of valpromide derivatives with antiepileptic activity | journal = Pharmaceutical Research | volume = 6 | issue = 8 | pages = 683–689 | pmid = 2510141 | doi = 10.1023/A:1015934321764}}</ref>. |
|||
La '''valnoctamide''', derivato sintetico dell'acido valerianico, avrebbe proprietà tranquillanti e in parte anche antiepilettiche. Viene impiegata nel trattamento dell'ansia e per favorire il riposo notturno. |
|||
==Farmacocinetica== |
|||
Dopo somministrazione di una dose singola di farmaco di 400 mg si ottiene una concentrazione plasmatica massima di 5,8 µg/ml in meno di un'ora. L'emivita di eliminazione è di 9,3 ore. Al contrario della valpromide, suo isomero e pro-farmaco dell'acido valproico, la valnoctamide viene trattenuta dall'organismo per un periodo relativamente lungo e le concentrazioni plasmatiche dell'acido corrispondente, acido valnoctico, sono molto inferiori a quelle del composto originario. |
|||
==Posologia e vie di somministrazione== |
|||
La valnoctamide viene somministrata per via orale a una dose compresa tra 400 mg e 1200 mg al giorno in più volte. Nel trattamento dell'insonnia la somministrazione deve essere effettuata prima di coricarsi. |
|||
==Indicazioni== |
|||
Oltre alle proprietà sedative, il valnoctamide è stato studiato per il trattamento dell'[[epilessia]] sin dal [[1969]]<ref name=Mattos_Nda_1969>{{cite journal | first = S. | last = Mattos Nda | month = May | year = 1969| language = Portuguese | trans_title = Use of Valnoctamide (nirvanil) in oligophrenic erethics and epileptics | journal = Hospital (Rio J) | volume = 75 | issue = 5 | pages = 1701–1704 | pmid = 5306499}}</ref><ref name=Lindekens_et_al_2000>{{cite journal | first = H. | last = Lindekens | coauthors = Ilse Smolders, Ghous M. Khan, Meir Bialer, Guy Ebinger, and Yvette Michotte | month = November | year = 2000 | title = In vivo study of the effect of valpromide and valnoctamide in the pilocarpine rat model of focal epilepsy | journal = Pharmaceutical Research | volume = 17 | issue = 11 | pages = 1408–1413 | pmid = 11205735 | doi = 10.1023/A:1007559208599}}</ref>. È stato studiato anche per il trattamento del [[dolore neuropatico]], dimostrando buoni risultati: esso ha degli effetti minimi sulla [[coordinazione motoria]] e sullo stato di allerta a dosi effettive, e sembra aver effetti antidolorifici simili al [[gabapentin]]<ref name=pain>{{cite journal | first = Ilan | last = Winkler | coauthors = Simcha Blotnik, Jakob Shimshoni, Boris Yagen, Marshall Devor, and Meir Bialer | month = September | year = 2005 | title = Efficacy of antiepileptic isomers of valproic acid and valpromide in a rat model of neuropathic pain | journal = British Journal of Pharmacology | pmid = 15997234 | doi = 10.1038/sj.bjp.0706310 | volume = 146 | pages = 198–208 | issue = 2 | pmc = 1576263}}</ref>. È stato anche studiato per la [[profilassi]] degli [[Mania (disturbi psichici)|attacchi maniacali]] per sostituire l'acido valproico e i suoi derivati, dotati di maggior [[Teratogenesi|effetti teratogeni]]<ref name=kinder_gentler_valproate>{{cite web | author = RH Belmaker, Yuly Bersudsky, Alex Mishory and Beersheva Mental Health Center | year = 2005 | title = Valnoctamide in Mania | url = http://www.clinicaltrials.gov/ct/gui/show/NCT00140179?order=213 | work = ClinicalTrials.gov | publisher = United States National Institutes of Health | accessdate = 25 February 2006}}</ref>. |
|||
==Effetti collaterali== |
==Effetti collaterali== |
||
Gli [[Effetti collaterali (medicina)|effetti collaterali]] del valnoctamide sono soprattutto minori e includono [[sonnolenza]]<ref name="BIAM">{{Cite web | url=http://www.biam2.org/www/Sub2343.htmll | title=VALNOCTAMIDE | date=2 June 1997 | language=French | publisher=BIAM | accessdate=11 January 2012}}</ref> e i già citati effetti sulla coordinazione motoria. |
|||
Si possono verificare disturbi dovuti a ipersensibilità o a carico dell'apparato gastroenterico. |
|||
==Controindicazioni e precauzioni d'uso== |
|||
L'uso del farmaco è controindicato in caso di ipersensibilità individuale accertata. La somministrazione durante la gravidanza deve essere effettuata solo in caso di effettiva necessità e comunque sotto controllo medico. È sconsigliata l'assunzione contemporanea di alcool. |
|||
==Interazioni== |
==Interazioni== |
||
Il valnoctamide aumenta, mediante [[Inibizione enzimatica|inibizione]] dell'[[enzima]] [[epossido-idrolasi]], i livelli del [[metabolita]] [[Epossidi|epossidico]] della [[carbamazepina]], talvolta fino a livelli tossici<ref name=carbamazepine>{{cite journal | last1 = Pisani | first1 = F | last2 = Fazio | first2 = A | last3 = Artesi | first3 = C | last4 = Oteri | first4 = G | last5 = Spina | first5 = E | last6 = Tomson | first6 = T | last7 = Perucca | first7 = E | title = Impairment of carbamazepine-10, 11-epoxide elimination by valnoctamide, a valpromide isomer, in healthy subjects | journal = British Journal of Clinical Pharmacology | volume = 34 | issue = 1 | pages = 85–87 | year = 1992 | pmid = 1352988 | pmc = 1381382 }}</ref>. |
|||
La valnoctamide potenzia gli effetti di morfina, barbiturici ed etere. |
|||
==Caratteristiche chimiche== |
|||
Si tratta di un [[Racemo|composto racemico]] formato da quattro [[Stereoisomero|stereoisomeri]]<ref>Shimon Barel, Boris Yagen, Volker Schurig, Stephan Sobak, Francesco Pisani, Emilio Perucca and Meir Bialer. [http://www.nature.com/clpt/journal/v61/n4/full/clpt199736a.html Stereoselective pharmacokinetic analysis of valnoctamide in healthy subjects and in patients with epilepsy]. ''Clinical Pharmacology & Therapeutics 61, 442–449 (April 1997)'' {{doi|10.1016/S0009-9236(97)90194-6}}</ref>, che si sono dimostrati tutti più efficaci dell'acido valproico nei modelli animali per il trattamento dell'epilessia, in particolar modo il 2''S'',3''S''-valnoctamide<ref name=2s3s>{{cite journal | first = Nina | last = Isoherranen | coauthors = H. Steve White, Brian D. Klein, Michael Roeder, José H. Woodhead, Volker Schurig, Boris Yagen, Meir Bialer | month = August | year = 2003 | title = Pharmacokinetic-pharmacodynamic relationships of (2S,3S)-valnoctamide and its stereoisomer (2R,3S)-valnoctamide in rodent models of epilepsy | journal = Pharmaceutical Research | volume = 8 | issue = 8 | pages = 1293–1301 | pmid = 12948028 | doi = 10.1023/A:1025069519218}}</ref>. |
|||
== |
==Note== |
||
{{References|2}} |
|||
M. Bialer et al., Eur. J. Clin. Pharmacol. 38, 289, 1990; J.P. Chambon, A. Perio, Neurosci. Lett. (Suppl.) 5, S327, 1980. |
|||
{{portale|medicina}} |
{{portale|medicina|chimica}} |
||
[[Categoria:Antiepilettici]] |
|||
[[Categoria:Anticonvulsanti]] |
|||
[[en: |
[[en:Valnoctamide]] |
||
[[de:Valnoctamid]] |
[[de:Valnoctamid]] |
||
[[fa:والنوکتامید]] |
[[fa:والنوکتامید]] |
||
Versione delle 16:41, 1 lug 2012
| Valnoctamide | |
|---|---|
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C8H17NO |
| Aspetto | Bianco cristallino |
| Numero CAS | |
| Numero EINECS | 224-033-7 |
| Codice ATC | N05 |
| PubChem | 20140 |
| DrugBank | DB13099 |
| SMILES | CCC(C)C (CC)c (:[nH2]):[o] |
| Dati farmacologici | |
| Modalità di somministrazione | Orale, endovenosa |
| Dati farmacocinetici | |
| Biodisponibilità | 94% |
| Metabolismo | epatico |
| Emivita | 10 h |
| Indicazioni di sicurezza | |
Il valnoctamide è un farmaco utilizzato in Francia come sedativo dal 1964[1]. È un isomero conformazionale del valpromide, un profarmaco dell'acido valproico; a differenza di questo, il valnoctamide non viene, in vivo, trasformato nel suo acido omologo, l'acido valnoctico[2].
Indicazioni
Oltre alle proprietà sedative, il valnoctamide è stato studiato per il trattamento dell'epilessia sin dal 1969[3][4]. È stato studiato anche per il trattamento del dolore neuropatico, dimostrando buoni risultati: esso ha degli effetti minimi sulla coordinazione motoria e sullo stato di allerta a dosi effettive, e sembra aver effetti antidolorifici simili al gabapentin[5]. È stato anche studiato per la profilassi degli attacchi maniacali per sostituire l'acido valproico e i suoi derivati, dotati di maggior effetti teratogeni[6].
Effetti collaterali
Gli effetti collaterali del valnoctamide sono soprattutto minori e includono sonnolenza[7] e i già citati effetti sulla coordinazione motoria.
Interazioni
Il valnoctamide aumenta, mediante inibizione dell'enzima epossido-idrolasi, i livelli del metabolita epossidico della carbamazepina, talvolta fino a livelli tossici[8].
Caratteristiche chimiche
Si tratta di un composto racemico formato da quattro stereoisomeri[9], che si sono dimostrati tutti più efficaci dell'acido valproico nei modelli animali per il trattamento dell'epilessia, in particolar modo il 2S,3S-valnoctamide[10].
Note
- ^ (French) F. M. Harl, La Presse Médicale, vol. 72, March 1964, pp. 753–754. Lingua sconosciuta: French (aiuto)
- ^ Abdullah Haj-Yehia, Meir Bialer, Structure-pharmacokinetic relationships in a series of valpromide derivatives with antiepileptic activity, in Pharmaceutical Research, vol. 6, n. 8, August 1989, pp. 683–689, DOI:10.1023/A:1015934321764.
- ^ (Portuguese) S. Mattos Nda, Hospital (Rio J), vol. 75, n. 5, May 1969, pp. 1701–1704. Lingua sconosciuta: Portuguese (aiuto)
- ^ H. Lindekens, Ilse Smolders, Ghous M. Khan, Meir Bialer, Guy Ebinger, and Yvette Michotte, In vivo study of the effect of valpromide and valnoctamide in the pilocarpine rat model of focal epilepsy, in Pharmaceutical Research, vol. 17, n. 11, November 2000, pp. 1408–1413, DOI:10.1023/A:1007559208599.
- ^ Ilan Winkler, Simcha Blotnik, Jakob Shimshoni, Boris Yagen, Marshall Devor, and Meir Bialer, Efficacy of antiepileptic isomers of valproic acid and valpromide in a rat model of neuropathic pain, in British Journal of Pharmacology, vol. 146, n. 2, September 2005, pp. 198–208, DOI:10.1038/sj.bjp.0706310.
- ^ RH Belmaker, Yuly Bersudsky, Alex Mishory and Beersheva Mental Health Center, Valnoctamide in Mania, in ClinicalTrials.gov, United States National Institutes of Health, 2005. URL consultato il 25 February 2006.
- ^ (French) VALNOCTAMIDE, su biam2.org, BIAM, 2 June 1997. URL consultato l'11 January 2012. Lingua sconosciuta: French (aiuto)
- ^ Impairment of carbamazepine-10, 11-epoxide elimination by valnoctamide, a valpromide isomer, in healthy subjects, in British Journal of Clinical Pharmacology, vol. 34, n. 1, 1992, pp. 85–87.
- ^ Shimon Barel, Boris Yagen, Volker Schurig, Stephan Sobak, Francesco Pisani, Emilio Perucca and Meir Bialer. Stereoselective pharmacokinetic analysis of valnoctamide in healthy subjects and in patients with epilepsy. Clinical Pharmacology & Therapeutics 61, 442–449 (April 1997) DOI: 10.1016/S0009-9236(97)90194-6
- ^ Nina Isoherranen, H. Steve White, Brian D. Klein, Michael Roeder, José H. Woodhead, Volker Schurig, Boris Yagen, Meir Bialer, Pharmacokinetic-pharmacodynamic relationships of (2S,3S)-valnoctamide and its stereoisomer (2R,3S)-valnoctamide in rodent models of epilepsy, in Pharmaceutical Research, vol. 8, n. 8, August 2003, pp. 1293–1301, DOI:10.1023/A:1025069519218.