Nitrato di etile: differenze tra le versioni
Nessun oggetto della modifica |
alcune correzioni (v. discussione) e piccolo ampliamento |
||
| Riga 1: | Riga 1: | ||
{{Composto chimico |
{{Composto chimico |
||
|nome |
|nome = |
||
|immagine1_nome |
|immagine1_nome = Ethyl Nitrate Structural Formulae V.1.svg |
||
|immagine1_dimensioni |
|immagine1_dimensioni = 200px |
||
|immagine1_descrizione |
|immagine1_descrizione = |
||
|immagine2_nome |
|immagine2_nome = Ethyl nitrate 3D ball.png |
||
|immagine2_dimensioni |
|immagine2_dimensioni = 300px |
||
|immagine2_descrizione |
|immagine2_descrizione = |
||
|immagine3_nome |
|immagine3_nome = |
||
|immagine3_dimensioni |
|immagine3_dimensioni = |
||
|immagine3_descrizione |
|immagine3_descrizione = |
||
|immagine4_nome |
|immagine4_nome = |
||
|immagine4_dimensioni |
|immagine4_dimensioni = |
||
|immagine4_descrizione |
|immagine4_descrizione = |
||
|immagine5_nome |
|immagine5_nome = |
||
|immagine5_dimensioni |
|immagine5_dimensioni = |
||
|immagine5_descrizione |
|immagine5_descrizione = |
||
|nome_IUPAC |
|nome_IUPAC = Nitrato di etile |
||
|abbreviazioni |
|abbreviazioni = |
||
|nomi_alternativi |
|nomi_alternativi = |
||
|massa_molecolare |
|massa_molecolare = 91,07 g/mol |
||
|peso_formula |
|peso_formula = |
||
|aspetto |
|aspetto = liquido incolore |
||
|note_CAS |
|note_CAS = |
||
|numero_EINECS |
|numero_EINECS = |
||
|prefisso_ATC |
|prefisso_ATC = |
||
|suffisso_ATC |
|suffisso_ATC = |
||
|DrugBank |
|DrugBank = |
||
|smiles |
|smiles = |
||
|densità_condensato |
|densità_condensato = |
||
|densità_g_l |
|densità_g_l = |
||
|densità_gas |
|densità_gas = |
||
|prodotto_ionico |
|prodotto_ionico = |
||
|indice_di_rifrazione |
|indice_di_rifrazione = |
||
|potere_rotatorio_specifico |
|potere_rotatorio_specifico = |
||
|Ka |
|Ka = |
||
|pKa |
|pKa = |
||
|Ka_temperatura |
|Ka_temperatura = |
||
|Kb |
|Kb = |
||
|pKb |
|pKb = |
||
|Kb_temperatura |
|Kb_temperatura = |
||
|punto_isoelettrico |
|punto_isoelettrico = |
||
|solubilità_acqua |
|solubilità_acqua = |
||
|Ks |
|Ks = |
||
|pKs |
|pKs = |
||
|Ks_temperatura |
|Ks_temperatura = |
||
|temperatura_di_fusione |
|temperatura_di_fusione = −102 °C |
||
|entalpia_di_fusione |
|entalpia_di_fusione = |
||
|entropia_di_fusione |
|entropia_di_fusione = |
||
|temperatura_di_ebollizione |
|temperatura_di_ebollizione = 87 °C |
||
|entalpia_di_ebollizione |
|entalpia_di_ebollizione = |
||
|entropia_di_ebollizione |
|entropia_di_ebollizione = |
||
|punto_triplo |
|punto_triplo = |
||
|punto_critico |
|punto_critico = |
||
|tensione_di_vapore |
|tensione_di_vapore = |
||
|tensione_di_vapore_temperatura |
|tensione_di_vapore_temperatura = |
||
|sistema_cristallino |
|sistema_cristallino = |
||
|viscosità_cinematica |
|viscosità_cinematica = |
||
|viscosità_cinematica_temperatura |
|viscosità_cinematica_temperatura = |
||
|viscosità_dinamica |
|viscosità_dinamica = |
||
|viscosità_dinamica_temperatura |
|viscosità_dinamica_temperatura = |
||
|titolo_proprietà_termochimiche |
|titolo_proprietà_termochimiche = |
||
|entalpia_standard_di_formazione |
|entalpia_standard_di_formazione = |
||
|energia_libera_standard_di_formazione |
|energia_libera_standard_di_formazione = |
||
|entropia_standard_di_formazione |
|entropia_standard_di_formazione = |
||
|capacità_termica |
|capacità_termica = |
||
|entalpia_standard_di_combustione |
|entalpia_standard_di_combustione = |
||
|LD50 |
|LD50 = |
||
|categoria |
|categoria = |
||
|teratogenesi |
|teratogenesi = |
||
|somministrazione |
|somministrazione = |
||
|biodisponibilità |
|biodisponibilità = |
||
|legame proteico |
|legame proteico = |
||
|metabolismo |
|metabolismo = |
||
|emivita |
|emivita = |
||
|escrezione |
|escrezione = |
||
|flash_point |
|flash_point = 10 °C |
||
|limiti_di_esplosione |
|limiti_di_esplosione = |
||
|temperatura_di_autoignizione |
|temperatura_di_autoignizione = |
||
|TLV |
|TLV = |
||
|simbolo1 |
|simbolo1 = esplosivo |
||
|simbolo2 |
|simbolo2 = nocivo |
||
|simbolo3 |
|simbolo3 = |
||
|simbolo4 |
|simbolo4 = |
||
|simbolo5 |
|simbolo5 = |
||
|avvertenza |
|avvertenza = |
||
|frasiR |
|frasiR = |
||
|frasiS |
|frasiS = |
||
|frasiH |
|frasiH = |
||
|consigliP |
|consigliP = |
||
}} |
}} |
||
Il '''nitrato di etile''' è |
Il '''nitrato di etile''' è l'[[Esteri|estere]] [[Etile|etilico]] dell'[[acido nitrico]], avente [[formula condensata]] CH<sub>3</sub>CH<sub>2</sub>ONO<sub>2</sub>. A temperatura ambiente si presenta come un liquido incolore abbastanza esplosivo e tossico per sovradosaggio.<ref>{{cita web|url=http://toxnet.nlm.nih.gov/cgi-bin/sis/search/a?dbs+hsdb:@term+@DOCNO+415|titolo=Effetti del nitrato di etile sulla salute umana|editore=TOXNET}}</ref> Il composto è naturalmente presente in minime quantità nell'atmosfera, ma si forma anche per cause naturali nel profondo degli oceani.<ref>{{Cita web|url=https://www.sciencenews.org/article/natures-own-ocean-yields-gases-had-seemed-humanmade|titolo=Nature's Own: Ocean yields gases that had seemed humanmade|data=2002-08-14|lingua=en-US|accesso=2023-09-30}}</ref> Viene usato in sintesi organica e come intermedio per la preparazione di alcuni farmaci, coloranti e profumi.<ref>{{Cita libro|nome=Kenneth|cognome=Schofield|titolo=Aromatic nitration|accesso=2023-09-30|data=1980|editore=Cambridge Univ. Pr|ISBN=978-0-521-23362-0}}</ref> |
||
==Sintesi== |
==Sintesi== |
||
È possibile ottenere il nitrato di etile tramite [[esterificazione]] |
È possibile ottenere il nitrato di etile tramite [[esterificazione]] dell'[[etanolo]] con [[Fluoruro di Nitrile|fluoruro di nitroile]] (FNO<sub>2</sub>) eseguita alla temperatura di -10 °C:<ref>{{Cita pubblicazione|nome=G.|cognome=Hetherington|nome2=P. L.|cognome2=Robinson|data=1954-01-01|titolo=Nitryl fluoride as a nitrating agent|rivista=Journal of the Chemical Society (Resumed)|numero=0|pp=3512–3514|lingua=en|accesso=2023-09-30|doi=10.1039/JR9540003512|url=https://pubs.rsc.org/en/content/articlelanding/1954/jr/jr9540003512}}</ref> |
||
:[[Etanolo|CH<sub>3</sub>CH<sub>2</sub>OH]] + [[fluoruro di nitronio|NO<sub>2</sub>F]] → CH<sub>3</sub>CH<sub>2</sub>ONO<sub>2</sub> + [[Acido fluoridrico|HF]] |
:[[Etanolo|CH<sub>3</sub>CH<sub>2</sub>OH]] + [[fluoruro di nitronio|NO<sub>2</sub>F]] → CH<sub>3</sub>CH<sub>2</sub>ONO<sub>2</sub> + [[Acido fluoridrico|HF]] |
||
Questa reazione è stata poi riesaminata nei suoi dettagli.<ref>{{Cita pubblicazione|nome=B. S.|cognome=Fedorov|nome2=L. T.|cognome2=Eremenko|data=1997-05-01|titolo=Nitration of alcohols by nitryl fluoride|rivista=Russian Chemical Bulletin|volume=46|numero=5|pp=1022–1023|lingua=en|accesso=2023-09-30|doi=10.1007/BF02496138|url=https://doi.org/10.1007/BF02496138}}</ref> È inoltre possibile ottenerlo per esterificazione dell'etanolo con acido nitrico fumante a temperatura di 10-20 °C, o anche con una miscela di acido nitrico e acido solforico, dove quest'ultimo serve come agente disidratante: |
|||
è inoltre possibile ottenerlo per nitrazione dell'etanolo a temperatura di 10-20 °C utilizzando [[acido nitrico]] come catalizzatore e deidratante: |
|||
:{{chem|C|2|H|5|OH}} + {{chem|HNO|3}} → {{chem|C|2|H|5|ONO|2}} + {{chem|H|2|O}}. |
:{{chem|C|2|H|5|OH}} + {{chem|HNO|3}} → {{chem|C|2|H|5|ONO|2}} + {{chem|H|2|O}}. |
||
Con questo tipo di sintesi bisogna fare attenzione perché ad alte temperature l'acido nitrico tende ad ossidare l'etanolo ad acetaldeide. Questo tipo di sintesi viene utilizzato anche su scala industriale. |
Con questo tipo di sintesi bisogna fare attenzione perché ad alte temperature l'acido nitrico tende ad ossidare l'etanolo ad acetaldeide. Inoltre, la purificazione della miscela di reazione tramite distillazione è sconsigliabile in quanto comporta il rischio di esplosione.<ref>{{Cita libro|nome=Julius B. (Julius Berend)|cognome=University of California Libraries|titolo=Theoretical organic chemistry|url=http://archive.org/details/theoreticalorgan00coherich|accesso=2023-09-30|data=1920|editore=London, Macmillan|p=189}}</ref> Questo tipo di sintesi viene utilizzato anche su scala industriale. |
||
== Proprietà == |
== Proprietà == |
||
Versione delle 13:40, 30 set 2023
| Nitrato di etile | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Nitrato di etile | |
| Caratteristiche generali | |
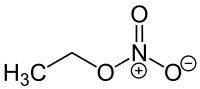
| Formula bruta o molecolare | C2H5NO3 |
| Massa molecolare (u) | 91,07 g/mol |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 210-903-3 |
| PubChem | 12259 |
| SMILES | CCO[N+](=O)[O-] |
| Proprietà chimico-fisiche | |
| Temperatura di fusione | −102 °C |
| Temperatura di ebollizione | 87 °C |
| Indicazioni di sicurezza | |
| Punto di fiamma | 10 °C |
| Simboli di rischio chimico | |
Il nitrato di etile è l'estere etilico dell'acido nitrico, avente formula condensata CH3CH2ONO2. A temperatura ambiente si presenta come un liquido incolore abbastanza esplosivo e tossico per sovradosaggio.[1] Il composto è naturalmente presente in minime quantità nell'atmosfera, ma si forma anche per cause naturali nel profondo degli oceani.[2] Viene usato in sintesi organica e come intermedio per la preparazione di alcuni farmaci, coloranti e profumi.[3]
Sintesi
È possibile ottenere il nitrato di etile tramite esterificazione dell'etanolo con fluoruro di nitroile (FNO2) eseguita alla temperatura di -10 °C:[4]
Questa reazione è stata poi riesaminata nei suoi dettagli.[5] È inoltre possibile ottenerlo per esterificazione dell'etanolo con acido nitrico fumante a temperatura di 10-20 °C, o anche con una miscela di acido nitrico e acido solforico, dove quest'ultimo serve come agente disidratante:
- C2H5OH + HNO3 → C2H5ONO2 + H2O.
Con questo tipo di sintesi bisogna fare attenzione perché ad alte temperature l'acido nitrico tende ad ossidare l'etanolo ad acetaldeide. Inoltre, la purificazione della miscela di reazione tramite distillazione è sconsigliabile in quanto comporta il rischio di esplosione.[6] Questo tipo di sintesi viene utilizzato anche su scala industriale.
Proprietà
Il nitrato di etile è un liquido altamente infiammabile e si decompone esotermicamente. In quantità abbastanza grandi esplode anche in assenza di ossigeno.
Note
- ^ Effetti del nitrato di etile sulla salute umana, su toxnet.nlm.nih.gov, TOXNET.
- ^ (EN) Nature's Own: Ocean yields gases that had seemed humanmade, su sciencenews.org, 14 agosto 2002. URL consultato il 30 settembre 2023.
- ^ Kenneth Schofield, Aromatic nitration, Cambridge Univ. Pr, 1980, ISBN 978-0-521-23362-0.
- ^ (EN) G. Hetherington e P. L. Robinson, Nitryl fluoride as a nitrating agent, in Journal of the Chemical Society (Resumed), n. 0, 1º gennaio 1954, pp. 3512–3514, DOI:10.1039/JR9540003512. URL consultato il 30 settembre 2023.
- ^ (EN) B. S. Fedorov e L. T. Eremenko, Nitration of alcohols by nitryl fluoride, in Russian Chemical Bulletin, vol. 46, n. 5, 1º maggio 1997, pp. 1022–1023, DOI:10.1007/BF02496138. URL consultato il 30 settembre 2023.
- ^ Julius B. (Julius Berend) University of California Libraries, Theoretical organic chemistry, London, Macmillan, 1920, p. 189. URL consultato il 30 settembre 2023.
Altri progetti
 Wikimedia Commons contiene immagini o altri file su Nitrato di etile
Wikimedia Commons contiene immagini o altri file su Nitrato di etile