Gangli della base: differenze tra le versioni
→Circuiti: ampliamento con traduzione della voce Basal ganglia su en.wikipedia.org |
→Circuiti: correggo nota |
||
| Riga 85: | Riga 85: | ||
Tuttavia in questo modello la velocità del percorso diretto non sarebbe concordante con il percorso indiretto. Per superare questo, sono stati proposti, nel ''center surround model'', un percorso iperdiretto in cui la corteccia invia proiezioni glutammatergiche attraverso il nucleo subtalamico eccitando il GPe inibitorio, così come una via indiretta più breve. |
Tuttavia in questo modello la velocità del percorso diretto non sarebbe concordante con il percorso indiretto. Per superare questo, sono stati proposti, nel ''center surround model'', un percorso iperdiretto in cui la corteccia invia proiezioni glutammatergiche attraverso il nucleo subtalamico eccitando il GPe inibitorio, così come una via indiretta più breve. |
||
Il percorso diretto, originatosi nello striato dorsale, inibisce il GPi e il SNr, determinando una disinibizione o eccitazione netta del talamo. Questo percorso consiste di neuroni medio spinosi (MSN) che esprimono il recettore D1 della dopamina, il recettore muscarinico dell'acetilcolina M4 e il recettore A1 dell'adenosina<ref name="receptors"/>. È stato proposto che il percorso diretto faciliti le azioni motorie, i tempi delle azioni motorie, il controllo della memoria di lavoro e le risposte motorie a stimoli specifici<ref name="BG models"/>. |
Il percorso diretto, originatosi nello striato dorsale, inibisce il GPi e il SNr, determinando una disinibizione o eccitazione netta del talamo. Questo percorso consiste di neuroni medio spinosi (MSN) che esprimono il recettore D1 della dopamina, il recettore muscarinico dell'acetilcolina M4 e il recettore A1 dell'adenosina<ref name="receptors"/>. È stato proposto che il percorso diretto faciliti le azioni motorie, i tempi delle azioni motorie, il controllo della memoria di lavoro e le risposte motorie a stimoli specifici<ref name="BG models">{{cite journal|last1=Schroll|first1=Henning|last2=Hamker|first2=Fred H.|title=Computational models of basal-ganglia pathway functions: focus on functional neuroanatomy|journal=Frontiers in Systems Neuroscience|date=30 December 2013|volume=7|doi=10.3389/fnsys.2013.00122|pmc=3874581|issn=1662-5137|pmid=24416002}}</ref>. |
||
Il percorso (lungo) indiretto ha origine nello striato dorsale e inibisce il GPe, con conseguente disinibizione del GPi che è quindi libero di inibire il talamo. Questo percorso consiste di MSN che esprimono il recettore dopaminergico D2, il recettore muscarinico dell'acetilcolina M1 e il recettore A2a dell'adenosina<ref name="receptors">{{cite journal|last1=Silkis|first1=I.|title=The cortico-basal ganglia-thalamocortical circuit with synaptic plasticity. II. Mechanism of synergistic modulation of thalamic activity via the direct and indirect pathways through the basal ganglia|journal=Bio Systems|date=1 January 2001|volume=59|issue=1|pages=7–14|pmid=11226622|issn=0303-2647|doi=10.1016/s0303-2647(00)00135-0}}</ref>. È stato proposto che questo percorso provochi l'inibizione motoria globale (inibizione di tutte le attività motorie) e la cessazione delle risposte. È stato proposto un altro percorso indiretto più breve, che comporta l'eccitazione corticale del nucleo subtalamico con conseguente eccitazione diretta del GPe e l'inibizione del talamo. Questo percorso è proposto per determinare l'inibizione di specifici programmi motori basati sull'apprendimento associativo<ref name="BG models"/>. |
Il percorso (lungo) indiretto ha origine nello striato dorsale e inibisce il GPe, con conseguente disinibizione del GPi che è quindi libero di inibire il talamo. Questo percorso consiste di MSN che esprimono il recettore dopaminergico D2, il recettore muscarinico dell'acetilcolina M1 e il recettore A2a dell'adenosina<ref name="receptors">{{cite journal|last1=Silkis|first1=I.|title=The cortico-basal ganglia-thalamocortical circuit with synaptic plasticity. II. Mechanism of synergistic modulation of thalamic activity via the direct and indirect pathways through the basal ganglia|journal=Bio Systems|date=1 January 2001|volume=59|issue=1|pages=7–14|pmid=11226622|issn=0303-2647|doi=10.1016/s0303-2647(00)00135-0}}</ref>. È stato proposto che questo percorso provochi l'inibizione motoria globale (inibizione di tutte le attività motorie) e la cessazione delle risposte. È stato proposto un altro percorso indiretto più breve, che comporta l'eccitazione corticale del nucleo subtalamico con conseguente eccitazione diretta del GPe e l'inibizione del talamo. Questo percorso è proposto per determinare l'inibizione di specifici programmi motori basati sull'apprendimento associativo<ref name="BG models"/>. |
||
Versione delle 18:44, 2 dic 2018
| Gangli della base | |
|---|---|
 | |
 | |
| Nome latino | nuclei basales |
| Sistema | Sistema nervoso centrale |
| Identificatori | |
| MeSH | A08.186.211.200.885.287.249 |
| TA | A14.1.09.501 |
| FMA | 84013 |
| ID NeuroLex | birnlex_826 |
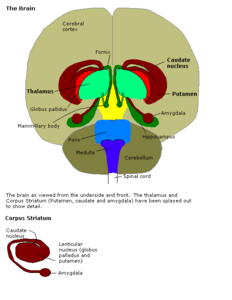
I gangli della base (o nuclei della base) sono un gruppo di nuclei subcorticali, di varia origine, nel cervello dei vertebrati, inclusi gli esseri umani, che si trovano alla base del telencefalo e nella parte superiore del mesencefalo. I gangli della base sono fortemente interconnessi con la corteccia cerebrale, il talamo e il tronco encefalico, così come molte altre aree del cervello. I gangli della base sono associati a una varietà di funzioni, tra cui il controllo dei movimenti volontari, l'apprendimento procedurale, l'apprendimento delle abitudini, i movimenti oculari, la cognizione[1] e l'emozione[2].
I componenti principali dei gangli della base - come definiti funzionalmente - sono lo striato, sia lo striato dorsale (nucleo caudato e putamen) che lo striato ventrale (nucleus accumbens e tubercolo olfattivo), il globo pallido, il pallido ventrale, la substantia nigra e il nucleo subtalamico[3]. Ciascuno di questi componenti ha una complessa organizzazione interna anatomica e neurochimica. Il componente più importante, lo striato (dorsale e ventrale), riceve input da molte aree del cervello oltre i gangli della base, ma invia l'output solo ad altri componenti dei gangli della base. Il pallido riceve input dallo striato e invia l'output inibitorio a varie aree motorie. La substantia nigra è l'origine dell'ingresso striatale del neurotrasmettitore dopamina, che svolge un ruolo importante nella funzione dei gangli della base. Il nucleo subtalamico riceve input principalmente dallo striato e dalla corteccia cerebrale, e proietta sul globo pallido.
Le teorie più accreditate implicano i gangli della base principalmente nella selezione delle azioni - ovvero contribuiscono a decidere quale tra i possibili comportamenti eseguire in un dato momento. In termini più specifici, la funzione primaria dei gangli della base è il controllo e la regolazione delle attività delle aree corticali motorie e premotorie in modo che i movimenti volontari possano essere eseguiti fluidamente[1][4]. Studi sperimentali mostrano che i gangli della base esercitano un'influenza inibitoria su un numero di sistemi motori e che un rilascio di questa inibizione consente al sistema motorio di attivarsi. La "modifica del comportamento" che avviene all'interno dei gangli della base è influenzata da segnali provenienti da molte parti del cervello, inclusa la corteccia prefrontale, che svolge un ruolo chiave nelle funzioni esecutive[2][5].
I gangli della base sono di grande importanza per le normali funzioni e comportamenti cerebrali. La loro disfunzione si traduce in una vasta gamma di condizioni neurologiche tra cui i disturbi del controllo del comportamento e del movimento. Quelli comportamentali includono la sindrome di Tourette, il disturbo ossessivo-compulsivo e la dipendenza. I disordini del movimento comprendono, in particolare, la malattia di Parkinson, che comporta la degenerazione delle cellule produttrici di dopamina nella substantia nigra, la malattia di Huntington, che coinvolge principalmente un danno allo striato[1][3], distonia e più raramente emiballismo. I gangli della base hanno un settore limbico ai cui componenti sono assegnati nomi distinti: il nucleus accumbens, il pallido ventrale e l'area tegmentale ventrale (VTA). Vi è una considerevole evidenza che questa parte limbica giochi un ruolo centrale nell'apprendimento della ricompensa, in particolare la via mesolimbica dal VTA al nucleus accumbens, che utilizza il neurotrasmettitore dopamina. Si pensa che un certo numero di droghe, tra cui cocaina, anfetamina e nicotina, agiscano aumentando l'efficacia di questo segnale della dopamina. Ci sono anche evidenze che implicano l'iperattività della proiezione dopaminergica VTA nella schizofrenia[6].
Struttura
In termini di sviluppo, il sistema nervoso centrale umano è spesso classificato sulla base delle tre primitive vescicole originarie da cui si sviluppa: queste vescicole primarie si formano nel normale sviluppo del tubo neurale dell'embrione e comprendono inizialmente il prosencefalo, il mesencefalo e il rombencefalo , in orientamento da rostrale a caudale (dalla testa alla coda). Più tardi nello sviluppo del sistema nervoso ogni sezione si trasforma in componenti più piccoli. Durante lo sviluppo, le cellule che migrano tangenzialmente per formare i gangli della base sono dirette dalle eminenze gangliari laterali e mediali[7].
La seguente tabella mostra questa classificazione evolutiva e la traccia delle strutture anatomiche trovate nei gangli della base.[1][3][8] Le strutture relative ai gangli della base sono mostrate in grassetto.
| Divisione primaria del tubo neurale | Divisione secondaria | Segmenti finali nell'uomo adulto |
|---|---|---|
| Prosencefalo |
| |
| Mesencefalo |
|
|
| Rombencefalo |
|

Anteriore: striato, globo pallido (GPe and GPi)
Posteriore: nucleo subtalamico (STN), substantia nigra (SN)
I gangli della base formano una componente fondamentale del cervello. In contrasto con lo strato corticale che riveste la superficie del proencefalo, i gangli basali sono una raccolta di distinte masse di materia grigia che giacciono nel profondo del cervello non lontano dalla giunzione del talamo. Si trovano a lato del talamo e lo circondano[9]. Come la maggior parte delle parti del cervello, i gangli della base sono costituiti da lati sinistro e destro che sono immagini speculari l'una dell'altra.
In termini di anatomia, i gangli della base sono divisi in quattro strutture distinte, a seconda di come sono superiori o rostrali (in altre parole a seconda di quanto sono vicini alla sommità della testa): due di loro, lo striato e il pallido , sono relativamente grandi; gli altri due, la substantia nigra e il nucleo subtalamico, sono più piccoli. Nell'illustrazione a destra, due sezioni coronali del cervello umano mostrano la posizione dei componenti dei gangli della base. Da notare, e non visto in questa sezione, il nucleo subtalamico e la substantia nigra si trovano più indietro (posteriormente) nel cervello rispetto allo striato e al pallido.
Striato

Lo striato è una struttura sottocorticale generalmente divisa nello striato dorsale e nello striato ventrale, anche se è stato suggerito che una classificazione laterale mediale sia più pertinente dal punto di vista comportamentale[10] e viene utilizzata più ampiamente[11].
Lo striato è composto principalmente da neuroni medio spinosi. Questi neuroni GABAergici proiettano al globo pallido esterno (laterale) e al globo pallido interno (mediale), nonché alla substantia nigra pars reticulata. Le proiezioni a globo pallido e substantia nigra sono principalmente dopaminergiche, sebbene l'encefalina, la dinorfina e la sostanza P siano presenti. Lo striato contiene anche interneuroni classificati come neuroni nitrici (dovuti all'uso di ossido nitrico come neurotrasmettitore), interneuroni colinergici tonicamente attivi, neuroni che esprimono parvalbumina e neuroni che esprimono calretina[12]. Lo striato dorsale riceve significativi input glutammatergici dalla corteccia, così come input dopaminergici dalla substantia nigra pars compacta. Lo striato dorsale viene generalmente considerato coinvolto nelle attività sensomotorie. Lo striato ventrale riceve input glutammatergici dalle aree limbiche e input dopaminergici dalla VTA, attraverso la via mesolimbica. Si ritiene che lo striato ventrale svolga un ruolo nella ricompensa e in altre funzioni limbiche[13]. Lo striato dorsale è diviso nel caudato e nel putamen dalla capsula interna mentre lo striato ventrale è composto dal nucleus accumbens e dal tubercolo olfattivo[14][15]. Il caudato ha tre regioni principali di connettività, con la testa del caudato che mostra connettività alla corteccia prefrontale, alla corteccia cingolata e all'amigdala. Il corpo e la coda mostrano la differenziazione tra il bordo dorsolaterale e il caudato ventrale, proiettandosi rispettivamente verso le regioni sensomotoria e limbica dello striato[16]. Le fibre striatopallidiche collegano lo striato al pallido.
Pallido
Il pallido è costituito da una grande struttura chiamata globo pallido insieme ad una più piccola estensione ventrale chiamata pallido ventrale. Il globo pallido appare come una singola massa neurale, ma può essere diviso in due parti funzionalmente distinte, chiamate segmento interno (o mediale) ed esterno (laterale), abbreviati GPi e GPe[1]. Entrambi i segmenti contengono principalmente neuroni GABAergici, che pertanto hanno effetti inibitori sui loro bersagli. I due segmenti partecipano a circuiti neurali distinti. Il GPe riceve input principalmente dallo striato e proietta nel nucleo subtalamico. Il GPi riceve segnali dallo striato tramite i percorsi "diretto" e "indiretto". I neuroni pallidi operano utilizzando un principio di disinibizione. Questi neuroni sparano a velocità elevate in assenza di input, e i segnali dal corpo striato fanno sospendere o ridurre il loro tasso di attività. Poiché i neuroni pallidi stessi hanno effetti inibitori sui loro bersagli, l'effetto netto dell'ingresso striatale sul pallido è una riduzione dell'inibizione tonica esercitata dalle cellule pallide sui loro bersagli (disinibizione) con un aumento del tasso di attività nei bersagli.
Substantia nigra

La substantia nigra è una porzione di materia grigia dei gangli della base costituita da due parti: la pars compacta (SNc) e la pars reticulata (SNr). La SNr lavora spesso all'unisono con GPi e il complesso SNr-GPi inibisce il talamo. La substantia nigra pars compacta (SNc) tuttavia, produce il neurotrasmettitore dopamina, che è molto significativo nel mantenere l'equilibrio nella via striatale.
Nucleo subtalamico
Il nucleo subtalamico è una porzione di sostanza grigia diencefalica dei gangli della base e l'unica porzione dei gangli che produce un neurotrasmettitore eccitatorio, il glutammato. Il ruolo del nucleo subtalamico è quello di stimolare il complesso SNr-GPi e fa parte del percorso indiretto. Il nucleo subtalamico riceve l'input inibitorio dalla parte esterna del globo pallido e invia l'input eccitatorio al GPi.
Circuiti

Sono stati proposti molteplici modelli di circuiti e funzioni dei gangli della base, e sono sorti interrogativi sulle rigide divisioni dei percorsi diretti e indiretti, oltrechè sulla loro possibile sovrapposizione e regolazione[17]. I modelli circuitali si sono evoluti dal primo modello proposto negli anni '90 da DeLong, il modello di elaborazione parallela, nel quale la corteccia e la substantia nigra pars compacta proiettano nello striato dorsale dando origine ad una via indiretta inibitoria e una via diretta eccitatoria:
- La via indiretta inibitoria comportava l'inibizione del globo pallido esterno, consentendo la disinibizione del globo pallido interno (attraverso STN) che gli permetteva di inibire il talamo.
- Il percorso diretto o eccitatorio comportava la disinibizione del talamo attraverso l'inibizione del GPi / SNr.
Tuttavia in questo modello la velocità del percorso diretto non sarebbe concordante con il percorso indiretto. Per superare questo, sono stati proposti, nel center surround model, un percorso iperdiretto in cui la corteccia invia proiezioni glutammatergiche attraverso il nucleo subtalamico eccitando il GPe inibitorio, così come una via indiretta più breve.
Il percorso diretto, originatosi nello striato dorsale, inibisce il GPi e il SNr, determinando una disinibizione o eccitazione netta del talamo. Questo percorso consiste di neuroni medio spinosi (MSN) che esprimono il recettore D1 della dopamina, il recettore muscarinico dell'acetilcolina M4 e il recettore A1 dell'adenosina[18]. È stato proposto che il percorso diretto faciliti le azioni motorie, i tempi delle azioni motorie, il controllo della memoria di lavoro e le risposte motorie a stimoli specifici[19].
Il percorso (lungo) indiretto ha origine nello striato dorsale e inibisce il GPe, con conseguente disinibizione del GPi che è quindi libero di inibire il talamo. Questo percorso consiste di MSN che esprimono il recettore dopaminergico D2, il recettore muscarinico dell'acetilcolina M1 e il recettore A2a dell'adenosina[18]. È stato proposto che questo percorso provochi l'inibizione motoria globale (inibizione di tutte le attività motorie) e la cessazione delle risposte. È stato proposto un altro percorso indiretto più breve, che comporta l'eccitazione corticale del nucleo subtalamico con conseguente eccitazione diretta del GPe e l'inibizione del talamo. Questo percorso è proposto per determinare l'inibizione di specifici programmi motori basati sull'apprendimento associativo[19].
Una combinazione di questi percorsi indiretti con conseguente percorso iperdiretto che determina l'inibizione degli input dei gangli basali oltre a uno specifico focus è stata proposta come parte della teoria del center surround[20][21]. Questo percorso iperdiretto è proposto per inibire le risposte premature o inibire globalmente i gangli della base per consentire un controllo top-down più specifico dalla corteccia[19].
Le interazioni di questi percorsi sono attualmente in discussione. Alcuni ricercatori sostengono che tutti i percorsi si contrappongono direttamente, mentre altri sostengono la teoria del center surround, secondo cui un input focalizzato nella corteccia è protetto dall'inibizione degli input concorrenti dal resto dei percorsi indiretti[19].
Note
- ^ a b c d e Andrea Stocco, Christian Lebiere e John R. Anderson, Conditional Routing of Information to the Cortex: A Model of the Basal Ganglia's Role in Cognitive Coordination, in Psychological Review, vol. 117, n. 2, 2010, pp. 541–74, DOI:10.1037/a0019077, PMC 3064519, PMID 20438237.
- ^ a b James A. Weyhenmeyer e Eve. A. Gallman, Rapid Review of Neuroscience, Mosby Elsevier, 2007, p. 102, ISBN 0-323-02261-8.
- ^ a b c James D. Fix, Basal Ganglia and the Striatal Motor System, in Neuroanatomy (Board Review Series), 4th, Baltimore, Wulters Kluwer & Lippincott Wiliams & Wilkins, 2008, pp. 274–281, ISBN 0-7817-7245-1.
- ^ V. S. Chakravarthy, Denny Joseph e Raju S. Bapi, What do the basal ganglia do? A modeling perspective, in Biological Cybernetics, vol. 103, n. 3, 2010, pp. 237–53, DOI:10.1007/s00422-010-0401-y, PMID 20644953.
- ^ Cameron IG, Watanabe M, Pari G, Munoz DP, Executive impairment in Parkinson's disease: response automaticity and task switching, in Neuropsychologia, vol. 48, n. 7, Neuropsychologia, June 2010, pp. 1948–57, DOI:10.1016/j.neuropsychologia.2010.03.015, PMID 20303998.
- ^ D. Inta, A. Meyer-Lindenberg e P. Gass, Alterations in Postnatal Neurogenesis and Dopamine Dysregulation in Schizophrenia: A Hypothesis, in Schizophrenia Bulletin, vol. 37, n. 4, 2010, pp. 674–80, DOI:10.1093/schbul/sbq134, PMC 3122276, PMID 21097511.
- ^ Marín & Rubenstein. (2001). A Long, Remarkable Journey: Tangential Migration in the Telencephalon. Nature Reviews Neuroscience, 2.
- ^ Regina Bailey, Divisions of the Brain, su biology.about.com, about.com. URL consultato il 30 novembre 2010 (archiviato il 2 December 2010).
- ^ John Hall, Guyton and Hall textbook of medical physiology, 12th, Philadelphia, Pa., Saunders/Elsevier, 2011, p. 690, ISBN 978-1-4160-4574-8.
- ^ Pieter Voorn, Louk J. M. J. Vanderschuren, Henk J. Groenewegen, Trevor W. Robbins e Cyriel M. A. Pennartz, Putting a spin on the dorsal-ventral divide of the striatum, in Trends in Neurosciences, vol. 27, n. 8, 1º agosto 2004, pp. 468–474, DOI:10.1016/j.tins.2004.06.006, ISSN 0166-2236, PMID 15271494.
- ^ AC Burton, K Nakamura e MR Roesch, From ventral-medial to dorsal-lateral striatum: neural correlates of reward-guided decision-making., in Neurobiology of Learning and Memory, vol. 117, January 2015, pp. 51–9, DOI:10.1016/j.nlm.2014.05.003, PMC 4240773, PMID 24858182.
- ^ José L. Lanciego, Natasha Luquin e José A. Obeso, Functional Neuroanatomy of the Basal Ganglia, in Cold Spring Harbor Perspectives in Medicine, vol. 2, n. 12, 22 gennaio 2017, p. a009621, DOI:10.1101/cshperspect.a009621, ISSN 2157-1422, PMC 3543080, PMID 23071379.
- ^ Sarah Threlfell e Stephanie Jane Cragg, Dopamine Signaling in Dorsal Versus Ventral Striatum: The Dynamic Role of Cholinergic Interneurons, in Frontiers in Systems Neuroscience, vol. 5, 3 marzo 2011, DOI:10.3389/fnsys.2011.00011, ISSN 1662-5137, PMC 3049415, PMID 21427783.
- ^ Sergi Ferré, Carme Lluís, Zuzana Justinova, César Quiroz, Marco Orru, Gemma Navarro, Enric I Canela, Rafael Franco e Steven R Goldberg, Adenosine–cannabinoid receptor interactions. Implications for striatal function, in British Journal of Pharmacology, vol. 160, n. 3, 22 gennaio 2017, pp. 443–453, DOI:10.1111/j.1476-5381.2010.00723.x, ISSN 0007-1188, PMC 2931547, PMID 20590556.
- ^ Suzanne N. Haber, Neuroanatomy of Reward: A View from the Ventral Striatum, su Neurobiology of Sensation and Reward, CRC Press/Taylor & Francis, 1º gennaio 2011. URL consultato il 9 marzo 2017.
- ^ Jennifer L. Robinson, Angela R. Laird, David C. Glahn, John Blangero, Manjit K. Sanghera, Luiz Pessoa, P. Mickle Fox, Angela Uecker, Gerhard Friehs, Keith A. Young, Jennifer L. Griffin, William R. Lovallo e Peter T. Fox, The functional connectivity of the human caudate: An application of meta-analytic connectivity modeling with behavioral filtering, in NeuroImage, vol. 60, n. 1, 23 gennaio 2017, pp. 117–129, DOI:10.1016/j.neuroimage.2011.12.010, ISSN 1053-8119, PMC 3288226, PMID 22197743.
- ^ Direct and indirect pathways of basal ganglia: a critical reappraisal, in Nature Neuroscience, vol. 17, n. 8, 1º August 2014, pp. 1022–1030, DOI:10.1038/nn.3743.
- ^ a b The cortico-basal ganglia-thalamocortical circuit with synaptic plasticity. II. Mechanism of synergistic modulation of thalamic activity via the direct and indirect pathways through the basal ganglia, in Bio Systems, vol. 59, n. 1, 1º January 2001, pp. 7–14, DOI:10.1016/s0303-2647(00)00135-0.
- ^ a b c d Computational models of basal-ganglia pathway functions: focus on functional neuroanatomy, in Frontiers in Systems Neuroscience, vol. 7, 30 December 2013, DOI:10.3389/fnsys.2013.00122.
- ^ Changing Views of Basal Ganglia Circuits and Circuit Disorders, in Clinical EEG and Neuroscience, vol. 41, n. 2, 15 January 2017, pp. 61–67.
- ^ Update on models of basal ganglia function and dysfunction, in Parkinsonism & Related Disorders, vol. 15, Suppl 3, 15 January 2017, pp. S237–S240, DOI:10.1016/S1353-8020(09)70822-3.