Utente:Grasso Luigi/sanbox1/nitrosilazoturo
| Nitrosilazoturo (trans) | |
|---|---|
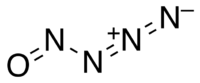 | |
| Nome IUPAC | |
| Nitrosilazoturo [1][2] | |
| Abbreviazioni | |
| N4O | |
| Nomi alternativi | |
| Azoturo di nitrosile Ossido di tetranitrogeno | |
| Caratteristiche generali | |
| Formula bruta o molecolare | N4O |
| Massa molecolare (u) | 72.03 [3] |
| Aspetto | Solido giallo pallido [4] |
| Numero CAS | Immagine_3D |
| PubChem | 18974641 |
| SMILES | [N-]=[N+]=NN=O |
| Proprietà chimico-fisiche | |
| Temperatura di fusione | −60 °C a −55 °C[5] −59 °C[6] |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | --- |
Il nitrosilazoturo è un ossido di azoto altamente instabile, con formula chimica N4O. E' un composto inorganico a legame covalente delle pozioni-molecole di azoturo e di nitrosile. Il contenuto di azoto nella molecola è del 77,79 %.
Sintesi[modifica | modifica wikitesto]
La prima sintesi fu effettuata nel 1958 dal chimico H. W. Lucien. Tale sintesi avviene tramite la seguente reazione di azoturo di sodio e nitrosilcloruro a bassa temperatura:[4][5]
Sotto −50 °C, il composto esiste come un solido giallo pallido, nella forma d'isomero geometrico tipo trans. Il prodotto è ottenuto per distillazione sotto vuoto dalla miscela di reazione.
Sopra questa temperatura, si decompone in ossido nitroso (N2O) e azoto molecolare (N2):
Invece del nitrosilcloruro si possono usare come fonti di NO, l'acido nitrosilsolforico oppure l'acido nitroso.[5]
Proprietà[modifica | modifica wikitesto]
La pressione di vapore in funzione della T è data dall'equazione di Antoine come lg(P) = −A/T+B (P in Torr, T in Kelvin) con A = 1215,6 e B = 7,306.[5] Per estrapolazione, è possibile stimare un normale punto di ebollizione della pressione alla temperatura T=1,5 °C. Questo punto non può essere raggiunto praticamente perché abbiamo detto che il composto si decompone sopra a -50 °C. Un calcolo ab initio di chimica quantistica ha rivelato un calore fortemente esotermico di reazione con -381 kJ · mol-1 a -50 °C.
La caratterizzazione è stata effettuata mediante spettroscopia infrarossa[5] e Raman[4], per cui le bande misurate si accordano bene con i valori teorici calcolati per un isomero geometrico trans. I calcoli chimico-quantistici hanno rivelato un isomero di tipo cis a energia di 4,2 kJ · mol-1 e un isomero di struttura aromatico di anello 6π più stabile intorno a 54,4 kJ · mol-1. Per la reazione di ciclizzazione, si dovrebbe applicare un'energia di attivazione molto elevata di 205 kJ · mol-1 a causa della flessione della funzione dell'azoturo. [4]
Questo può essere visto come una ragione per cui il nitrosilazoturo è così stabile e può essere isolato a basse temperature. La forma ciclica si decompone rapidamente come visto precedentemente.
Note[modifica | modifica wikitesto]
- ^ Nomenclature of Inorganic Chemistry : IUPAC Recommendations 2005 (Red Book), Cambridge, The Royal Society of Chemistry, 2005, ISBN 978-0-85404-438-2.
- ^ (EN) PubChem Compound, AC1L1C0X - Compound Summary, su pubchem.ncbi.nlm.nih.gov, National Center for Biotechnology Information, 25 Marzo 2005. URL consultato il 13 Ottobre 2011.
- ^ (EN) IUPAC Commission on Isotopic Abundances and Atomic Weights, Atomic weights of the elements 2017, su Queen Mary University of London.
- ^ a b c d Schulz, A.; Tornieporth-Oetting, I.C.; Klapötke, T.M.: Nitrosyl azide, N4O, an intrinsically unstable oxide of nitrogen in Angew. Chem. Int. Ed. 32 (1993) 1610–1612; DOI: 10.1002/anie.199316101.
- ^ a b c d e Lucien, H.W.: The preparation and properties of nitrosyl azide in J. Am. Chem. Soc. 80 (1958) 4458–4460,DOI: 10.1021/ja01550a004.
- ^ (DE) Römpp Online, Stickstoffoxide, su roempp.thieme.de, Georg Thieme Verlag, 17. April 2014.
- ^ Questa sostanza non è stata ancora classificata in termini di pericolosità o una fonte attendibile e stimabile non è stata ancora trovata.
Bibliografia[modifica | modifica wikitesto]
- Cotton, F. Albert & Geoffrey Wilkinson, Advanced Inorganic Chemistry, 6th, New York, John Wiley & Sons, 1999, p. 331, ISBN 0-471-19957-5.




