Tenofovir
| Tenofovir | |
|---|---|
 | |
| Nome IUPAC | |
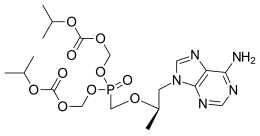
| [[(2R)-1-(6-amminopurin-9-il)propan-2-il]ossimetil-(propan-2-ilossicarbonilossimetossi)fosforil]ossimethilpropan-2-il carbonato ;acido (E)-but-2-enedioico | |
| Nomi alternativi | |
| Viread | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C23H34N5O14P |
| Massa molecolare (u) | 635.514922 g/mol |
| Numero CAS | |
| Numero EINECS | 604-571-2 |
| PubChem | 464205 |
| DrugBank | DB14126 |
| SMILES | CC(CN1C=NC2=C1N=CN=C2N)OCP(=O)(O)O |
| Indicazioni di sicurezza | |
Tenofovir disoproxil fumarato (TDF) è un farmaco appartenente alla classe dei cosiddetti antiretrovirali, cioè dei nucleosidi e nucleotidi inibitori della transcrittasi inversa.[1] In Italia il farmaco è venduto dalla società farmaceutica Gilead con il nome commerciale di Viread, nella forma farmaceutica di compresse da 245 mg di tenofovir disoproxil, come sale fumarato. Tenofovir è inoltre disponibile in una associazione fissa con l'emtricitabina, prodotto con il nome commerciale di Truvada, in dose giornaliera. Emtricitabina è venduto anche come singolo principio attivo con il nome di Emtriva, anche in questo caso commercializzato da Gilead. Atripla è invece una dose fissa formata dalla combinazione di tenofovir, emtricitabina ed efavirenz (Sustiva, venduto dalla Bristol-Myers Squibb. Questo farmaco è stato approvato dalla FDA il 12 luglio 2006, ed è adesso disponibile, a condizione che venga data una singola dose al giorno nel trattamento dell'infezione da HIV.
Storia[modifica | modifica wikitesto]
Tenofovir è stato scoperto grazie a un grande impegno collaborativo di ricerca tra il Dott. Antonin Holý, dell'Institute of Organic Chemistry and Biochemistry, Accademia delle Scienze della Repubblica Ceca a Praga, e il Dott. Erik Declercq, Rega Institute for Medical Research, Università Cattolica di Leuven, Belgio. Il Tenofovir è stato approvato dalla Food and Drug Administration (FDA) il 26 ottobre 2001. In Europa l'European Medicines Agency (EMEA) lo ha anche approvato per la cura dell'epatite B.
Farmacodinamica[modifica | modifica wikitesto]
Tenofovir è un analogo nucleotidico (cioè un nucleoside già fosforilato) che inibisce la transcrittasi inversa di HIV-1 e le HBV polimerasi virali, risultando pertanto attivo sia contro il virus HIV-1 che contro HBV. Tenofovir disoproxil viene assorbito e convertito a tenofovir, grazie ad alcune esterasi plasmatiche, quindi viene inglobato nelle cellule e successivamente sottoposto a fosforilazione dando luogo al difosfato, il quale compete con il normale substrato deossiadenosina-5-trifosfato, inibendo perciò in modo competitivo la transcriptasi inversa.[2]
Si ricorda che la transcrittasi inversa è l'enzima che catalizza la trascrizione di RNA in DNA, l'inverso del normale processo di trascrizione. Questo enzima si trova in alcuni virus patogeni, denominati appunto retrovirus, ed in particolare è un enzima fondamentale per la replicazione di HIV.
Farmacocinetica[modifica | modifica wikitesto]
In seguito a somministrazione per via orale tenofovir disoproxil viene rapidamente assorbito dal tratto gastrointestinale e quindi convertito ad opera delle esterasi plasmatiche in tenofovir. La concentrazioni plasmatica massima (Cmax) di tenofovir si osserva entro 1 ora (Tmax)dall'assunzione del farmaco a stomaco vuoto ed entro 2 ore quando venga assunto con il cibo. La biodisponibilità orale nei pazienti a digiuno si aggira intorno al 25%.[3][4] Tenofovir si distribuisce nella maggioranza dei tessuti biologici, ed in particolare nel rene, nel fegato e nell'intestino. L'emivita del farmaco si aggira intorno alle 17 ore.[5] Tenofovir viene eliminato soprattutto per via renale sia per filtrazione che a seguito di un sistema di trasporto tubulare attivo. A seguito di una somministrazione endovenosa circa il 70-80% della dose viene escreta non modificata nell'urina. La somministrazione in soggetti affetti da insufficienza renale comporta picchi di concentrazioni plasmatiche più elevate rispetto ai soggetti con normale funzione renale, ma le implicazioni cliniche di ciò non sono note.[6]
Usi clinici[modifica | modifica wikitesto]
Tenofovir è consigliato, in combinazione con altri agenti antiretrovirali, nel trattamento dell'infezione da virus HIV-1, negli adulti.[7] Questa indicazione è basata sulla valutazione delle concentrazioni plasmatiche di HIV-1 e sulla conta delle cellule CD4, in studi controllati eseguiti sia su soggetti mai precedentemente trattati (soggetti "naive", letteralmente nuovi, primitivi) che su adulti che in precedenza erano stati sottoposti ad altri protocolli di trattamento.[8][9]
Non ci sono studi clinici che hanno dato risultati dimostrativi sugli effetti del tenofovir nella progressione della malattia.
Tenofovir è anche indicato per la terapia dell'epatite B cronica, sia in soggetti con evidenza di malattia epatica compensata con elevati livelli di transaminasi (in particolare ALT) e quadro istologico di infiammazione attiva o fibrosi, che in pazienti con malattia epatica scompensata.[10][11][12]
Effetti collaterali ed indesiderati[modifica | modifica wikitesto]
Gli effetti avversi più frequentemente associati con il trattamento con tenofovir includono astenia, capogiro, cefalea, ed effetti gastrointestinali quali nausea, vomito, diarrea. Con una frequenza inferiore si possono registrare aumento delle transaminasi (ALT ed AST), steatosi epatica, epatite acuta, dolore e distensione addominale, flatulenza, rash cutaneo.[13]
Tenofovir in alcuni pazienti può causare tossicità renale, particolarmente in quei soggetti che richiedono dosaggi elevati. In particolare può dar luogo a insufficienza renale acuta, sindrome di Fanconi, proteinuria o necrosi tubulare.
Questi effetti collaterali sono dovuti all'accumulo del farmaco nei tubuli prossimali renali.
Controindicazioni[modifica | modifica wikitesto]
La principale controindicazione all'utilizzo del farmaco è rappresentata dall'ipersensibilità nota al principio attivo oppure ad uno qualsiasi degli eccipienti.
Dosi terapeutiche[modifica | modifica wikitesto]
Nei soggetti adulti il dosaggio consigliato di tenofovir per il trattamento dell'infezione da HIV così come per il trattamento dell'epatite B cronica è pari a 245 mg, equivalenti ad una compressa, una volta al giorno. Il farmaco deve essere assunto per os e preferibilmente con il cibo.
Interazioni[modifica | modifica wikitesto]
- La possibilità di interazioni tra tenofovir ed altri medicinali metabolizzati dal citocromo P450 è bassa.
- La co-somministrazione di tenofovir disoproxil e didanosina non è consigliata, in quanto comporta un importante incremento delle concentrazioni di didanosina, che può aumentare il rischio di reazioni avverse correlate.[14]
- Medicinali nefrotossici: la somministrazione concomitante di tenofovir disoproxil e medicinali nefrotossici quali aminoglicosidi, amfotericina B, foscarnet, ganciclovir, vancomicina, cidofovir ed altri, deve essere evitata per l'aumentato rischio di nefrotossiticità.
Note[modifica | modifica wikitesto]
- ^ HB. Fung, EA. Stone; FJ. Piacenti, Tenofovir disoproxil fumarate: a nucleotide reverse transcriptase inhibitor for the treatment of HIV infection., in Clin Ther, vol. 24, n. 10, ottobre 2002, pp. 1515-48, PMID 12462284.
- ^ SA. Grim, F. Romanelli, Tenofovir disoproxil fumarate., in Ann Pharmacother, vol. 37, n. 6, giugno 2003, pp. 849-59, PMID 12773076.
- ^ P. Barditch-Crovo, SG. Deeks; A. Collier; S. Safrin; DF. Coakley; M. Miller; BP. Kearney; RL. Coleman; PD. Lamy; JO. Kahn; I. McGowan, Phase i/ii trial of the pharmacokinetics, safety, and antiretroviral activity of tenofovir disoproxil fumarate in human immunodeficiency virus-infected adults., in Antimicrob Agents Chemother, vol. 45, n. 10, ottobre 2001, pp. 2733-9, DOI:10.1128/AAC.45.10.2733-2739.2001, PMID 11557462.
- ^ C. Lu, Y. Jia; L. Chen; Y. Ding; J. Yang; M. Chen; Y. Song; X. Sun; A. Wen, Pharmacokinetics and food interaction of a novel prodrug of tenofovir, tenofovir dipivoxil fumarate, in healthy volunteers., in J Clin Pharm Ther, dicembre 2012, DOI:10.1111/jcpt.12023, PMID 23278367.
- ^ BL. Robbins, RV. Srinivas; C. Kim; N. Bischofberger; A. Fridland, Anti-human immunodeficiency virus activity and cellular metabolism of a potential prodrug of the acyclic nucleoside phosphonate 9-R-(2-phosphonomethoxypropyl)adenine (PMPA), Bis(isopropyloxymethylcarbonyl)PMPA., in Antimicrob Agents Chemother, vol. 42, n. 3, marzo 1998, pp. 612-7, PMID 9517941.
- ^ R. Hazra, FM. Balis; AN. Tullio; E. DeCarlo; CJ. Worrell; SM. Steinberg; JF. Flaherty; K. Yale; M. Poblenz; BP. Kearney; L. Zhong, Single-dose and steady-state pharmacokinetics of tenofovir disoproxil fumarate in human immunodeficiency virus-infected children., in Antimicrob Agents Chemother, vol. 48, n. 1, gennaio 2004, pp. 124-9, PMID 14693529.
- ^ KA. Lyseng-Williamson, NA. Reynolds; GL. Plosker, Tenofovir disoproxil fumarate: a review of its use in the management of HIV infection., in Drugs, vol. 65, n. 3, 2005, pp. 413-32, PMID 15669881.
- ^ JE. Gallant, PA. Pham, Tenofovir disoproxil fumarate (Viread) for the treatment of HIV infection., in Expert Rev Anti Infect Ther, vol. 1, n. 3, ottobre 2003, pp. 415-22, PMID 15482138.
- ^ PA. Pham, JE. Gallant, Tenofovir disoproxil fumarate for the treatment of HIV infection., in Expert Opin Drug Metab Toxicol, vol. 2, n. 3, giugno 2006, pp. 459-69, DOI:10.1517/17425255.2.3.459, PMID 16863446.
- ^ G. Woo, G. Tomlinson; Y. Nishikawa; M. Kowgier; M. Sherman; DK. Wong; B. Pham; WJ. Ungar; TR. Einarson; EJ. Heathcote; M. Krahn, Tenofovir and entecavir are the most effective antiviral agents for chronic hepatitis B: a systematic review and Bayesian meta-analyses., in Gastroenterology, vol. 139, n. 4, ottobre 2010, pp. 1218-29, DOI:10.1053/j.gastro.2010.06.042, PMID 20600036.
- ^ J. Jones, J. Colquitt; J. Shepherd; P. Harris; K. Cooper, Tenofovir disoproxil fumarate for the treatment of chronic hepatitis B infection., in Health Technol Assess, 14 Suppl 1, maggio 2010, pp. 23-9, DOI:10.3310/hta14Suppl1/04, PMID 20507800.
- ^ CM. Perry, D. Simpson, Tenofovir disoproxil fumarate: in chronic hepatitis B., in Drugs, vol. 69, n. 16, novembre 2009, pp. 2245-56, DOI:10.2165/10482940-000000000-00000, PMID 19852527.
- ^ T. Chapman, J. McGavin; S. Noble, Tenofovir disoproxil fumarate., in Drugs, vol. 63, n. 15, 2003, pp. 1597-608, PMID 12887265.
- ^ P. Pecora Fulco, MA. Kirian, Effect of tenofovir on didanosine absorption in patients with HIV., in Ann Pharmacother, vol. 37, n. 9, settembre 2003, pp. 1325-8, DOI:10.1345/aph.1C412, PMID 12921517.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Tenofovir
Wikimedia Commons contiene immagini o altri file su Tenofovir