Erlotinib: differenze tra le versioni
m corretto errore di battitura |
Nessun oggetto della modifica |
||
| Riga 1: | Riga 1: | ||
{{F|sostanze chimiche|agosto 2013}} |
|||
{{disclaimer|medico}} |
{{disclaimer|medico}} |
||
{{Composto chimico |
{{Composto chimico |
||
| Riga 27: | Riga 26: | ||
| somministrazione = Orale |
| somministrazione = Orale |
||
}} |
}} |
||
L |
L''''erlotinib''' (nome commerciale: '''Tarceva'''), prodotto dalla [[Genentech]] e commercilizzato da [[Hoffmann-La Roche|Roche]], è un farmaco utilizzato per gestire e trattare alcuni tipi di [[cancro polmonare]] non a piccole cellule e [[cancro pancreatico]] avanzato. È una medicazione appartenente alla classe degli inibitori del recettore della [[tirosin-chinasi]].<ref name=":0">{{Cita libro|nome=Jake|cognome=Carter|nome2=Prasanna|cognome2=Tadi|titolo=Erlotinib|url=http://www.ncbi.nlm.nih.gov/books/NBK554484/|accesso=2023-07-28|data=2023|editore=StatPearls Publishing}}</ref> |
||
==Farmacologia== |
|||
| ⚫ | |||
L'Erlotinib è un farmaco strutturalmente simile al [[Gefitinib]] ([[Gefitinib|Iressa]]), del quale è parente stretto. L'Erlotinib è un inibitore dei [[recettori tirosin chinasici|recettori tirosin-chinasici]], in particolare agisce inibendo il [[recettore EGF]] (il recettore del [[Fattore di crescita dell'epidermide|fattore di crescita epidermico]]). Nei tumori si registra la sovra-espressione dei recettori dei fattori di crescita e dei relativi ligandi. Questi infatti sono alcuni dei fattori che intervengono nei processi di eziopatogenesi tumorale. La stimolazione dei fattori di crescita porta ad un aumento della proliferazione cellulare con conseguente innesco della patologia. I recettori, una volta legato il ligando, si [[autofosforilazione|autofosforilano]] dando origine ad una cascata di reazioni intracellulari che portano all'attivazione di [[fattore di trascrizione|fattori di trascrizione]] che intervengono nella proliferazione cellulare. L'Erlotinib, che come il suo simile Gefitinib appartengono alla classe chimica delle [[chinazoline]], si legano alla porzione catalitica intracellulare del recettore. Mimando la struttura dell'[[Adenosina trifosfato|ATP]], ma essendo più stabili di questa, si legano al recettore inibendolo. Non viene perciò permessa l'attivazione delle reazioni cellulari, bloccando l'espansione cellulare. |
|||
=== Indicazioni d'uso === |
|||
Nel novembre [[2005]] la [[Food and Drug Administration]] (FDA) ha approvato l'utilizzo dell'Erlotinib in combinazione con la [[Gemcitabina]] per il trattamento di tumori pancreatici non operabili, in stadio avanzato e metastatici. |
|||
==== Tumore del Polmone Non a Piccole Cellule (NSCLC) ==== |
|||
Tuttavia nel 2012 uno studio italiano pubblicato sulla rivista Lancet, ha provato che questo farmaco è molto meno efficace nella cura dei tumori al polmone legati al fumo rispetto alla vecchia chemioterapia. [http://www.marionegri.it/Tumori+del+polmone+nei+fumatori_+chemioterapia+%C3%A8+pi%C3%B9+efficace+dei+farmaci+a+bersaglio+molecolare/16601,Comunicati.html] |
|||
La [[Food and Drug Administration]] ha originariamente approvato erlotinib per il trattamento del NSCLC nel novembre 2004. Secondo la American Society of Clinical Oncology, erlotinib è raccomandato come terapia di prima, seconda o terza linea nel NSCLC avanzato, a seconda delle caratteristiche del paziente. Il farmaco è raccomandato come agente di prima linea solo se il paziente ha una mutazione nota dell'[[EGFR]] (trattamento di prima linea nel NSCLC). Erlotinib può essere somministrato come terapia di seconda linea se non vi è risposta al trattamento dopo quattro cicli di trattamento o se vi è progressione della malattia durante o dopo la terapia di prima linea a base di [[cisplatino]]. Le linee guida indicano che erlotinib può essere somministrato come terapia di terza linea se vi è progressione della malattia e il paziente non ha mai assunto erlotinib o gefitinib in precedenza.<ref>{{Cita pubblicazione|nome=Christopher G.|cognome=Azzoli|nome2=Sarah|cognome2=Temin|nome3=Giuseppe|cognome3=Giaccone|data=2012-01|titolo=2011 Focused Update of 2009 American Society of Clinical Oncology Clinical Practice Guideline Update on Chemotherapy for Stage IV Non-Small-Cell Lung Cancer|rivista=Journal of Oncology Practice|volume=8|numero=1|pp=63–66|accesso=2023-07-29|doi=10.1200/JOP.2011.000374|url=https://pubmed.ncbi.nlm.nih.gov/22548014/}}</ref><ref>{{Cita pubblicazione|nome=Ajaz|cognome=Bulbul|nome2=Hatim|cognome2=Husain|data=2018|titolo=First-Line Treatment in EGFR Mutant Non-Small Cell Lung Cancer: Is There a Best Option?|rivista=Frontiers in Oncology|volume=8|pp=94|accesso=2023-07-29|doi=10.3389/fonc.2018.00094|url=https://pubmed.ncbi.nlm.nih.gov/29755953/}}</ref> L'inibitore di terza generazione della tirosin-chinasi osimertinib ha aumentato la sopravvivenza globale rispetto a erlotinib nei pazienti con NSCLC avanzato con mutazione [[EGFR]].<ref name=":0" /> |
|||
==== Tumore Pancreatico ==== |
|||
Gli studi effettuati dopo la approvazione del farmaco hanno consentito di stabilire che il farmaco è attivo '''solo''' nel caso di tumori che presentano una alterazione del gene dello EGFR. Questa mutazione è molto rara nei tumori dovuti al fumo (che sono generalmente squamosi) ed è più frequente negli adenocarcinomi, nelle donne e nei soggetti provenienti dall'estremo oriente. Oggi è quindi opportuno iniziare un trattamento con Erlotinib (o con Gefitinib) solo dopo che sia stato accertato che il tumore presenta la mutazione dello EGFR che rappresenta come detto il bersaglio (target) di questa molecola. |
|||
La [[Food and Drug Administration]] ha approvato l'erlotinib per il trattamento del tumore pancreatico nel 2005. Molte neoplasie pancreatiche nell'uomo presentano la mutazione EGFR; i pazienti con questa mutazione hanno tipicamente una prognosi peggiore. In precedenza, la monoterapia con gemcitabina era considerata il trattamento standard per il tumore pancreatico avanzato. Mentre le combinazioni di [[gemcitabina]] con altri agenti anticancro, come la terapia combinata gemcitabina e erlotinib, mostrano i risultati più promettenti. Erlotinib/gemcitabina ha dimostrato di offrire maggiori benefici rispetto alla monoterapia con gemcitabina nel tumore pancreatico localmente avanzato o [[metastatico]]. Erlotinib non è stato studiato come monoterapia nel contesto del tumore pancreatico.<ref>{{Cita pubblicazione|nome=Yuan|cognome=Wang|nome2=Guo-Fang|cognome2=Hu|nome3=Qian-Qian|cognome3=Zhang|data=2016|titolo=Efficacy and safety of gemcitabine plus erlotinib for locally advanced or metastatic pancreatic cancer: a systematic review and meta-analysis|rivista=Drug Design, Development and Therapy|volume=10|pp=1961–1972|accesso=2023-07-29|doi=10.2147/DDDT.S105442|url=https://pubmed.ncbi.nlm.nih.gov/27358556/}}</ref> |
|||
==== Off-label ==== |
|||
==Formulazioni farmaceutiche== |
|||
Attualmente non ci sono indicazioni per l'uso [[off-label]] di erlotinib.<ref name=":0" /> |
|||
Attualmente l'unica forma farmaceutica in commercio è quella in [[compressa|compresse]]. |
|||
| ⚫ | |||
| ⚫ | |||
È un inibitore reversibile di prima generazione della tirosin-chinasi dei recettori (insieme al gefitinib) che agisce principalmente sul [[Recettore del fattore di crescita dell'epidermide|recettore del fattore di crescita epidermico]] (EGFR), un membro della famiglia dei recettori ErbB. Il farmaco interagisce sia con l'EGFR di tipo selvaggio che con le varianti mutate di [[EGFR]]. La famiglia di recettori ErbB può formare omodimeri o eterodimeri, che sono spesso implicati negli effetti a valle e nella patogenesi di molti tipi di carcinoma studiati nell'uomo. Gli inibitori della [[tirosin-chinasi]] dei recettori (TKI) impediscono la fosforilazione dei loro substrati nel percorso di segnalazione cellulare. L'EGFR svolge normalmente un ruolo in molte funzioni cellulari, tra cui differenziazione, proliferazione e angiogenesi, tutte caratteristiche del cancro.<ref>{{Cita pubblicazione|nome=Nicola|cognome=Normanno|nome2=Antonella|cognome2=De Luca|nome3=Caterina|cognome3=Bianco|data=2006-01-17|titolo=Epidermal growth factor receptor (EGFR) signaling in cancer|rivista=Gene|volume=366|numero=1|pp=2–16|accesso=2023-07-29|doi=10.1016/j.gene.2005.10.018|url=https://pubmed.ncbi.nlm.nih.gov/16377102/}}</ref><ref>{{Cita pubblicazione|nome=Nicola|cognome=Normanno|nome2=Monica R.|cognome2=Maiello|nome3=Antonella|cognome3=De Luca|data=2003-01|titolo=Epidermal growth factor receptor tyrosine kinase inhibitors (EGFR-TKIs): simple drugs with a complex mechanism of action?|rivista=Journal of Cellular Physiology|volume=194|numero=1|pp=13–19|accesso=2023-07-29|doi=10.1002/jcp.10194|url=https://pubmed.ncbi.nlm.nih.gov/12447985/}}</ref> |
|||
[[Rash]] cutanei, [[diarrea]], affaticamento, [[dispnea]]. |
|||
La mutazione [[EGFR]] nel NSCLC è tipicamente una mutazione attivante. Alcune caratteristiche del paziente che rendono più probabile la presenza della mutazione [[EGFR]] includono l'assenza di storia di fumo, adenocarcinoma confermato da analisi istologica, origine etnica asiatica e sesso femminile.<ref>{{Cita pubblicazione|nome=Monic|cognome=Roengvoraphoj|nome2=Gregory J.|cognome2=Tsongalis|nome3=Konstantin H.|cognome3=Dragnev|data=2013-12|titolo=Epidermal growth factor receptor tyrosine kinase inhibitors as initial therapy for non-small cell lung cancer: focus on epidermal growth factor receptor mutation testing and mutation-positive patients|rivista=Cancer Treatment Reviews|volume=39|numero=8|pp=839–850|accesso=2023-07-29|doi=10.1016/j.ctrv.2013.05.001|url=https://pubmed.ncbi.nlm.nih.gov/23768755/}}</ref> |
|||
| ⚫ | |||
| ⚫ | |||
Secondo le indicazioni rilasciate dal produttore, i seguenti sono gli [[effetti avversi]] segnalati che si verificano più frequentemente in pazienti trattati con erlotinib rispetto al [[placebo]]. Gli effetti avversi che si sono verificati in meno del 3% dei pazienti non sono di rilevanza clinica, mentre i piu frequenti sono stati: [[affaticamento]] (9,0%), [[diarrea]] (20,3%), [[anoressia]] (9,2%), [[Perdita di peso|calo ponderale]] (3,9%), [[rash cutaneo]] (49%), [[prurito]] (7,4%), [[acne]] (6,2%), [[dermatite]] acneiforme (4,6%), [[xerosi]] (4,4%) e [[paronichia]] (3,9%).<ref name=":0" /> |
|||
Gli effetti avversi di erlotinib sono simili al resto della famiglia degli inibitori della tirosin-chinasi dell'EGFR, con i più notevoli essere [[diarrea]] e [[rash]] e [[dolore toracico]]. Uno studio clinico multicentrico, in aperto, di fase 3 ha dimostrato che il 13% dei pazienti trattati con erlotinib rispetto al 0% trattato con [[chemioterapia]] standard ha sviluppato un rash durante il trattamento. Un altro studio di fase 3 in aperto ha riscontrato che il 50% del gruppo di trattamento con erlotinib ha segnalato un rash rispetto al 5% nel gruppo di chemioterapia. Questo studio ha anche osservato che l'18% dei pazienti nel gruppo di trattamento con erlotinib ha riportato diarrea rispetto al 2% nel gruppo di chemioterapia. Si deve notare che gli eventi avversi gravi sono meno comuni nei gruppi di trattamento con erlotinib rispetto ai gruppi di trattamento con chemioterapia standard.<ref>{{Cita pubblicazione|nome=Rafael|cognome=Rosell|nome2=Enric|cognome2=Carcereny|nome3=Radj|cognome3=Gervais|data=2012-03|titolo=Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial|rivista=The Lancet. Oncology|volume=13|numero=3|pp=239–246|accesso=2023-07-29|doi=10.1016/S1470-2045(11)70393-X|url=https://pubmed.ncbi.nlm.nih.gov/22285168/}}</ref> |
|||
==== Effetti Avversi Gravi ==== |
|||
Secondo il foglio illustrativo del produttore, i seguenti sono gli eventi avversi gravi segnalati nei pazienti che assumono erlotinib consistono in [[insufficienza renale acuta]], [[aritmie cardiache]] nei pazienti che assumono erlotinib con gemcitabina, [[epatotossicità]] e [[sindrome epatorenale]], elevazioni del [[tempo di protrombina]] nei pazienti che assumono erlotinib e [[warfarin]], disturbi cutanei esfoliativi, [[Perforazione gastrointestinale|perforazioni gastrointestinali]], perforazione corneale, [[Infarto miocardico acuto|infarto miocardico]], [[ischemia miocardica]], [[ictus]] e [[anemia emolitica microangiopatica]] con [[trombocitopenia]].<ref name=":0" /> |
|||
=== Tossicità === |
|||
Secondo il produttore, i pazienti affetti da cancro tollerano una dose settimanale totale di 1600 mg di erlotinib senza tossicità. Nel caso di [[sovradosaggio]] di erlotinib, la raccomandazione è per il trattamento sintomatico, nonché per la sospensione della terapia.<ref name=":0" /> |
|||
==Note== |
|||
<references /> |
|||
| ⚫ | |||
{{interprogetto}} |
{{interprogetto}} |
||
Versione attuale delle 12:22, 29 lug 2023
| Erlotinib | |
|---|---|
 | |
 | |
| Caratteristiche generali | |
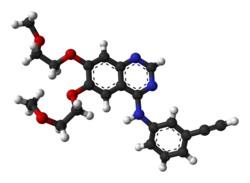
| Formula bruta o molecolare | C22H23N3O4 |
| Massa molecolare (u) | 393,436 |
| Numero CAS | |
| Numero EINECS | 689-196-2 |
| Codice ATC | L01 |
| PubChem | 176870 |
| DrugBank | DB00530 e DBDB00530 |
| SMILES | COCCOC1=C(C=C2C(=C1)C(=NC=N2)NC3=CC=CC(=C3)C#C)OCCOC |
| Dati farmacologici | |
| Modalità di somministrazione | Orale |
| Indicazioni di sicurezza | |
L'erlotinib (nome commerciale: Tarceva), prodotto dalla Genentech e commercilizzato da Roche, è un farmaco utilizzato per gestire e trattare alcuni tipi di cancro polmonare non a piccole cellule e cancro pancreatico avanzato. È una medicazione appartenente alla classe degli inibitori del recettore della tirosin-chinasi.[1]
Farmacologia
[modifica | modifica wikitesto]Indicazioni d'uso
[modifica | modifica wikitesto]Tumore del Polmone Non a Piccole Cellule (NSCLC)
[modifica | modifica wikitesto]La Food and Drug Administration ha originariamente approvato erlotinib per il trattamento del NSCLC nel novembre 2004. Secondo la American Society of Clinical Oncology, erlotinib è raccomandato come terapia di prima, seconda o terza linea nel NSCLC avanzato, a seconda delle caratteristiche del paziente. Il farmaco è raccomandato come agente di prima linea solo se il paziente ha una mutazione nota dell'EGFR (trattamento di prima linea nel NSCLC). Erlotinib può essere somministrato come terapia di seconda linea se non vi è risposta al trattamento dopo quattro cicli di trattamento o se vi è progressione della malattia durante o dopo la terapia di prima linea a base di cisplatino. Le linee guida indicano che erlotinib può essere somministrato come terapia di terza linea se vi è progressione della malattia e il paziente non ha mai assunto erlotinib o gefitinib in precedenza.[2][3] L'inibitore di terza generazione della tirosin-chinasi osimertinib ha aumentato la sopravvivenza globale rispetto a erlotinib nei pazienti con NSCLC avanzato con mutazione EGFR.[1]
Tumore Pancreatico
[modifica | modifica wikitesto]La Food and Drug Administration ha approvato l'erlotinib per il trattamento del tumore pancreatico nel 2005. Molte neoplasie pancreatiche nell'uomo presentano la mutazione EGFR; i pazienti con questa mutazione hanno tipicamente una prognosi peggiore. In precedenza, la monoterapia con gemcitabina era considerata il trattamento standard per il tumore pancreatico avanzato. Mentre le combinazioni di gemcitabina con altri agenti anticancro, come la terapia combinata gemcitabina e erlotinib, mostrano i risultati più promettenti. Erlotinib/gemcitabina ha dimostrato di offrire maggiori benefici rispetto alla monoterapia con gemcitabina nel tumore pancreatico localmente avanzato o metastatico. Erlotinib non è stato studiato come monoterapia nel contesto del tumore pancreatico.[4]
Off-label
[modifica | modifica wikitesto]Attualmente non ci sono indicazioni per l'uso off-label di erlotinib.[1]
Meccanismo d'azione
[modifica | modifica wikitesto]È un inibitore reversibile di prima generazione della tirosin-chinasi dei recettori (insieme al gefitinib) che agisce principalmente sul recettore del fattore di crescita epidermico (EGFR), un membro della famiglia dei recettori ErbB. Il farmaco interagisce sia con l'EGFR di tipo selvaggio che con le varianti mutate di EGFR. La famiglia di recettori ErbB può formare omodimeri o eterodimeri, che sono spesso implicati negli effetti a valle e nella patogenesi di molti tipi di carcinoma studiati nell'uomo. Gli inibitori della tirosin-chinasi dei recettori (TKI) impediscono la fosforilazione dei loro substrati nel percorso di segnalazione cellulare. L'EGFR svolge normalmente un ruolo in molte funzioni cellulari, tra cui differenziazione, proliferazione e angiogenesi, tutte caratteristiche del cancro.[5][6]
La mutazione EGFR nel NSCLC è tipicamente una mutazione attivante. Alcune caratteristiche del paziente che rendono più probabile la presenza della mutazione EGFR includono l'assenza di storia di fumo, adenocarcinoma confermato da analisi istologica, origine etnica asiatica e sesso femminile.[7]
Effetti avversi
[modifica | modifica wikitesto]Secondo le indicazioni rilasciate dal produttore, i seguenti sono gli effetti avversi segnalati che si verificano più frequentemente in pazienti trattati con erlotinib rispetto al placebo. Gli effetti avversi che si sono verificati in meno del 3% dei pazienti non sono di rilevanza clinica, mentre i piu frequenti sono stati: affaticamento (9,0%), diarrea (20,3%), anoressia (9,2%), calo ponderale (3,9%), rash cutaneo (49%), prurito (7,4%), acne (6,2%), dermatite acneiforme (4,6%), xerosi (4,4%) e paronichia (3,9%).[1]
Gli effetti avversi di erlotinib sono simili al resto della famiglia degli inibitori della tirosin-chinasi dell'EGFR, con i più notevoli essere diarrea e rash e dolore toracico. Uno studio clinico multicentrico, in aperto, di fase 3 ha dimostrato che il 13% dei pazienti trattati con erlotinib rispetto al 0% trattato con chemioterapia standard ha sviluppato un rash durante il trattamento. Un altro studio di fase 3 in aperto ha riscontrato che il 50% del gruppo di trattamento con erlotinib ha segnalato un rash rispetto al 5% nel gruppo di chemioterapia. Questo studio ha anche osservato che l'18% dei pazienti nel gruppo di trattamento con erlotinib ha riportato diarrea rispetto al 2% nel gruppo di chemioterapia. Si deve notare che gli eventi avversi gravi sono meno comuni nei gruppi di trattamento con erlotinib rispetto ai gruppi di trattamento con chemioterapia standard.[8]
Effetti Avversi Gravi
[modifica | modifica wikitesto]Secondo il foglio illustrativo del produttore, i seguenti sono gli eventi avversi gravi segnalati nei pazienti che assumono erlotinib consistono in insufficienza renale acuta, aritmie cardiache nei pazienti che assumono erlotinib con gemcitabina, epatotossicità e sindrome epatorenale, elevazioni del tempo di protrombina nei pazienti che assumono erlotinib e warfarin, disturbi cutanei esfoliativi, perforazioni gastrointestinali, perforazione corneale, infarto miocardico, ischemia miocardica, ictus e anemia emolitica microangiopatica con trombocitopenia.[1]
Tossicità
[modifica | modifica wikitesto]Secondo il produttore, i pazienti affetti da cancro tollerano una dose settimanale totale di 1600 mg di erlotinib senza tossicità. Nel caso di sovradosaggio di erlotinib, la raccomandazione è per il trattamento sintomatico, nonché per la sospensione della terapia.[1]
Note
[modifica | modifica wikitesto]- ^ a b c d e f Jake Carter e Prasanna Tadi, Erlotinib, StatPearls Publishing, 2023. URL consultato il 28 luglio 2023.
- ^ Christopher G. Azzoli, Sarah Temin e Giuseppe Giaccone, 2011 Focused Update of 2009 American Society of Clinical Oncology Clinical Practice Guideline Update on Chemotherapy for Stage IV Non-Small-Cell Lung Cancer, in Journal of Oncology Practice, vol. 8, n. 1, 2012-01, pp. 63–66, DOI:10.1200/JOP.2011.000374. URL consultato il 29 luglio 2023.
- ^ Ajaz Bulbul e Hatim Husain, First-Line Treatment in EGFR Mutant Non-Small Cell Lung Cancer: Is There a Best Option?, in Frontiers in Oncology, vol. 8, 2018, pp. 94, DOI:10.3389/fonc.2018.00094. URL consultato il 29 luglio 2023.
- ^ Yuan Wang, Guo-Fang Hu e Qian-Qian Zhang, Efficacy and safety of gemcitabine plus erlotinib for locally advanced or metastatic pancreatic cancer: a systematic review and meta-analysis, in Drug Design, Development and Therapy, vol. 10, 2016, pp. 1961–1972, DOI:10.2147/DDDT.S105442. URL consultato il 29 luglio 2023.
- ^ Nicola Normanno, Antonella De Luca e Caterina Bianco, Epidermal growth factor receptor (EGFR) signaling in cancer, in Gene, vol. 366, n. 1, 17 gennaio 2006, pp. 2–16, DOI:10.1016/j.gene.2005.10.018. URL consultato il 29 luglio 2023.
- ^ Nicola Normanno, Monica R. Maiello e Antonella De Luca, Epidermal growth factor receptor tyrosine kinase inhibitors (EGFR-TKIs): simple drugs with a complex mechanism of action?, in Journal of Cellular Physiology, vol. 194, n. 1, 2003-01, pp. 13–19, DOI:10.1002/jcp.10194. URL consultato il 29 luglio 2023.
- ^ Monic Roengvoraphoj, Gregory J. Tsongalis e Konstantin H. Dragnev, Epidermal growth factor receptor tyrosine kinase inhibitors as initial therapy for non-small cell lung cancer: focus on epidermal growth factor receptor mutation testing and mutation-positive patients, in Cancer Treatment Reviews, vol. 39, n. 8, 2013-12, pp. 839–850, DOI:10.1016/j.ctrv.2013.05.001. URL consultato il 29 luglio 2023.
- ^ Rafael Rosell, Enric Carcereny e Radj Gervais, Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial, in The Lancet. Oncology, vol. 13, n. 3, 2012-03, pp. 239–246, DOI:10.1016/S1470-2045(11)70393-X. URL consultato il 29 luglio 2023.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Erlotinib
Wikimedia Commons contiene immagini o altri file su Erlotinib