Cheratocono
| Cheratocono | |
|---|---|
 | |
| Malattia rara | |
| Cod. esenz. SSN | RF0280 |
| Specialità | oftalmologia e optometria |
| Classificazione e risorse esterne (EN) | |
| OMIM | 614628, 148300, 614622, 614629, 608932, 608586, 614623 e 609271 |
| MeSH | D007640 |
| MedlinePlus | 001013 |
| eMedicine | 1194693 |
Il cheratocono (dal greco keratos="cornea" e konos="cono" e spesso abbreviato in ambito medico come KC) è una malattia degenerativa della cornea che porta ad una progressiva deformazione della cornea stessa. Può colpire uno o, nella maggior parte dei casi, entrambi gli occhi. L'incidenza è mediamente di circa 1 persona su 2000. Si ipotizza che sia causata da fattori genetici, ambientali o disfunzioni ormonali.
Caratteristiche[modifica | modifica wikitesto]
A causa di un'anormalità strutturale delle fibre di collagene che compongono lo stroma corneale, la cornea stessa si deforma progressivamente, assottigliandosi ed allungandosi verso l'esterno (una distrofia corneale detta ectasia) per via della sua ridotta robustezza sotto pressione intraoculare. Si verifica quindi una curvatura corneale irregolare con perdita di sfericità che presenta il tipico apice di forma conica.
Nei casi più gravi la cornea può mostrare inoltre alcune opacità, dovute ad un'alterata disposizione delle proteine corneali, che causano delle micro-cicatrici che distorcono le immagini e - in taluni casi - riducono il passaggio della luce, dando un fastidioso senso di abbagliamento.
Eziologia[modifica | modifica wikitesto]
Sembra sia in relazione a disfunzioni delle ghiandole endocrine (ipofisi, tiroide). Può esistere anche una predisposizione ereditaria. Comunemente al momento dell'esordio non è in relazione ad altre patologie sistemiche eventualmente presenti, sebbene secondo il Clek Study (Collaborative Longitudinal Evaluation of Keratoconus), è presente un'atopia nel 53% dei casi. Può essere associata alla amaurosi congenita di Leber (30% dei casi in pazienti con più di 15 anni).
Esordio e decorso[modifica | modifica wikitesto]
La malattia insorge di solito durante la pubertà o l'adolescenza (sono anche descritti rarissimi casi congeniti) ed ha carattere maggiormente progressivo fino a 45 anni per poi arrestarsi spontaneamente. Il decorso è spesso caratterizzato da primi sintomi di abbagliamento alla luce e quindi da riduzione dell'acuità visiva causata dall'irregolarità della cornea. Se diagnosticato in tempo grazie ad indagini non invasive, come la topografia corneale, il cheratocono può essere efficacemente curato con la procedura di cross-linking corneale. Il cheratocono rappresenta la prima causa di trapianto della cornea nelle persone under 40 in tutto il mondo, per tale motivo è fondamentale una diagnosi precoce ed un trattamento conservativo e tempestivo con il cross-linking corneale.
Sintomi[modifica | modifica wikitesto]
La curvatura irregolare creatasi modifica il potere refrattivo della cornea, producendo distorsioni delle immagini e una visione confusa sia da vicino che da lontano. Si registrano infatti miopia associata ad astigmatismo irregolare congiuntamente ad aberrazioni di altro tipo, tipicamente la "coma" (ovvero striscia luminosa a forma di cometa) e l'aberrazione sferica. Il paziente lamenta pertanto una diminuzione del visus e della qualità visiva in generale, soprattutto da lontano ed in condizioni di scarsa luminosità ambientale. Col progredire della malattia la qualità della visione continua a peggiorare irreversibilmente, con aloni e sbavature intorno alle sorgenti luminose. In caso di marcata evoluzione, l'occhio, se visto di profilo, mostra una sporgenza conica caratteristica della superficie corneale.
Possono inoltre verificarsi affaticamento della vista, dolore e/o bruciore oculare, diplopia, fotofobia, lacrimazione alterata, cefalea e senso di abbagliamento persistente dovuto alle eventuali cicatrici corneali.
Cheratocono acuto[modifica | modifica wikitesto]
Talvolta può verificarsi la rottura improvvisa della membrana di Descemet, con imbibizione dello stroma da parte dell'umor acqueo (idrope corneale) e conseguente edema. Durante questa fase il paziente riporta un brusco calo del visus spesso accompagnato da dolore. La situazione può risolversi spontaneamente nel giro di poche settimane, altrimenti bisogna fare ricorso all'intervento di diatermia corneale.
Diagnosi[modifica | modifica wikitesto]
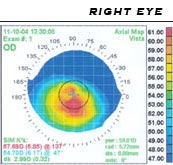
Il primo sospetto di cheratocono è solitamente quello di una miopia associata ad un astigmatismo progressivo o irregolare. Le tecniche diagnostiche si avvalgono di:
- oftalmoscopia diretta: il riflesso retinico risulta più chiaro nella zona periferica e più scuro dove è posizionato il cono
- oftalmometro di Javal: con cui valutare l'angolo di Amsler
- retinoscopio a striscia: evidenzia il riflesso a forbice
- lampada a fessura o biomicroscopio: permette di ricercare i seguenti reperti:
- l'anello di Fleischer (da non confondersi con l'anello di Kayser-Fleischer). Tale reperto è patognomonico (presente nel 50% dei KC): è un anello giallo-verdastro dovuto all'accumulo di emosiderina nelle cellule epiteliali basali
- opacità subepiteliali (che si formano da rotture della membrana di Bowman)
- assottigliamento stromale: l'assottigliamento in genere è maggiore a livello dell'apice del cono, a meno che questo non sia molto periferico
- strie di Vogt (tardive): strie stromali che scompaiono alla digitopressione, hanno aspetto verticale
- segno di Munson (avanzato): deformazione della rima palpebrale inferiore da parte del cono e si visualizza facendo guardare verso il basso il soggetto
- pachimetria: evidenzia una riduzione dello spessore della cornea nell'area interessata dal cono; è importante anche conoscere la misura dello spessore nel punto di massimo assottigliamento ("thinnest point"), perché al di sotto di certi limiti non è possibile eseguire eventuali trattamenti conservativi di cross-linking ed aumenta il rischio di perforazione.
- topografia corneale (gold standard): studia le immagini riflesse dalla cornea quando le si antepone una serie di anelli luminosi concentrici; L'elaborazione dei dati consente la visualizzazione di una mappa (la parte in rosso corrisponde alla regione sfiancata mentre quella verde-blu le zone piatte) e di una simulazione della qualità della visione consentita da tale cornea. Permette di vedere l'aumento di curvatura (non individuabile alla lampada a fessura negli stadi iniziali) e permette dunque la diagnosi precoce anche quando è ancora asintomatica.
- aberrometria: sintomi tipici sono l'aberrazione della coma verticale e l'aberrazione sferica che porta alla percezione di immagini-fantasma, e di aloni e distorsioni intorno alle sorgenti luminose;
- microscopia confocale (Confoscan di Nidek): una sorta di esame istologico in vivo delle lesioni tipiche del KC
- immagini della cornea e del segmento anteriore ottenute con l'ecografia ad alta frequenza (UBM : ultrabiomicroscopia)
Classificazione[modifica | modifica wikitesto]
Solitamente la progressione della malattia viene suddivisa in stadi, determinati in base al quadro clinico e ai dati ottenuti dagli esami strumentali
| Stadio | Gravità | Curvatura corneale (letture medie) | Spessore corneale all'apice, stato della superficie | Visus e rifrazione, aberrazioni di alto ordine |
|---|---|---|---|---|
| Sub-clinico | Frusto | Lievemente alterata | Normale, assenza di leucomi | Normale (10/10) |
| I | Lieve | K1<48 Diottrie | Lievemente ridotto (fino ad un minimo di 500 µm), assenza di leucomi | Vizio refrattivo<5 Diottrie, 0,25 µm<RMS<1,25 µm |
| II | Moderato | K1<53 Diottrie | Ridotto (>400 µm), assenza di leucomi | Vizio refrattivo<8 Diottrie, 1,25 µm<RMS<1,5 µm |
| III | Avanzato | K1>53 Diottrie | Molto ridotto (fra i 300 µm e 400 µm), assenza di leucomi | Vizio refrattivo>8 Diottrie, RMS<2,5 µm |
| IV | Severo | K1>56 Diottrie | Rischio perforazione (circa 200 µm), presenza di leucomi | Vizio refrattivo non misurabile, RMS>2,5 µm |
Il cheratocono è classificato come malattia rara e quindi è esentabile dal ticket sanitario per prestazioni mediche ed esami.
Incidenza[modifica | modifica wikitesto]
Il cheratocono colpisce circa una persona su 2000. Generalmente è binoculare (96% dei casi)[1] anche se inizialmente la malattia può colpire un solo occhio, che, nelle fasi avanzate, risulterà il più grave dal punto di vista clinico. Ha una lieve predominanza nel sesso maschile (63,4%), secondo uno studio francese dell'Associazione specialisti lenti a contatto.
Terapia[modifica | modifica wikitesto]

Ad oggi non esistono cure farmacologiche per il cheratocono e l'unica terapia è la correzione ottica o la chirurgia. Nelle forme lievi si utilizzano occhiali convenzionali o lenti a contatto rigide o gas-permeabili per correggere il difetto visivo, ma nei casi più gravi tale correzione può essere insufficiente.
Anelli intrastromali[modifica | modifica wikitesto]
Un trattamento chirurgico relativamente recente è rappresentato dagli inserti intracorneali (ICRS). La tecnica, che migliora sensibilmente l'acuità visiva dei pazienti, consiste nell'impianto di microscopici inserti in materiale sintetico trasparente all'interno dello stroma nelle zone periferiche della cornea. Tali inserti, di forma circolare, provocano una parziale regolarizzazione della sfericità corneale.
M.A.R.K.[modifica | modifica wikitesto]
Un'ulteriore opzione è la Mini Cheratotomia Radiale Asimmetrica (M.A.R.K.), tecnica chirurgica incisionale che provoca una cicatrizzazione controllata della cornea, la quale cambia forma e spessore secondo il bisogno dell'occhio affetto da cheratocono.[1][2][3][4][5]. Questa tecnica può essere combinata con il cross-linking al fine di rinforzare ulteriormente la cornea[6]
Il cross-linking corneale[modifica | modifica wikitesto]
La tecnica originale, inventata in Germania nel 1997 presso l'università di Dresda ma diffusa solo dagli anni duemila, consiste nell'instillare delle gocce di vitamina B2 (riboflavina) sulla cornea dopo rimozione dell'epitelio (fase di imbibizione) ed esporre successivamente la cornea stessa a una luce ultravioletta (fase di irradiazione). I raggi UV-A eccitano la riboflavina comportando un rafforzamento dei legami nel collagene corneale con un conseguente irrigidimento del tessuto corneale. Gli studi clinici hanno dimostrato che nella maggior parte dei casi si riesce a bloccare l'evoluzione della malattia e, in molti di essi, si verifica una riduzione della curvatura della cornea (in media 1 diottria ad 1 anno dal trattamento). Successivamente sono state introdotte alcune innovazioni quali l'utilizzo di soluzioni a base di riboflavina ed enhancers in grado di penetrare nello strato stromale della cornea attraverso l'epitelio superficiale, rendendo non necessaria la sua rimozione preventiva (tecnica denominata epi-on). La metodica, seguendo il protocollo tedesco, presenta una percentuale molto ridotta di complicazioni (micro-opacità corneali nel 5-7% dei casi).
Alcuni oculisti italiani hanno cominciato ad apportare delle modifiche a tale protocollo, quali la iontoforesi corneale per l'applicazione attiva della riboflavina nella cornea[7] o altri protocolli di irradiazione UV-A come il protocollo Megaride[8] o più recentemente la teranostica che apre la frontiera della medicina personalizzata e di precisione al trattamento del cheratocono[9].
Dal 1º gennaio 2007, il trattamento di cross linking è stato riconosciuto a livello sia nazionale che sovranazionale (Unione europea) come terapia ufficiale. Nel corso del 2007, grazie agli eccezionali risultati riconosciuti internazionalmente, si sono moltiplicati sul territorio italiano i centri che praticano il cross-linking. Tuttavia non dappertutto viene effettuato in regime di completa gratuità, ma solo in alcune regioni dove viene rimborsato dal Servizio Sanitario Nazionale come ad esempio in Toscana, Emilia-Romagna, Lazio e Campania. È da tenere tuttavia presente che, per poter effettuare tale tecnica, ci sono dei limiti (ad esempio limiti morfologico-strutturali): il cheratocono non deve essere troppo evoluto, non devono essere presenti opacità significative della cornea nell'area centrale e lo spessore della cornea deve essere sufficiente).
Il cross-linking corneale può, in alcuni casi, essere combinato con altre procedure di chirurgia conservativa del cheratocono[10]. Il Medico Oculista individua quale paziente è idoneo all'intervento e consiglia la metodica più opportuna; prima del trattamento esegue un completo esame del bulbo oculare oltre agli approfondimenti diagnostici specifici per il cheratocono, quali la topografia corneale e la misura degli spessori (pachimetria). Come ogni altro intervento, anche il cross-linking non è scevro da possibili complicanze (es. "haze" corneale), la cui incidenza è maggiore nelle forme più avanzate della patologia ed impiegando tecniche più invasive (epi-off, elevate potenze di irradiazione).

Cheratoplastica[modifica | modifica wikitesto]
Le forme più gravi tuttavia, che conducono a uno sfiancamento e assottigliamento eccessivo della cornea (come il cheratoglobo o la degenerazione marginale pellucida) con rischio di perforazione spontanea, necessitano invece di un intervento chirurgico radicale come il trapianto di cornea. Il tessuto corneale malato viene sostituito con tessuto sano proveniente da donatore.
Cheratoplastica lamellare[modifica | modifica wikitesto]
Introdotta a partire dal 1998 e denominata DALK (Deep Anterior Lamellar Keratoplasty), consente di sostituire non l'intera cornea, ma solo gli strati più esterni, ovvero quelli affetti dalla malattia, lasciando intatto l'endotelio e la membrana di Descemet. Il vantaggio principale rispetto alla cheratoplastica tradizionale è il minor rischio di rigetto, unito a tempi di recupero più brevi.
Note[modifica | modifica wikitesto]
- ^ Da centronazionalelaser.com, su centronazionalelaser.com. URL consultato il 17 marzo 2012 (archiviato dall'url originale il 3 ottobre 2013).
- ^ Da ilgiornale.it, su ilgiornale.it. URL consultato il 17 marzo 2012 (archiviato dall'url originale il 24 maggio 2012).
- ^ Da ncbi.nlm.nih.gov.
- ^ Asymmetric radial keratotomy for the ... [J Refract Surg. 1997 May-Jun] - PubMed - NCBI.
- ^ Come curare il cheratocono a "Vivere meglio" - Comunicato - Qui Mediaset - Mediaset.it.
- ^ CRSTodayEurope.com August 2009 : Refractive Changes Following CXL (archiviato dall'url originale il 26 febbraio 2014).
- ^ (EN) Marco Lombardo, Daniela Giannini e Giuseppe Lombardo, Randomized Controlled Trial Comparing Transepithelial Corneal Cross-linking Using Iontophoresis with the Dresden Protocol in Progressive Keratoconus, in Ophthalmology, vol. 124, n. 6, 2017-06, pp. 804–812, DOI:10.1016/j.ophtha.2017.01.040. URL consultato il 14 settembre 2022.
- ^ (EN) Ciro Caruso, Robert L. Epstein e Pasquale Troiano, Topography and Pachymetry Guided, Rapid Epi-on Corneal Cross-Linking for Keratoconus: 7-year Study Results, in Cornea, vol. 39, n. 1, 2020-01, pp. 56–62, DOI:10.1097/ICO.0000000000002088. URL consultato il 14 settembre 2022.
- ^ (EN) Giuseppe Lombardo, Giuseppe Massimo Bernava e Sebastiano Serrao, Theranostic‐guided corneal cross‐linking: pre‐clinical evidence on a new treatment paradigm for keratoconus, in Journal of Biophotonics, 4 settembre 2022, DOI:10.1002/jbio.202200218. URL consultato il 14 settembre 2022.
- ^ CRSTodayEurope.com > August 2009 > Refractive Changes Following CXL (archiviato dall'url originale il 26 febbraio 2014).
- ^ Kymionis GD, Diakonis VF, Coskunseven E, Jankov M, Yoo SH, Pallikaris IG, Customized pachymetric guided epithelial debridement for corneal collagen cross linking, in BMC Ophthalmology, vol. 9, 2009, p. 10, DOI:10.1186/1471-2415-9-10, PMC 2744909, PMID 19715585.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su cheratocono
Wikimedia Commons contiene immagini o altri file su cheratocono
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) keratoconus, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- FAQ (Domande frequenti) sul cheratocono, su iapb.it. URL consultato il 1º febbraio 2013 (archiviato dall'url originale il 6 ottobre 2014).
| Controllo di autorità | Thesaurus BNCF 52698 · LCCN (EN) sh98007487 · BNF (FR) cb14473172q (data) · J9U (EN, HE) 987007551721105171 |
|---|