Utente:Grasso Luigi/sanbox1/diossirano
| Diossirano | |
|---|---|
 | |
| Nome IUPAC | |
| Diossirano [1] | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CH2O2 |
| Massa molecolare (u) | 46.03 g/mol |
| Numero CAS | Immagine_3D_Diossirano |
| PubChem | 449520 |
| SMILES | C1OO1 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| attenzione | |
| Frasi H | --- |
| Consigli P | --- |

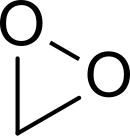
In chimica, diossirano è un composto eterociclico composto di un atomo carbonio e due di ossigeno di formula chimica H2CO2; può essere pensato come il più piccolo perossido ciclico organico. Il composto è altamente instabile e non è mai stato osservato a temperatura ambiente.
Sintesi[modifica | modifica wikitesto]
Il diossirano è altamente instabile e la maggior parte degli studi condotti sono computazionali; è stato rilevato durante la reazione a bassa temperatura (-196 °C) di etilene e ozono,[2] sebbene anche a queste temperature una tale miscela possa essere esplosiva. [3] Si ritiene che la sua formazione sia di natura radicale, procede attraverso un intermedio di Criegee. Analisi a microonde indica una lunghezza dei legami C-H, C-O e O-O di 1.090, 1.388 e 1.516 Å.[3] Il legame lungo e debole O-O (c.f. perossido di idrogeno O-O = 1.47 Å) è all'origine della sua instabilità.
Composti diossirani[modifica | modifica wikitesto]
Sostituendo gli H con radicali alchilici o arilici, otteniamo il gruppo funzionale detto diossirano, aventi la struttura R1-CO2-R2. I composti derivati detti diossirani, spesso possiedono una migliore stabilità e sono utilizzati in sintesi organica come reagenti ossidanti[4] e in particolare come intermedi catalitici chiave nella reazione detta epossidazione Shi.
Altri derivati comuni impiegati nella sintesi organica includono dimetildiossirano (forma abbreviata DMDO-DiMethylDiOxirane e formula chimica C3H6O2) e il metile(trifluorometil)diossirano più reattivo, che sono preparati come soluzioni diluite (~0.1 M) per trattamento di acetone e del chetone metiltrifluorometile, rispettivamente per DMDO e per l'altro composto, con Ossone (2KHSO5·KHSO4·K2SO4).
Difluorodiossirano, un gas (b.p ~ –80 - –90 °C), è uno dei tanti derivati diossirano stabile in forma pura a temperatura ambiente.
Note[modifica | modifica wikitesto]
- ^ Nomenclature of Inorganic Chemistry : IUPAC Recommendations 2005 (Red Book), Cambridge, The Royal Society of Chemistry, 2005, p. 315, ISBN 978-0-85404-438-2.
- ^ Identification of dioxirane (H2) in ozone-olefin reactions via microwave spectroscopy, in Chemical Physics Letters, vol. 51, n. 3, November 1977, pp. 453–456, DOI:10.1016/0009-2614(77)85398-0.
- ^ a b Dioxirane. Its synthesis, microwave spectrum, structure, and dipole moment, in Journal of the American Chemical Society, vol. 100, n. 16, August 1978, pp. 5117–5122, DOI:10.1021/ja00484a034.
- ^ Dioxirane oxidations: Taming the reactivity-selectivity principle (PDF), in Pure Appl. Chem., vol. 67, n. 5, 1995, pp. 811–822, DOI:10.1351/pac199567050811.

