Utente:Grasso Luigi/sanbox1/Nitrometano
| Grasso Luigi/sanbox1/Nitrometano | |
|---|---|
 | |
| Nome IUPAC | |
| nitrometano | |
| Caratteristiche generali | |
| Massa molecolare (u) | 61,04 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,14 |
| Temperatura di fusione | −29 °C (244 K) |
| Temperatura di ebollizione | 101 °C (374 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −112,6 |
| ΔfG0 (kJ·mol−1) | −14,4 |
| S0m(J·K−1mol−1) | 171,8 |
| C0p,m(J·K−1mol−1) | 106,6 |
| Indicazioni di sicurezza | |
| Punto di fiamma | 35,6 °C (308,8 K) |
| Limiti di esplosione | 7,3 - 63% vol. |
| Temperatura di autoignizione | 418 °C (691 K) |
| Simboli di rischio chimico | |
 
| |
| attenzione | |
| Frasi H | 226 - 302 |
| Consigli P | 210 [1] |
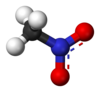
Il nitrometano è un composto organico di formula CH3NO2. È il più semplice dei nitrocomposti alifatici R-NO2 (R = alchile). Nella molecola i due atomi di ossigeno sono uguali grazie alla risonanza (una delle due forme è mostrata in figura, a destra) che li fa scambiare di ruolo. Come si può già intuire da queste due strutture limite la sua molecola risulta considerevolmente polare (μ = 3,54 D) [2].
Allo stato liquido va soggetto a tautomeria di tipo cheto-enolico che comporta uno spostamento di protone (H+) dal carbonio a uno degli ossigeni (e viceversa), ma l’equilibrio risultante è comunque molto spostato a sinistra; la presenza di un -OH nella seconda forma tautomera, pur se largamente minoritaria, rende il nitrometano un solvente polare sì, ma non del tutto aprotico. Un solvente simile, ma di uso più generale, è l'acetonitrile; anch'esso notevolmente polare e con buona costante dielettrica.
Il nitrogruppo -NO2 è tra i gruppi maggiormente stabilizzanti dei carbanioni in α, più del carbonile (e questo più del cianogruppo -CN), per cui gli idrogeni del metile sono qui decisamente più acidi che nei chetoni o aldeidi; infatti il suo pKa è 10,21 [3], contro 19,16 [4] per l’acetone; il nitrometano può quindi essere facilmente deprotonato; l’anione che così ne deriva è un buon nucleofilo al carbonio; come tale, che può essere utilmente impiegato nelle reazioni di addizione nucleofila al carbonile e questo anche a scopo sintetico, per formare legami C-C ed estendere così la catena.
A temperatura ambiente si presenta come un liquido incolore, leggermente oleoso, dall'intenso odore caratteristico; bolle a 101 °C ed è solo parzialmente solubile in acqua.
Viene comunemente usato in svariate applicazioni industriali come solvente, come intermedio di sintesi, come mezzo di reazione e per estrazioni liquido-liquido in campo farmaceutico, per le produzioni di pesticidi, esplosivi, fibre e solvente di vernici o rivestimenti [5].
La sua costante dielettrica relativamente elevata (εr = 39,40) [6] lo rende adatto anche per solubilizzare complessi metallici e composti inorganici in genere.
Usi[modifica | modifica wikitesto]
Un uso di un certo rilievo è connesso al mondo del modellismo dinamico a motore endotermico, dove esso viene miscelato con alcol metilico, olio di ricino di alta qualità e una miscela di 8 tipi diversi di olio sintetico per produrre una miscela carburante. L'ossigeno presente nella molecola viene rilasciato ad una certa temperatura permettendo di bruciare una quantità maggiore di combustibile di quanto permetterebbe il solo ossigeno presente nell'aria, ottenendo così una combustione più energetica di quella che si avrebbe immettendo una miscela di solo alcool metilico nella camera di combustione del micromotore, sia esso a due o quattro tempi. Viene impiegato nel mondo quattro ruote pista e fuoristrada ma è anche utilizzato, in percentuali minori, in aerei ed elicotteri in scala. I dragster sono un esempio di macchine da corsa alimentate a nitrometano, infatti quando si alimentano motori con nitrometano molto concentrato si notano le caratteristiche "fiammate" (date dalla parziale combustione del nitrometano nella camera di scoppio) che escono dagli scarichi. Le percentuali maggiori, si ottengono nell'1/8 pista 25% ma si può arrivare anche a percentuali di 30-33% per i fuoristrada o rally per poi scendere al 10-16% per la 1/10. Il nitrometano, in maniera analoga ad altri nitrocomposti come la nitroglicerina, ad alte temperature si disgrega e gli atomi di ossigeno vengono liberati agevolando così una forte detonazione; tuttavia, il nitrometano, generando ossigeno, va ad ossidare le delicate parti meccaniche prevalentemente fatte di alluminio ma anche di acciaio del micromotore. Il nitrometano è impiegato nelle industrie come solvente e per altre applicazioni.
Reazioni[modifica | modifica wikitesto]
Proprietà acido-base[modifica | modifica wikitesto]

Il nitrometano è un acido di carbonio relativamente acido. Ha un pKa di 17.2 in soluzione DMSO. Questo valore indica un pKa in soluzione acquosa di circa 11.[7]
Il motivo per cui è così acido è dovuto alla struttura di risonanza come nella figura accanto.
È lento a deprotonare. La protonazione della base coniugata O2NCH2−, che è quasi isosterico con un nitrato, si verifica inizialmente sull'ossigeno.[8]
Reazioni organiche[modifica | modifica wikitesto]
In sintesi organica il nitrometano è impiegato come un carbonio nella funzione di elemento costitutivo.[9][10]
La sua acidità gli permette di subire deprotonazione, ottenendo reazioni di condensazione analoghe a quelle dei composti carbonilici. Pertanto, sotto catalisi basica, il nitrometano si lega a un' aldeide con addizione-1,2 in una reazione nitroaldolica. Alcuni importanti derivati includono dei pesticidi: la cloropicrina (Cl3CNO2), il β-nitrostirene (C8H7NO2 un composto aromatico) e il tris(idrossimetil)nitrometano ((HOCH2)3CNO2). La riduzione di quest'ultimo dà il tris (HOCH2)3CNH2, molto usato come buffer.
Nella sintesi organica specialistica, il nitrometano ha funzione di donore di Michael, legandosi a composti carbonilici α,β-insaturi tramite un'addizione-1,4 nella reazione di Michael.
Carburante per motore[modifica | modifica wikitesto]
Nitromethane is used as a fuel in motor racing, particularly drag racing, as well as for radio-controlled model power boats, cars, planes and helicopters. In this context, nitromethane is commonly referred to as "nitro fuel" or simply "nitro", and is the principal ingredient for fuel used in the "Top Fuel" category of drag racing.
The oxygen content of nitromethane enables it to burn with much less atmospheric oxygen than conventional fuels. During nitromethane combustion, nitric oxide (NO) is one of the major emission products along with COTemplate:Sub and HTemplate:SubO.[11] Recent (2020) studies[12]suggest the correct stoichiometric equation for the burning of nitromethane is:
- 4 CH3NO2 + 5 O2 → 4 CO2 + 6 H2O + 4 NO
The amount of air required to burn 1 kg (2,2 lb) of gasoline is 14,7 kg (32 lb), but only 1,7 kg (3,7 lb) of air is required for 1 kg of nitromethane. Since an engine's cylinder can only contain a limited amount of air on each stroke, 8.6 times as much nitromethane as gasoline can be burned in one stroke. Nitromethane, however, has a lower specific energy: gasoline provides about 42–44 MJ/kg, whereas nitromethane provides only 11.3 MJ/kg. This analysis indicates that nitromethane generates about 2.3 times the power of gasoline when combined with a given amount of oxygen.
Nitromethane can also be used as a monopropellant, i.e., a fuel that burns without added oxygen. The following equation describes this process:
- 2 CH3NO2 → 2 CO + 2 H2O + H2 + N2
Nitromethane has a laminar combustion velocity of approximately 0.5 m/s, somewhat higher than gasoline, thus making it suitable for high-speed engines. It also has a somewhat higher flame temperature of about 2 400 °C (4 350 °F). The high heat of vaporization of 0.56 MJ/kg together with the high fuel flow provides significant cooling of the incoming charge (about twice that of methanol), resulting in reasonably low temperatures.
Nitromethane is usually used with rich air–fuel mixtures because it provides power even in the absence of atmospheric oxygen. When rich air–fuel mixtures are used, hydrogen and carbon monoxide are two of the combustion products. These gases often ignite, sometimes spectacularly, as the normally very rich mixtures of the still burning fuel exits the exhaust ports. Very rich mixtures are necessary to reduce the temperature of combustion chamber hot parts in order to control pre-ignition and subsequent detonation. Operational details depend on the particular mixture and engine characteristics.
A small amount of hydrazine blended in nitromethane can increase the power output even further. With nitromethane, hydrazine forms an explosive salt that is again a monopropellant. This unstable mixture poses a severe safety hazard and the Academy of Model Aeronautics does not permit its use in competitions.[13]
In model aircraft and car glow fuel, the primary ingredient is generally methanol with some nitromethane (0% to 65%, but rarely over 30%, and 10–20% lubricants (usually castor oil and/or synthetic oil). Even moderate amounts of nitromethane tend to increase the power created by the engine (as the limiting factor is often the air intake), making the engine easier to tune (adjust for the proper air/fuel ratio).
Proprietà esplosive[modifica | modifica wikitesto]
Nitromethane was not known to be a high explosive until a railroad tanker car loaded with it exploded on June 1, 1958.[14] After much testing, it was realized that nitromethane was a more energetic high explosive than TNT, although TNT has a higher velocity of detonation (VoD) and brisance. Both of these explosives are oxygen-poor, and some benefits are gained from mixing with an oxidizer, such as ammonium nitrate. Pure nitromethane is an insensitive explosive with a VoD of approximately 6 400 m/s (21 000 ft/s), but even so inhibitors may be used to reduce the hazards. The tank car explosion was speculated to be due to adiabatic compression, a hazard common to all liquid explosives. This is when small entrained air bubbles compress and superheat with rapid rises in pressure. It was thought that an operator rapidly snapped shut a valve creating a "hammer-lock" pressure surge.
Nitromethane can also be mixed with ammonium nitrate, which is used as an oxidizer, to form an explosive mixture known as ANNM. One graphic example of this was the use of nitromethane and ammonium nitrate in the Oklahoma City bombing.
Nitromethane is used as a model explosive, along with TNT. It has several advantages as a model explosive over TNT, namely its uniform density and lack of solid post-detonation species that complicate the determination of equation of state and further calculations.
Gas di scarico[modifica | modifica wikitesto]
Template:Unreferenced section Exhaust gas from an internal combustion engine whose fuel includes nitromethane will contain nitric acid vapour, which is corrosive, and when inhaled causes a muscular reaction making it impossible to breathe. The condensed nitric acid-based residue left over in a glow-fueled model engine after a model-flight session can also corrode their internal components, usually mandating use of a combination of kerosene to neutralize the residual nitric acid, and an "after-run oil" (often the lower-viscosity "air tool oil" variety of a popular preservative oil) for lubrication to safeguard against such damage, when such an engine is placed into storage.
Precauzioni d'uso[modifica | modifica wikitesto]
Puro o ad alte concentrazioni, il nitrometano è esplosivo per riscaldamento o compressione. Se contaminato con ammine o idrocarburi, può formare composti esplosivi sensibili agli urti (l'esplosivo liquido Picatinny Liquid explosive - PLX viene ottenuto proprio miscelando 95% di nitrometano e 5% di etilendiammina).
A partire dal 1º marzo 2016 le normative europee vietano la vendita di nitrometano ai privati in quanto precursore di esplosivo.[15]
Note[modifica | modifica wikitesto]
- ^ scheda del nitrometano su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ Dipole moments, su www.stenutz.eu. URL consultato il 10 luglio 2020.
- ^ John A. Riddick, Theodore Sakano e William B. Bunger, Organic solvents: physical properties and methods of purification, collana Techniques of chemistry, 4th ed, Wiley, 1986, ISBN 978-0-471-08467-9. URL consultato il 10 luglio 2020.
- ^ (EN) Yvonne Chiang, A. Jerry Kresge e Yui S. Tang, The pKa and keto-enol equilibrium constant of acetone in aqueous solution, in Journal of the American Chemical Society, vol. 106, n. 2, 1984-01, pp. 460–462, DOI:10.1021/ja00314a055. URL consultato il 10 luglio 2020.
- ^ Markofsky, S. B., Nitro Compounds, Aliphatic, in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, 2000, DOI:10.1002/14356007.a17_401.pub2, ISBN 978-3527306732.
- ^ Dielectric constants and refractive index, su www.stenutz.eu. URL consultato il 10 luglio 2020.
- ^ (EN) Bordwell, F. G.; Satish, A. V., Is Resonance Important in Determining the Acidities of Weak Acids or the Homolytic Bond Dissociation Enthalpies (BDEs) of Their Acidic H-A Bonds?, in J. Am. Chem. Soc., vol. 116, n. 20, 1994, pp. 8885–8889, DOI:10.1021/ja00099a004.
- ^ (EN) Kramarz, K. W.; Norton, J. R., Slow Proton-Transfer Reactions in Organometallic and Bioinorganic Chemistry, in Progress in Inorganic Chemistry, 2007, pp. 1-65, DOI:10.1002/9780470166437.ch1, ISBN 9780470166437.
- ^ (EN) Dauben, H. J. Jr.; Ringold, H. J.; Wade, R. H.; Pearson, D. L.; Anderson, A. G. Jr.; de Boer, T. J.; Backer, H. J., Cycloheptanone, in Organic Syntheses, vol. 34, 1954, pp. 19, DOI:10.15227/orgsyn.034.0019. Volume collettivo, vol. 4, 1963, pp. 221.
- ^ (EN) Noland, W. E., 2-Nitroethanol, in Organic Syntheses. Volume collettivo, vol. 4, 1963, pp. 833.
- ^ Insights into nitromethane combustion from detailed kinetic modeling – Pyrolysis experiments in jet-stirred and flow reactors (PDF), in Fuel, vol. 261, 1º febbraio 2020, p. 116349, DOI:10.1016/j.fuel.2019.116349.
- ^ Insights into nitromethane combustion from detailed kinetic modeling – Pyrolysis experiments in jet-stirred and flow reactors (PDF), in Fuel, vol. 261, 1º febbraio 2020, p. 116349, DOI:10.1016/j.fuel.2019.116349.
- ^ AMA Competition Regulations 2015–2016 Part 7. Fuels (PDF), su modelaircraft.org, Academy of Model Aeronautics, February 15, 2016.
- ^ Interstate Commerce Commission, Accident Near Mt. Pulaski, ILL (PDF), in Ex Parte No 213 (archiviato dall'url originale il 1º November 2020).
- ^ Reg. (CE) 15-1-2013 n. 98/2013 REGOLAMENTO DEL PARLAMENTO EUROPEO E DEL CONSIGLIO relativo all'immissione sul mercato e all'uso di precursori di esplosivi (Testo rilevante ai fini del SEE). (PDF), su earmi.it, G.U.U.E. 9 febbraio 2013, n. L 39.. URL consultato il 10 febbraio 2016.
Voci correlate[modifica | modifica wikitesto]
- Nitrobenzene
- Acetonitrile
- Acetone
- Top Fuel
- Temperatura adiabatica della fiamma, calcolo termodinamico della temperatura fiamma del nitrometano
- Fattore RE
- Motore modello
- Composti correlati
Altri progetti[modifica | modifica wikitesto]