Cloruro di cromile
| Cloruro di cromile | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Diossido dicloruro di cromo(VI) | |
| Nomi alternativi | |
| Cloruro di cromile Ossicloruro di cromo | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CrO2Cl2 |
| Massa molecolare (u) | 154,8 g/mol |
| Aspetto | liquido rosso cremisi |
| Numero CAS | |
| Numero EINECS | 239-056-8 |
| PubChem | 22150757 |
| SMILES | Cl[Cr](Cl)(=O)=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,91 g/cm³ |
| Solubilità in acqua | decompone |
| Temperatura di fusione | -96,5 °C |
| Temperatura di ebollizione | 117 °C |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
    
| |
| pericolo | |
| Frasi H | 271 - 314 - 317 - 340 - 350i - 410 |
| Consigli P | 201 - 210 - 273 - 280 - 305+361+353 - 305+351+338 [1] |
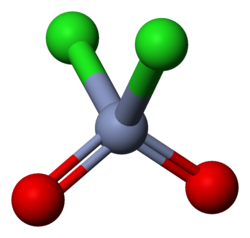
Il cloruro di cromile è un composto inorganico con formula CrO2Cl2. È l'ossicloruro di Cr(VI); possiede configurazione elettronica d0, diamagnetico. La molecola ha forma tetraedrica distorta, con l'atomo di cromo ibridato sp3, come lo zolfo nel cloruro di solforile (SO2Cl2), composto al quale può essere raffrontato. Si presenta come un liquido rosso sangue dall'odore pungente, che per esposizione all'aria reagisce con l'umidità presente idrolizzandosi a anidride cromica (o ad acido cromico) producendo fumi di acido cloridrico. È un composto altamente ossidante e poco discriminante nella sua azione e per questo poco utile in quanto tale[2]; è più ossidante[2] degli analoghi composti del molibdeno e tungsteno (solidi di colore giallo pallido); come tutti i composti di Cr(VI) è tossico e cancerogeno[3]. Reagisce con la maggior parte dei composti organici dando reazioni violente e perfino con gli idrocarburi non dà soluzioni stabili. È solubile in idrocarburi clorurati come il diclorometano (CH2Cl2), il cloroformio (CHCl3) e il tetracloruro di carbonio (CCl4), nei quali è possibile usarlo a freddo.
Sintesi[modifica | modifica wikitesto]
Può essere preparato per reazione tra acido cloridrico (HCl) e anidride cromica (CrO3) o fra una soluzione di acido cloridrico concentrato e cromato di potassio (K2CrO4) seguita dall'aggiunta di acido solforico (H2SO4) come agente disidratante. Il cloruro di cromile prodotto (d = 1,92 g/mL, maggiore dell'acido solforico) si raccoglierà sul fondo e potrà essere prelevato con una pipetta in vetro[4].
Tuttavia una reazione più semplice da eseguire in laboratorio è aggiungere H2SO4 concentrato in eccesso ad una miscela di un cloruro alcalino (cloruro di potassio o cloruro di sodio), e un cromato o bicromato (cromato di potassio o dicromato di potassio):
L'acido solforico va aggiunto in eccesso per assorbire l'acqua che si produce nella reazione, in modo che non reagisca con il cloruro di cromile (riformando il cromato).
Proprietà chimiche[modifica | modifica wikitesto]
Il cloruro di cromile ha un forte carattere elettrofilo e forti proprietà ossidanti. Ossida gli idrocarburi e lo zolfo solido a temperatura ambiente dando reazioni fortemente esotermiche. Reagisce con l'acqua rilasciando vapori di acido cloridrico ed anidride cromica:
Impieghi[modifica | modifica wikitesto]
Viene impiegato in alcune reazioni organiche, per esempio l'ossidazione del toluene a benzaldeide.[5] Tuttavia le reazioni con composti organici vanno svolte in condizioni ben controllate, in quanto CrO2Cl2 reagisce violentemente coi composti organici, a volte provocandone la combustione istantanea.
Note[modifica | modifica wikitesto]
- ^ Scheda del cloruro di cromile su IFA-GESTIS, su gestis-en.itrust.de. URL consultato il 18 giugno 2021 (archiviato dall'url originale il 16 ottobre 2019).
- ^ a b (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, 1997, pp. 1022-3, ISBN 978-07-50-63365-9.
- ^ (EN) PubChem, Hazardous Substances Data Bank (HSDB) : 518, su pubchem.ncbi.nlm.nih.gov. URL consultato il 17 agosto 2020.
- ^ (EN) H.H. Sisler, Chromyl Chloride, in Inorganic Synthesis, vol. 2, New York, McGraw-Hill, 1946, pp. 205-7.
- ^ Pradyot Patnaik. op. cit.
Bibliografia[modifica | modifica wikitesto]
- G. Salomone, Guida pratica per la preparazione dei prodotti chimici inorganici (PDF).
- (EN) Pradyot Patnaik, Handbook of Inorganic Chemicals, McGraw-Hill, 2002, ISBN 0-07-049439-8.
- Scheda della sostanza Cromile cloruro, su dors.it. URL consultato il 15 gennaio 2022.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su cloruro di cromile
Wikimedia Commons contiene immagini o altri file su cloruro di cromile
Collegamenti esterni[modifica | modifica wikitesto]
- Sintesi del cloruro di cromile e del pentossido di cromo - YouTube
- Cloruro di cromile, sulla Matrice di esposizione a cancerogeni - MATline, su dors.it.


