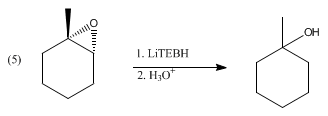Trietilboroidruro di litio
| Trietilboroidruro di litio | |
|---|---|
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | Li(C2H5)3BH |
| Massa molecolare (u) | 105,95 g/mol |
| Aspetto | liquido di colore trasparente/giallognolo |
| Numero CAS | |
| Numero EINECS | 245-076-8 |
| PubChem | 23712863 |
| SMILES | [Li+].CC[BH-](CC)CC |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,890 |
| Temperatura di ebollizione | 66 °C |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| Frasi H | 250 - 260 - 314 - 335 [1] |
| Consigli P | 210 - 222 - 223 - 231+232 - 260 - 261 - 264 - 271 - 280 - 301+330+331 - 302+334 - 303+361+353 - 304+340 - 305+351+338 |
Il trietilboroidruro di litio è un composto organoboro con la formula LiEt3BH. Comunemente indicato come LiTEBH o superidruro, è un potente agente riducente utilizzato nella chimica organometallica e organica. È un liquido incolore o bianco, ma viene generalmente commercializzato e utilizzato come soluzione in THF.[2] Il relativo agente riducente, il trietilboroidruro di sodio, è disponibile in commercio come soluzioni di toluene.
Il trietilboroidruro di litio è un agente riducente più forte del boroidruro di litio e del tetraidroalluminato di litio.
Preparazione[modifica | modifica wikitesto]
Il trietilboroidruro di litio è preparato dalla reazione di idruro di litio (LiH) e trietilborano (Et3B) in tetraidrofurano (THF):
Le sue soluzioni THF sono stabili indefinitamente in assenza di umidità e aria.
Reazioni[modifica | modifica wikitesto]
Gli alogenuri alchilici sono ridotti ad alcani dal trietilboroidruro di litio[3][4][2].
Il trietilboroidruro di litio riduce un'ampia gamma di gruppi funzionali, reazione che è tuttavia comune anche a molti altri reagenti idruro. Il trietilboroidruro di litio è però riservato a substrati difficili, come carbonili stericamente impediti, come illustrato dalla riduzione del 2,2,4,4-tetrametil-3-pentanone. In aggiunta riduce le anidridi acide a alcol e acido carbossibilico, ma non ai corrispondenti dioli. Invece i lattoni si riducono a dioli. Gli α,β-enoni subiscono un'addizione 1,4 per dare enolati di litio. I disolfuri si riducono a tioli (tramite tiolati). Il trietilboroidruro di litio deprotona gli acidi carbossilici, ma non riduce i risultanti carbossilati di litio. Per ragioni simili, gli epossidi subiscono l'apertura dell'anello dopo il trattamento con LiBHEt3 per dare l'alcol. Con epossidi asimmetrici, la reazione può procedere con elevata regioselettività e stereoselettività, favorendo l'attacco nella posizione meno impedita: [2]
Gli acetali e i chetali non vengono ridotti dal trietilboroidruro di litio. Può essere utilizzato nella scissione riduttiva di mesilati e tosilati[5]. Il trietilboroidruro di litio può deproteggere selettivamente i gruppi N-acile terziari senza influenzare la funzionalità dell'ammide secondaria[6]. Ha anche dimostrato di ridurre gli esteri aromatici agli alcoli corrispondenti come mostrato nelle reazioni 6 e 7:
Il trietilboroidruro di litio riduce anche la piridina e le isochinoline rispettivamente in piperidine e tetraidroisochinoline[7].
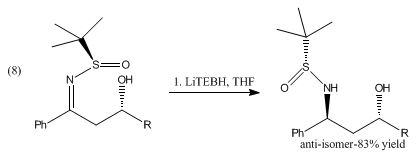
La riduzione delle β-idrossisolfinil immine con catecolborano e il trietilboroidruro di litio produce gli anti-1,3-amminoalcoli mostrati in (8) [8].
Precauzioni[modifica | modifica wikitesto]
Il trietilboroidruro di litio reagisce esotermicamente, potenzialmente anche in modo violento, con acqua, alcoli e acidi, liberando idrogeno e trietilborano piroforico[2].
Note[modifica | modifica wikitesto]
- ^ (EN) Lithium triethylhydroborate, su pubchem.ncbi.nlm.nih.gov. URL consultato il 19 dicembre 2021.
- ^ a b c d (EN) Zaidlewicz, M. e Brown, H.C., Lithium Triethylborohydride, in Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, 2001, DOI:10.1002/047084289X.rl148.
- ^ (EN) Zaidlewicz, M. e Brown, H.C., Lithium Triethylborohydride, in Encyclopedia of Reagents for Organic Synthesis, 2001, DOI:10.1002/047084289X.rl148, ISBN 0471936235.
- ^ (EN) Brown, H.C., Kim, S.C. e Krishnamurthy, S., Selective reductions. 27. Reaction of alkyl halides with representative complex metal hydrides and metal hydrides. Comparison of various hydride reducing agents, in J. Org. Chem., vol. 45, n. 5, 1º febbraio 1980, pp. 1-12, DOI:10.1021/jo01293a018. URL consultato il 18 febbraio 2022.
- ^ (EN) Baer, H.H. e Mekarska-Falicki, M., Stereochemical dependence of the mechanism of deoxygenation, with lithium triethylborohydride, in 4,6-O-benzylidenehexopyranoside p-toluenesulfonates, in Canadian Journal of Chemistry, vol. 63, n. 11, novembre 1985, p. 3043. URL consultato il 18 febbraio 2022.
- ^ (EN) Tanaka, H. e Ogasawara, K., Utilization oh lithium triethylborohydride as a selective N-acyl deprotecting agent, in Tetrahedron Lett., vol. 43, n. 25, 17 giugno 2002, p. 4417. URL consultato il 18 febbraio 2022.
- ^ (EN) Blough, B.E. e Carroll, F.I., Reduction of isoquinoline and pyridine-containing heterocycles with lithium triethylborohydride (Super-Hydride®), in Tetrahedron Lett., vol. 34, n. 45, 5 novembre 1993, p. 7239, DOI:10.1016/S0040-4039(00)79297-5. URL consultato il 18 febbraio 2022.
- ^ (EN) Kochi, T, Tang, T.P. e Ellman, J.A., Asymmetric Synthesis of syn- and anti-1,3-Amino Alcohols, in J. Am. Chem. Soc., vol. 124, n. 23, 14 maggio 2002, p. 6518. URL consultato il 18 febbraio 2022.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Trietilboroidruro di litio
Wikimedia Commons contiene immagini o altri file su Trietilboroidruro di litio