Tetrarodio dodecacarbonile
| Tetrarodio dodecacarbonile | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| dodecacarboniltetrarodio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C12H3O12Rh4⁻ |
| Aspetto | solido rosso[1] |
| Numero CAS | |
| Numero EINECS | 243-171-9 |
| PubChem | 16212430 |
| SMILES | [CH-]=O.[CH-]=O.[CH-]=O.[C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[C-]#[O+].[Rh].[Rh].[Rh].[Rh+2] |
| Proprietà chimico-fisiche | |
| Temperatura di fusione | >130 °C (403 K) dec[1] |
| Indicazioni di sicurezza | |
| Frasi H | 302 - 312 - 332 [2] |
| Consigli P | 280 [2] |
Il tetrarodio dodecacarbonile o dodecacarboniltetrarodio è il composto chimico cluster con formula Rh4(CO)12. È il più semplice carbonile binario stabile del rodio.[1][3] Disponibile in commercio, è un solido rosso usato come materiale di partenza per ottenere altri composti carbonilici di rodio e come precursore di catalizzatori usati in sintesi organica.[2][4]
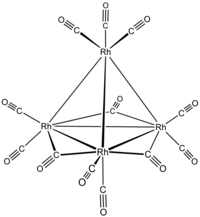
Struttura[modifica | modifica wikitesto]
Tutti e tre i metalli cobalto, rodio e iridio (gruppo 9) formano composti con stechiometria M4(CO)12. La struttura dei due cluster di cobalto e rodio, Co4(CO)12 e Rh4(CO)12 è simile: sono basati su un tetraedro di atomi di metallo e contengono tre CO legati a ponte, mentre i restanti sono terminali. Per questo motivo la formula viene a volte scritta come M4(CO)9(μ-CO)3. La simmetria risulta C3v. Il composto di iridio Ir4(CO)12 è anch'esso basato su un tetraedro di atomi del metallo, ma i leganti CO sono tutti terminali e la simmetria è Td.[1] La presenza di un tetraedro M4 fa sì che questi composti siano considerati tetraedrani.
Sintesi[modifica | modifica wikitesto]
Il composto fu sintetizzato per la prima volta nel 1943 da Walter Hieber e H. Lagally riducendo il tricloruro di rodio anidro con CO sotto pressione (200 atm) a 50-80 ºC in presenza di un accettore di ioni cloruro (Cu, Ag, Zn, Cd).[5]
Rh4(CO)12 può essere ottenuto anche a pressione atmosferica in ambiente acquoso trattando tricloruro di rodio idrato con CO e rame attivato:[4]
Alternativamente si può trattare tricloruro di rodio idrato in metanolo con CO per ottenere H[RhCl2(CO)2], che viene poi carbonilato in presenza di citrato di sodio.[6] Sono note anche altre procedure.[7][8]
Reattività[modifica | modifica wikitesto]
Rh4(CO)12 è un composto stabile allo stato solido, anche alla presenza di aria. È solubile in pentano, n-eptano, toluene e tetraidrofurano. In metanolo sotto atmosfera inerte Rh4(CO)12 si trasforma lentamente in Rh6(CO)16. In atmosfera di CO la reazione è impedita, indicando la presenza dell'equilibrio seguente. La formazione di Rh6(CO)16 è favorita anche da un aumento di temperatura (80-230 ºC).[4][8]
Esiste un equilibrio anche tra Rh4(CO)12 e Rh2(CO)8; quest'ultimo è tuttavia poco stabile ed è stato osservato solo nell'intervallo di temperatura tra -15,2 e 19,5 ºC, sotto pressione di CO (198 atm). Il corrispondente Co2(CO)8 è invece una specie stabile.[8]
Rh4(CO)12 e Rh6(CO)16 reagiscono con trifenilfosfina in eccesso dando prodotti di sostituzione come Rh4(CO)10(PPh3)2 e Rh2(CO)4(PPh3)4. In presenza di CO e reattivi alcalini si formano anioni tipo [Rh6(CO)14]4− e [Rh7(CO)16]3−.[4]
Note[modifica | modifica wikitesto]
Bibliografia[modifica | modifica wikitesto]
- (EN) F. Calderazzo, Carbonyl Complexes of the Transition Metals, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia037, ISBN 9780470862100.
- (EN) P. Chini e S. Martinengo, Synthesis of rhodium carbonyl compounds at atmospheric pressure. III. Synthesis of Rh4(CO)12 and of Rh6(CO)16, in Inorg. Chim. Acta, vol. 3, n. 2, 1969, pp. 315-318, DOI:10.1016/S0020-1693(00)92502-7.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (DE) W. Hieber e H. Lagally, Über Metallcarbonyle. XLV. Das Rhodium im System der Metallcarbonyle, in Z. anorg. allg. Chem., vol. 251, n. 1, 1943, pp. 96-113, DOI:10.1002/zaac.19432510110.
- (EN) C. E. Housecroft e A. G. Sharpe, Inorganic chemistry, 3ª ed., Harlow (England), Pearson Education Limited, 2008, ISBN 978-0-13-175553-6.
- (EN) S. Martinengo, G. Giordano e P. Chini, Tri-µ-carbonyl-nonacarbonyltetrarhodium, Rh4(CO)9(μ-CO)3, in Inorg. Synth., vol. 28, 1990, pp. 242–245, DOI:10.1002/9780470132593.ch62.
- (EN) P. H. Serp, P. H. Kalck, R. Feurer e R. Morancho, Tri(μ‐carbonyl)Nonacarbonyltetrarhodium, Rh4(μ-CO)3(CO)9, in Inorg. Synth., vol. 32, 1998, pp. 284-287, DOI:10.1002/9780470132630.ch45.
- Sigma-Aldrich, Scheda di dati di sicurezza del tetrarodio dodecacarbonile, su sigmaaldrich.com, 2020. URL consultato il 10 aprile 2020.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Tetrarodio dodecacarbonile
Wikimedia Commons contiene immagini o altri file su Tetrarodio dodecacarbonile


