Batteria a limone
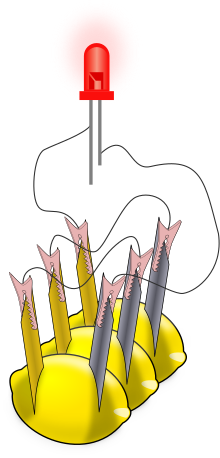
Una batteria a limone è una semplice batteria, generalmente realizzata con finalità didattiche. Solitamente, si inserisce all'interno di un limone un pezzo di zinco metallico (come, ad esempio, un chiodo zincato) e un pezzo di rame (come una moneta) inseriti in un limone e collegati tramite cavi elettrici. L'energia elettrica generata dalla reazione dei metalli viene utilizzata per alimentare piccoli dispositivi come i diodi LED.
La batteria a limone è analoga alla prima batteria elettrica inventata nel 1800 da Alessandro Volta, la quale utilizzava la salamoia (acqua salata) in luogo del succo di limone. La batteria a limone mostra il tipo di reazione chimica (ossidoriduzione) che si verifica nelle batterie. Lo zinco e il rame vengono chiamati elettrodi, invece il succo all'interno del limone è detto elettrolita. Ci sono numerose varianti della cella al limone che utilizzano diversi frutti (o liquidi) come elettroliti e diversi metalli, oltre allo zinco e al rame, come elettrodi.
Utilizzo nei progetti scolastici[modifica | modifica wikitesto]
Esistono numerosi kit di istruzioni per costruire batterie a limone e per procurarsi componenti come diodi LED, multimetri e chiodi e viti zincate. Il kit didattico "orologio a patata", per esempio, include elettrodi e un orologio digitale a bassa potenza. Dopo aver assemblato una cella, è possibile utilizzare un multimetro per misurare la tensione o la corrente elettrica prodotta dalla batteria stessa; con i limoni la tensione tipica è di 0,9 V. La corrente, invece, è più variabile, ma può raggiungere circa 1 mA (se le superfici degli elettrodi sono più larghe, la corrente aumenta). Se si desidera un effetto più visibile, le celle a limone possono essere collegate in serie al fine di alimentare un LED (come illustrato) o altri dispositivi. Il collegamento in serie aumenta la tensione disponibile per i dispositivi. Swartling e Morgan hanno pubblicato un elenco di dispositivi a bassa tensione con il relativo numero di celle al limone necessarie per alimentarli; tra questi figurano LED, buzzer e piccoli orologi digitali. Con gli elettrodi di zinco/rame, sono necessarie almeno due celle al limone per ciascuno di questi dispositivi. Sostituendo un elettrodo di magnesio a quello di zinco si ottiene una cella con una tensione maggiore (1,5-1,6 V) e una singola cella di magnesio/rame è in grado di alimentare alcuni di questi dispositivi. Da notare che le lampadine a incandescenza delle torce elettriche non vengono adoperate poiché la batteria al limone in questione non è progettata per produrre una corrente elettrica sufficiente ad accenderle. Moltiplicando la corrente media di un limone (0,001 A/1 mA) per la tensione media (più bassa) (differenza di potenziale) di un limone (0,7 V) si può concludere che ci vorrebbero più di 6 milioni di limoni per ottenere la potenza media di una batteria per auto da 4.320 W (5,79 CV).
Varianti[modifica | modifica wikitesto]

Molti frutti e liquidi possono essere utilizzati come elettroliti acidi. La frutta risulta conveniente perché fornisce sia l'elettrolita, sia un modo semplice per sostenere gli elettrodi. L'acido contenuto negli agrumi (limoni, arance, pompelmi, ecc.) è l'acido citrico. L'acidità, indicata dal pH misurato, varia sostanzialmente.
Le patate contengono acido fosforico e funzionano bene; sono la base per i kit didattici degli "orologi a patata".[1] Sono state proposte batterie di patate con illuminazione a LED per l'uso nei paesi poveri o per le popolazioni non collegate alla rete elettrica. Una ricerca internazionale iniziata nel 2010 ha dimostrato che la bollitura delle patate per otto minuti ne migliora la resa elettrica, oltre al posizionamento di fette di patate tra più piastre di rame e zinco. Secondo i ricercatori dello Sri Lanka, anche il platano bollito e tritato sarebbe idoneo.[2]
È possibile utilizzare, al posto della frutta, sostanze liquide in vari contenitori. L'aceto domestico (acido acetico) funziona bene. IIcrauti (acido lattico) sono stati presentati in un episodio del programma televisivo statunitense Head Rush (uno spin-off del programma MythBusters ). I crauti erano stati inscatolati e sono diventati l'elettrolita, mentre la lattina stessa era uno degli elettrodi.[3]
Gli elettrodi di zinco e rame sono abbastanza sicuri e facili da ottenere. Si possono valutare anche altri metalli come il piombo, il ferro, il magnesio, ecc. che generano tensioni differenti rispetto alla coppia zinco/rame. In particolare, gli elettrodi di magnesio/rame possono generare tensioni fino a 1,6 V nelle celle al limone. Questa tensione è maggiore di quella ottenibile con le celle zinco/rame. È paragonabile a quella delle batterie domestiche standard (1,5 V), e ciò è utile per alimentare i dispositivi con una singola cella invece di usare più celle in serie.
Utilizzo a seconda dell'età[modifica | modifica wikitesto]
Per gli alunni più piccoli, intorno ai 5-9 anni, l'obiettivo educativo è di tipo utilitaristico: le batterie sono dispositivi che possono alimentare altri dispositivi, purché siano collegati tra loro da un materiale conduttore. Le batterie sono componenti di circuiti elettrici; collegando un solo filo tra una batteria e una lampadina non si alimenta la lampadina.
Per i ragazzi di età compresa tra i 10 e i 13 anni, le batterie sono utilizzate per illustrare il legame tra chimica ed elettronica e per approfondire il concetto di circuito elettrico. Il fatto che vengano utilizzati elementi chimici differenti, come il rame e lo zinco, può essere inserito nel contesto più ampio in cui gli elementi non si dissolvono o scompongono quando subiscono reazioni chimiche.
Per gli studenti più grandi e per gli studenti universitari, queste batterie sono utili per illustrare i principi delle reazioni di ossidoriduzione. Gli studenti possono sperimentare che due elettrodi identici non producono tensione mentre coppie di metalli differenti (oltre al rame e allo zinco) producono tensioni differenti. Si possono esaminare le tensioni e le correnti delle combinazioni in serie e in parallelo delle batterie.
La corrente generata dalla batteria e misurata grazie a un tester è funzione delle dimensioni degli elettrodi, della loro distanza dal frutto e della loro vicinanza l'uno all'altro; la tensione, invece, è abbastanza indipendente da questi parametri degli elettrodi.
Chimica[modifica | modifica wikitesto]
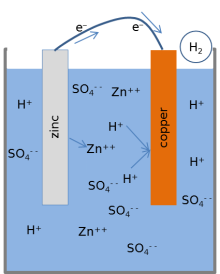
La maggior parte dei libri di testo presenta questo modello per le reazioni chimiche di una batteria al limone. Quando la cella fornisce una corrente elettrica al circuito esterno, lo zinco metallico sulla superficie dell'elettrodo di zinco si dissolve nella soluzione. Gli atomi di zinco si dissolvono nell'elettrolita liquido come ioni carichi elettricamente (), lasciando nel metallo 2 elettroni carichi negativamente ():
Questa reazione è chiamata ossidazione. Nel momento in cui lo zinco entra nell'elettrolita, due ioni idrogeno caricati positivamente dall'elettrolita () questi si combinano con due elettroni sulla superficie dell'elettrodo di rame e formano una molecola di idrogeno priva di carica():
Questa reazione è chiamata riduzione. Gli elettroni utilizzati nel rame per formare le molecole di idrogeno vengono trasferiti dallo zinco tramite un conduttore esterno che si collega tra il rame e lo zinco. Le molecole di idrogeno formatesi sulla superficie del rame a causa della reazione di riduzione, infine, si disperdono sotto forma di idrogeno gassoso.
Risultati dell'esperimento[modifica | modifica wikitesto]
In questo modello di reazioni chimiche sono state fatte diverse previsioni che sono state esaminate in esperimenti pubblicati da Jerry Goodisman nel 2001. Goodisman osserva che numerosi e recenti autori propongono reazioni chimiche per la batteria al limone che prevedono la dissoluzione dell'elettrodo di rame nell'elettrolita. Goodisman esclude questa reazione in quanto incoerente con gli esperimenti e osserva che il corretto sistema chimico, che prevede il passaggio dell'idrogeno all'elettrodo di rame ma può anche utilizzare l'argento al posto del rame, è noto da molti anni. La maggior parte delle descrizioni dettagliate del modello si applicano alla tensione della batteria, misurata direttamente da un tester a circuito aperto ( senza collegare nient'altro alla batteria). Quando l'elettrolita è stato modificato con l'aggiunta di solfato di zinco (), la tensione della cella si è ridotta come ipotizzato dall'equazione di Nernst per il modello. L'equazione di Nernst spiega essenzialmente di quanto si riduce la tensione con l'aggiunta di solfato di zinco. L'aggiunta di solfato di rame () non ha influito sulla tensione. Questo risultato è coerente con il fatto che gli atomi di rame dell'elettrodo non sono coinvolti nel modello di reazione chimica della cella.
Quando la batteria è collegata a un circuito esterno e il flusso di corrente elettrica è significativo, l'elettrodo di zinco perde la propria massa, come previsto dalla reazione di ossidazione dello zinco di cui sopra. Similmente, l'idrogeno gassoso si sviluppa sotto forma di bollicine dall'elettrodo di rame. Per concludere, la tensione della cella dipende dall'acidità dell'elettrolita, misurata dal suo pH; diminuendo l'acidità (e aumentando il pH) la tensione diminuisce. Questo effetto è previsto anche dall'equazione di Nernst; il particolare acido utilizzato (citrico, cloridrico, solforico, ecc.) non influisce sulla tensione se non attraverso il valore del pH.
Le previsioni dell'equazione di Nernst non sono valide per gli elettroliti fortemente acidi (pH < 3,4), quando l'elettrodo di zinco si dissolve nell'elettrolita come pure quando la batteria non fornisce corrente al circuito. Le due reazioni di ossidoriduzione sopra elencate avvengono solo quando la carica elettrica può essere trasportata attraverso il circuito esterno. L'ulteriore reazione a circuito aperto può essere osservata dalla formazione di bolle sull'elettrodo di zinco a circuito aperto. Questo effetto ha limitato la tensione delle celle a 1,0 V a temperatura ambiente ai massimi livelli di acidità.
Sorgenti energetiche[modifica | modifica wikitesto]
L'energia deriva dal cambiamento chimico dello zinco quando si scioglie nell'acido. L'energia non proviene dal limone o dalla patata. Lo zinco si ossida all'interno del limone, scambiando alcuni dei suoi elettroni con l'acido per raggiungere uno stato energetico inferiore, e l'energia rilasciata fornisce la corrente.
Attualmente, lo zinco viene prodotto mediante l'elettroestrazione del solfato di zinco o la riduzione pirometallurgica dello zinco con il carbonio, che richiedono un apporto energetico. L'energia prodotta nella batteria al limone deriva da un'inversione di questa reazione, recuperando parte dell'energia immessa durante la produzione dello zinco.
Cella Smee[modifica | modifica wikitesto]
Dal 1840 alla fine del XIX secolo, le celle voltaiche di grandi dimensioni che utilizzavano un elettrodo di zinco e un elettrolita di acido solforico sono state ampiamente utilizzate nell'industria della stampa. Sebbene a volte venissero utilizzati elettrodi di rame come quelli delle batterie al limone, nel 1840 Alfred Smee inventò una versione più raffinata di questa cella che utilizzava l'argento con un rivestimento di platino grezzo in luogo dell'elettrodo di rame. L'idrogeno gassoso che aderisce alla superficie di un elettrodo d'argento o di rame riduce la corrente elettrica che può essere prelevata dalla cella; il fenomeno è chiamato "polarizzazione". La superficie ruvida, "platinata", accelera il flusso dell'idrogeno gassoso e aumenta la corrente dalla cella. A differenza dell'elettrodo di zinco, gli elettrodi di rame o di argento platinato non vengono consumati dall'uso della batteria e le caratteristiche di questo elettrodo non influiscono sulla tensione della cella. La cella Smee era comoda per la stampa a macchina, che produceva lastre di rame per la stampa tipografica di giornali e libri, ma anche statue e altri oggetti metallici.
La cella di Smee utilizzava zinco amalgamato invece di zinco puro; la superficie dello zinco amalgamato era trattata col mercurio. Apparentemente lo zinco amalgamato si è dimostrato meno incline alla degradazione da parte di una soluzione acida rispetto allo zinco puro. Gli elettrodi di zinco amalgamato e di zinco semplice danno essenzialmente la stessa tensione quando lo zinco è puro.[4] Con lo zinco non perfettamente raffinato presente nei laboratori del XIX secolo, essi fornivano in genere tensioni differenti.
Nella cultura popolare[modifica | modifica wikitesto]
- Nel videogioco Portal 2, l'antagonista GLaDOS è incorporato in un computer alimentato a batteria per una parte significativa del gioco.[5]
- Nell'episodio della sesta stagione di The Big Bang Theory "The Proton Resurgence", l'eroe d'infanzia di Leonard e Sheldon, il professor Proton (Bob Newhart), tenta di mostrare al gruppo una batteria di patate, cosa che stupisce Penny.
- Nell'episodio della sesta stagione di Bones "The Blackout in the Blizzard", Angela e gli altri "strabici" costruiscono un enorme apparato di batterie per patate nel tentativo di alimentare un telefono cellulare. Illustrando la resa pateticamente bassa di un tale sistema, funziona solo per una manciata di secondi mentre si utilizzano dozzine di patate.
- Nell'episodio " Lemons " del programma televisivo Red Dwarf (decima serie), l'equipaggio viaggia per 4.000 miglia dalla Gran Bretagna all'India nel 23 d.C. per ottenere dei limoni per costruire una batteria al limone per alimentare il telecomando della loro macchina del tempo.[6]
- Nel sesto episodio della stagione finale di Mystery Science Theatre 3000, il cattivo principale Pearl Forrester ha provato a conquistare il mondo usando batterie di patate, solo per essere rovinato dal Professor Bobo.
- Nell'episodio 8 di NCIS stagione 7, "Power Down", Abby Sciuto usa i limoni come fonte di alimentazione per il suo stereo quando esaurisce le batterie durante un blackout.
- In Magnum PI, stagione 3, episodio 2, "Easy Money", Magnum utilizza una batteria al limone per caricare un walkie-talkie.
- In The Long Earth di Terry Pratchett e Stephen Baxter, i dispositivi utilizzati per passare da un universo all'altro sembrano essere alimentati da batterie di patate.[7]
- In Chiamatemi Anna Stagione 2 episodio 10, "Il bene che cresce nel mondo", Anna e i suoi compagni di classe usano batterie di patate per dimostrare alla loro città quanto hanno imparato dai metodi di insegnamento non convenzionali del loro nuovo insegnante.
Note[modifica | modifica wikitesto]
- ^ Potato science and technology, Elsevier Applied Science, 1989, ISBN 978-1-85166-307-1.
- ^ (EN) Jonathan Kalan, Potato power: the spuds that could light the world, su bbc.com. URL consultato il 14 ottobre 2023.
- ^
 https://www.youtube.com/watch?v=KZ9KmHWKobY.
https://www.youtube.com/watch?v=KZ9KmHWKobY.
- ^ The standard electrode potential is 0.76 V for both pure zinc and for amalgamated zinc.
- ^ techhive, http://www.techhive.com/article/246545/portal_2_science_kit_has_talking_evil_potato_glados.html. URL consultato il 30 gennaio 2015.
- ^ Robert Keeling, TV Review: RED DWARF X Episode 3 'Lemons', in Starburst, 19 ottobre 2012. URL consultato il 30 gennaio 2015.
- ^ The Guardian, https://www.theguardian.com/books/2012/jun/20/long-earth-terry-pratchett-stephen-baxter-review. URL consultato l'8 febbraio 2017.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file sulle batterie a limone
Wikimedia Commons contiene immagini o altri file sulle batterie a limone
Collegamenti esterni[modifica | modifica wikitesto]
- Video della batteria al limone. . Video animato simpatico e divertente che spiega in dettaglio come funziona una batteria al limone dall'interno.
- Video della batteria arancione (archiviato dall'url originale il 18 aprile 2021). . La batteria arancione alimenta un orologio digitale.
 Potato battery video, su YouTube. Tre batterie di patate in serie alimentano una calcolatrice.
Potato battery video, su YouTube. Tre batterie di patate in serie alimentano una calcolatrice.







