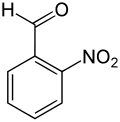
2-nitrobenzaldeide
| 2-nitrobenzaldeide | |
|---|---|
 | |
| Nome IUPAC | |
| 2-nitrobenzaldeide | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C7H5NO3 |
| Massa molecolare (u) | 151,12 |
| Aspetto | solido giallo chiaro |
| Numero CAS | |
| Numero EINECS | 209-025-3 |
| PubChem | 11101 |
| SMILES | C1=CC=C(C(=C1)C=O)[N+](=O)[O-] |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | (20 °C) quasi insolubile |
| Temperatura di fusione | 41 °C (314 K) |
| Temperatura di ebollizione | 156 °C (429 K) (20 hPa) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 302 - 315 - 319 - 335 |
| Consigli P | 261 - 305+351+338 [1] |
La 2-nitrobenzaldeide è un'aldeide aromatica, contenente un gruppo nitro in posizione orto rispetto al formile.
A temperatura ambiente si presenta come un solido giallo chiaro dall'odore caratteristico.
Sintesi[modifica | modifica wikitesto]
Le vie principali verso la nitrobenzaldeide iniziano con la nitrazione di stirene e acido cinnamico seguita dalle conversioni degli acidi 2-nitrostirene e 2-nitrocinnamici risultanti. La cinnamaldeide può anche essere nitrata, ad esempio, in una soluzione di anidride acetica in acido acetico, ad alto rendimento in 2-nitrocinnamaldeide.[2] Questo composto viene quindi ossidato in acido 2-nitrocinnamico, che viene decarbossilato in 2-nitrostirene. Il gruppo vinile può essere ossidato in diversi modi per produrre 2-nitrobenzaldeide.[3]
In un processo sintetico, il toluene viene mononitrato a basse temperature in 2-nitrotoluene, con circa il 58% convertito nell'isomero orto.[4] Il 2-nitrotoluene può quindi essere ossidato per produrre 2-nitrobenzaldeide.[5][6]
In alternativa, il 2-nitrotoluene può essere alogenato ad un alogenuro di 2-nitrobenzile seguito da ossidazione con DMSO e bicarbonato di sodio per produrre 2-nitrobenzaldeide, che viene successivamente purificato con la creazione di un addotto bisolfito[7]
La nitrazione della benzaldeide produce principalmente 3-nitrobenzaldeide, con rese di circa il 19% per l'isomero orto, il 72% per il meta e il 9% per il para.[8] Per questo motivo, la nitrazione della benzaldeide per produrre 2-nitrobenzaldeide non è conveniente.
Utilizzi[modifica | modifica wikitesto]
La 2-nitrobenzaldeide è un intermedio per la una prima sintesi dell'indaco, un colorante insolubile in acqua comunemente usato per tingere jeans e altri tessuti. Nella sintesi dell'indaco di Baeyer-Drewson, la 2-nitrobenzaldeide si condensa con acetone in una soluzione acquosa basica.[9][10][11][12] Il metodo è stato abbandonato nella prima parte del XX secolo, venendo sostituito da processi che utilizzano l'anilina.[13]
Dati i suoi due gruppi relativamente reattivi, la 2-nitrobenzaldeide è un potenziale materiale di partenza per altri composti. Le 2-nitrobenzaldeidi sostituite possono anche essere utilizzate per produrre altri importanti composti a base di indaco, come l'indigotina.
La 2-nitrobenzaldeide ha dimostrato di essere un utile gruppo protettivo fotomovibile.[14][15]
Note[modifica | modifica wikitesto]
- ^ scheda della 2-nitrobenzaldeide su IFA-GESTIS (archiviato dall'url originale il 16 ottobre 2019).
- ^ o-NITROCINNAMALDEHYDE, nitration of cinnamaldehyde, organic-synthesis, su orgsyn.org. URL consultato il 23 settembre 2020 (archiviato il 14 settembre 2020).
- ^ Selective aerobic oxidation of styrene to benzaldehyde catalyzed by water-soluble palladium(II) complex in water (archiviato dall'url originale il 28 maggio 2021)., Bo Feng, Zhenshan Hou, Xiangrui Wang, Yu Hu, Huan Li and Yunxiang Qiao
- ^ Product Distribution in the Nitration of Toluene (archiviato dall'url originale il 27 giugno 2020). Product Distribution in the Nitration of Toluene, Steven W. Anderson, January 7, 1999
- ^ Synthesis of 2-Nitrobenzaldehyde from 2-Nitrotoluene (PDF) (archiviato dall'url originale il 5 giugno 2011)., Alexander Popkov
- ^ o-Nitrobenzaldehyde, su orgsyn.org. URL consultato il 21 luglio 2009 (archiviato il 23 luglio 2009).
- ^ Process for the Preparation of 2-Nitrobenzaldehyde [collegamento interrotto], su google.com. URL consultato il 18 ottobre 2010.
- ^ Structure of Benzene, California State University Dominguez Hills, su chemistry2.csudh.edu. URL consultato il 23 settembre 2020 (archiviato il 14 settembre 2020).
- ^ See Baeyer-Drewson indigo synthesis
- ^ Synthesis of Indigo (PDF) (archiviato dall'url originale il 20 giugno 2010).
- ^ Indigo Synthesis (DOC), su chem.missouri.edu. URL consultato il 18 luglio 2009 (archiviato dall'url originale il 20 luglio 2011).
- ^ Synthesis of Indigo and Vat Dyeing (PDF), su courses.chem.psu.edu. URL consultato il 18 luglio 2009 (archiviato dall'url originale il 20 luglio 2011).
- ^ Elmar Steingruber "Indigo and Indigo Colorants" Ullmann's Encyclopedia of Industrial Chemistry 2004, Wiley-VCH, Weinheim. DOI: 10.1002/14356007.a14_149.pub2
- ^ Peter Šebej, Tomáš Šolomek, Ľubica Hroudná, Pavla Brancová e Petr Klán, Photochemistry of 2-Nitrobenzylidene Acetals, in J. Org. Chem., vol. 74, n. 22, 2009, pp. 8647-8658, DOI:10.1021/jo901756r, PMID 19824651.
- ^ Kristine L. Willett e Ronald A. Hites, Chemical Actinometry: Using o-Nitrobenzaldehyde to Measure Lamp Intensity in Photochemical Experiments, in J. Chem. Educ., vol. 77, n. 7, 2000, p. 900, DOI:10.1021/ed077p900.