Metimazolo
| Metimazolo | |
|---|---|
 | |
 | |
| Caratteristiche generali | |
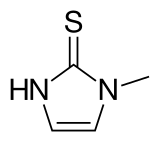
| Formula bruta o molecolare | C4H6N2S |
| Massa molecolare (u) | 114,17 g/mol |
| Numero CAS | |
| Numero EINECS | 200-482-4 |
| Codice ATC | H03 |
| PubChem | 1349907 |
| DrugBank | DB00763 |
| SMILES | Cn1cc[nH]c1=S |
| Proprietà chimico-fisiche | |
| Temperatura di fusione | 146 °C |
| Dati farmacologici | |
| Modalità di somministrazione | orale |
| Dati farmacocinetici | |
| Biodisponibilità | 93% |
| Metabolismo | epatico |
| Emivita | 5-6 h |
| Escrezione | renale |
| Indicazioni di sicurezza | |
Il metimazolo, conosciuto anche come tiamazolo, è un agente antitiroideo della classe delle tionamidi che inibisce l'azione della tiroperossidasi, portando alla riduzione della sintesi degli ormoni tiroidei e al miglioramento dell'ipertiroidismo. Il farmaco è indicato per il trattamento dell'ipertiroidismo, compresa la malattia di Graves, il gozzo multinodulare tossico e la tiroidite. Il suo meccanismo di azione principale consiste nell'inibire l'attività della tiroperossidasi, l'enzima coinvolto nella sintesi degli ormoni tiroidei e riducendo la produzione di ormoni tiroidei, consentendo di alleviare i sintomi dell'ipertiroidismo.[1][2][3]
È stato introdotto per la prima volta come agente antitiroideo nel 1949[2] ed è attualmente ampiamente utilizzato nel trattamento dell'ipertiroidismo, soprattutto nei casi in cui altre opzioni più aggressive come la chirurgia o la terapia con iodio radioattivo non sono appropriate.[4][5]
Dal punto di vista ponderale, il metimazolo è dieci volte più potente dell'altro principale agente antitiroideo tioneamide utilizzato in Nord America, il propiltiouracile,[5] ed è il metabolita attivo del pro-farmaco carbimazolo, che è un farmaco antitiroideo utilizzato nel Regno Unito e in alcune parti del Commonwealth britannico.[2] Tradizionalmente, il metimazolo è stato preferito al propiltiouracile a causa del rischio di epatotossicità fulminante associato a quest'ultimo,[6] con il propiltiouracile preferito in gravidanza a causa di un presunto minor rischio di effetti teratogeni. Nonostante gli effetti teratogeni documentati nelle informazioni di etichetta,[4][5] la vera teratogenicità di metimazolo sembra non essere chiara e il suo ruolo nella terapia potrebbe cambiare in futuro.[2][7][8]
Farmacologia[modifica | modifica wikitesto]
Indicazione d'uso[modifica | modifica wikitesto]
Il farmaco è indicato per il trattamento dell'ipertiroidismo nei pazienti affetti da malattia di Graves o gozzo multinodulare tossico per i quali la tiroidectomia o la terapia con iodio radioattivo non sono opzioni appropriate di trattamento. Il metimazolo è inoltre indicato per alleviare i sintomi dell'ipertiroidismo in preparazione alla tiroidectomia o alla terapia con iodio radioattivo.[4]
In Canada presenta le stesse indicazioni sopra menzionate ed è anche indicato per il trattamento medico dell'ipertiroidismo, indipendentemente dalle altre opzioni di trattamento disponibili.[5]
Farmacodinamica[modifica | modifica wikitesto]
Il metimazolo è un agente antitiroideo della classe delle tionamidi. Esso agisce inibendo la sintesi degli ormoni tiroidei, riducendo così l'ipertiroidismo.[4][5] L'effetto del metimazolo si manifesta entro 12-18 ore dall'assunzione e la sua durata è di 36-72 ore, probabilmente a causa dell'accumulo di metimazolo e dei suoi metaboliti nella ghiandola tiroidea dopo l'assunzione.[7]
Il più grave effetto collaterale potenziale della terapia con metimazolo è l'agranulocitosi, e i pazienti devono essere istruiti a monitorare e segnalare eventuali segni o sintomi di agranulocitosi, come febbre o mal di gola. Durante la terapia con metimazolo possono verificarsi anche altre citopenie. Inoltre, esiste il rischio di tossicità epatica grave nell'uso del farmaco, quindi è opportuno monitorare segni e sintomi di disfunzione epatica, come ittero, anoressia, prurito ed elevazione delle transaminasi epatiche.[4][5]
Meccanismo d'azione[modifica | modifica wikitesto]
Il meccanismo d'azione principale del metimazolo sembra interferire con una fase precoce della sintesi degli ormoni tiroidei coinvolgendo la tiroperossidasi, anche se il modo esatto attraverso cui il metimazolo inibisce questa fase non è ancora del tutto chiaro.[9] La tiroperossidasi, insieme al perossido di idrogeno, catalizza normalmente la conversione dell'ioduro in iodio e successivamente catalizza l'incorporazione di questo iodio nelle posizioni 3 e/o 5 degli anelli fenolici dei residui tirosina nella tireoglobulina. Queste molecole di tireoglobulina si degradano all'interno delle cellule follicolari tiroidee formando la tiroxina (T4) o la tri-iodotironina (T3), che sono gli ormoni principali prodotti dalla ghiandola tiroidea.[10]
Il metimazolo può inibire direttamente la tiroperossidasi, ma è stato dimostrato in vivo che agisce come un substrato competitivo per la tiroperossidasi, diventando quindi iodato e interferendo con l'iodazione della tireoglobulina.[9] Un'altra teoria proposta è che il gruppo solfuro del metimazolo possa interagire direttamente con l'atomo di ferro al centro della molecola di eme della tiroperossidasi, inibendone la capacità di iodare i residui tirosina.[11] Altre possibili meccanismi proposti, sebbene con prove più deboli, includono il legame diretto del metimazolo con la tireoglobulina o l'inibizione diretta della tireoglobulina stessa.[1][9]
Assorbimento[modifica | modifica wikitesto]
L'assorbimento del metimazolo dopo somministrazione orale è rapido ed esteso, con una biodisponibilità assoluta di circa 0,93 e un Tmax che varia da 0,25 a 4,0 ore.[9][12] L'assorbimento può essere influenzato dalla dose somministrata e la Cmax è leggermente, ma non significativamente, più elevata nei pazienti ipertiroidici.[9][12]
Volume di distribuzione[modifica | modifica wikitesto]
Il volume apparente di distribuzione del metimazolo è riportato essere di circa 20 L.[11] Dopo somministrazione orale, il metimazolo si concentra intensamente nella ghiandola tiroidea: i livelli intratiroidei di metimazolo sono approssimativamente 2-5 volte più elevati rispetto ai livelli plasmatici di picco e rimangono elevati per 20 ore dopo l'ingestione.[1]
Legame alle proteine[modifica | modifica wikitesto]
Il metimazolo presenta un legame alle proteine molto limitato o nullo, esistendo principalmente come farmaco libero nel siero.[7][10][11]
Metabolismo[modifica | modifica wikitesto]
Viene rapidamente e ampiamente metabolizzato dal fegato, principalmente attraverso i sistemi enzimatici CYP450 e FMO.[13][14] Sono stati identificati diversi metaboliti, anche se le isoforme specifiche degli enzimi responsabili della loro formazione non sono del tutto chiare. Uno dei primi metaboliti del metimazolo identificati, la 3-metil-2-tioimidazolidinone, potrebbe contribuire all'attività antitiroidea, come dimostrato in studi su ratti, e potrebbe spiegare la durata prolungata dell'inibizione dell'iodazione nonostante il relativamente breve emivita del metimazolo.
Diversi metaboliti sono stati investigati come responsabili dell'epatotossicità indotta dal metimazolo. Sia il glicossale sia la N-metiltiourea hanno dimostrato citotossicità e sono noti prodotti metabolici dell'intermedio di idrodiolo del metimazolo. Si ritiene che i derivati acidi solfenico e solfinico del metimazolo siano i principali agenti tossici responsabili dell'epatotossicità, anche se la loro origine non è chiara: potrebbero derivare dall'ossidazione diretta del farmaco tramite FMO o dall'ossidazione della N-metiltiourea più a valle nel processo metabolico.[13][14]
Via di eliminazione[modifica | modifica wikitesto]
L'escrezione urinaria del farmaco non modificato è stata riportata essere compresa tra il 7% e il 12%. L'eliminazione tramite feci sembra essere limitata, con una percentuale cumulativa di escrezione fecale del 3% dopo la somministrazione del farmaco.[9] La circolazione enteroepatica sembra svolgere un ruolo nell'eliminazione della molecola e dei suoi metaboliti, poiché quantità significative di queste sostanze sono presenti nella bile dopo la somministrazione.[7]
Emivita[modifica | modifica wikitesto]
Dopo l'iniezione endovenosa bolus singola di 10 mg, l'emivita della fase di distribuzione è stata di 0,17 ore e l'emivita della fase di eliminazione è stata di 5,3 ore.[12] Il principale metabolita attivo del metimazolo, la 3-metil-2-tioimidazolidinone, ha un'emivita circa 3 volte più lunga rispetto al farmaco madre. L'insufficienza renale non sembra alterare l'emivita, ma i pazienti con compromissione epatica hanno mostrato un aumento dell'emivita proporzionale alla gravità della loro condizione - un'insufficienza moderata ha comportato un'emivita di eliminazione di 7,1 ore, mentre un'insufficienza grave ha comportato un'emivita di eliminazione di 22,1 ore.[12]
Non sembrano esserci differenze significative nell'emivita in base allo stato tiroideo (ad esempio, nessuna differenza tra pazienti eutiroidei e ipertiroidici).[9][12][15]
Clearance[modifica | modifica wikitesto]
Dopo l'iniezione endovenosa bolus singola di 10 mg di, la clearance è stata di 5,70 L/h.[12] L'insufficienza renale non sembra alterarne la clearance, ma i pazienti con compromissione epatica hanno mostrato una riduzione della clearance proporzionale alla gravità della loro condizione - un'insufficienza moderata ha comportato un clearance di 3,49 L/h, mentre un'insufficienza grave ha comportato una clearance di 0,83 L/h.[12]
Non sembrano esserci differenze significative nella clearance in base allo stato tiroideo (ad esempio, nessuna differenza tra pazienti eutiroidei e ipertiroidici).[9][12][15]
Tossicità[modifica | modifica wikitesto]
La dose letale DL50 del farmaco somministrato per via orale nei ratti è di 2 250 mg/kg.[16] Segni e sintomi di sovradosaggio di metimazolo possono includere disturbi gastrointestinali, mal di testa, febbre, dolore articolare, prurito ed edema. Effetti avversi più gravi, come anemia aplastica o agranulocitosi, possono manifestarsi entro poche ore o giorni.[4][5] Epatite, sindrome nefrosica, dermatite esfoliativa e effetti sul sistema nervoso centrale come neuropatia o depressione/stimolazione del sistema nervoso centrale sono anche risultati potenziali, sebbene meno frequenti, di sovradosaggio.[4][5]
La gestione del sovradosaggio prevede un trattamento di supporto in base alle condizioni del paziente.[4][5] Ciò può includere il monitoraggio dei parametri vitali del paziente, emogasanalisi, degli elettroliti sierici o della funzione del midollo osseo, se indicato.[5]
Note[modifica | modifica wikitesto]
- ^ a b c Henry B. Burch e David S. Cooper, ANNIVERSARY REVIEW: Antithyroid drug therapy: 70 years later, in European Journal of Endocrinology, vol. 179, n. 5, 12 ottobre 2018, pp. R261–R274, DOI:10.1530/EJE-18-0678. URL consultato il 16 luglio 2023.
- ^ a b c d David S. Cooper, Antithyroid drugs, in The New England Journal of Medicine, vol. 352, n. 9, 3 marzo 2005, pp. 905–917, DOI:10.1056/NEJMra042972. URL consultato il 16 luglio 2023.
- ^ Debasish Manna, Gouriprasanna Roy e Govindasamy Mugesh, Antithyroid drugs and their analogues: synthesis, structure, and mechanism of action, in Accounts of Chemical Research, vol. 46, n. 11, 19 novembre 2013, pp. 2706–2715, DOI:10.1021/ar4001229. URL consultato il 16 luglio 2023.
- ^ a b c d e f g h FDA Approved Drug Products: TAPAZOLE (methimazole) oral tablet (PDF), su accessdata.fda.gov.
- ^ a b c d e f g h i j DPD Approved Drugs: Methimazole, su paladin-labs.com.
- ^ David S. Cooper e Peter Laurberg, Hyperthyroidism in pregnancy, in The Lancet. Diabetes & Endocrinology, vol. 1, n. 3, 2013-11, pp. 238–249, DOI:10.1016/S2213-8587(13)70086-X. URL consultato il 16 luglio 2023.
- ^ a b c d Shannon M. Clark, George R. Saade e Wayne R. Snodgrass, Pharmacokinetics and pharmacotherapy of thionamides in pregnancy, in Therapeutic Drug Monitoring, vol. 28, n. 4, 2006-08, pp. 477–483, DOI:10.1097/00007691-200608000-00001. URL consultato il 16 luglio 2023.
- ^ Murali K. Mallela, Marie Strobl e Ryan R. Poulsen, Evaluation of developmental toxicity of propylthiouracil and methimazole, in Birth Defects Research. Part B, Developmental and Reproductive Toxicology, vol. 101, n. 4, 2014-08, pp. 300–307, DOI:10.1002/bdrb.21113. URL consultato il 16 luglio 2023.
- ^ a b c d e f g h Y. Okamura, C. Shigemasa e T. Tatsuhara, Pharmacokinetics of methimazole in normal subjects and hyperthyroid patients, in Endocrinologia Japonica, vol. 33, n. 5, 1986-10, pp. 605–615, DOI:10.1507/endocrj1954.33.605. URL consultato il 16 luglio 2023.
- ^ a b Onyebuchi E. Okosieme e John H. Lazarus, Current trends in antithyroid drug treatment of Graves' disease, in Expert Opinion on Pharmacotherapy, vol. 17, n. 15, 2016-10, pp. 2005–2017, DOI:10.1080/14656566.2016.1232388. URL consultato il 16 luglio 2023.
- ^ a b c G. G. Skellern, B. I. Knight e C. K. Low, The pharmacokinetics of methimazole after oral administration of carbimazole and methimazole, in hyperthyroid patients, in British Journal of Clinical Pharmacology, vol. 9, n. 2, 1980-02, pp. 137–143, DOI:10.1111/j.1365-2125.1980.tb05823.x. URL consultato il 16 luglio 2023.
- ^ a b c d e f g h R. Jansson, B. Lindström e P. A. Dahlberg, Pharmacokinetic properties and bioavailability of methimazole, in Clinical Pharmacokinetics, vol. 10, n. 5, 1985, pp. 443–450, DOI:10.2165/00003088-198510050-00006. URL consultato il 16 luglio 2023.
- ^ a b Reza Heidari, Hossein Niknahad e Akram Jamshidzadeh, An overview on the proposed mechanisms of antithyroid drugs-induced liver injury, in Advanced Pharmaceutical Bulletin, vol. 5, n. 1, 2015-03, pp. 1–11, DOI:10.5681/apb.2015.001. URL consultato il 16 luglio 2023.
- ^ a b T. Mizutani, K. Yoshida e M. Murakami, Evidence for the involvement of N-methylthiourea, a ring cleavage metabolite, in the hepatotoxicity of methimazole in glutathione-depleted mice: structure-toxicity and metabolic studies, in Chemical Research in Toxicology, vol. 13, n. 3, 2000-03, pp. 170–176, DOI:10.1021/tx990155o. URL consultato il 16 luglio 2023.
- ^ a b D. S. Cooper, H. H. Bode e B. Nath, Methimazole pharmacology in man: studies using a newly developed radioimmunoassay for methimazole, in The Journal of Clinical Endocrinology and Metabolism, vol. 58, n. 3, 1984-03, pp. 473–479, DOI:10.1210/jcem-58-3-473. URL consultato il 16 luglio 2023.
- ^ CaymenChem: Methimazole MSDS (PDF), su caymanchem.com.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su metimazolo
Wikimedia Commons contiene immagini o altri file su metimazolo
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) methimazole, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.