Cloroprene
| Cloroprene | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| 2-cloro-1,3-butadiene | |
| Nomi alternativi | |
| cloroprene | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H5Cl |
| Massa molecolare (u) | 88.5365 g/mol |
| Aspetto | Liquido incolore |
| Numero CAS | |
| Numero EINECS | 204-818-0 |
| PubChem | 31369 |
| SMILES | C=CC(=C)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0.9598 g/cm3, liquido |
| Solubilità in acqua | 0.026 g/100 mL, liquido |
| Temperatura di fusione | −130 °C, 143 K, −202 °F |
| Temperatura di ebollizione | 59.4 °C, 333 K, 139 °F |
| Indicazioni di sicurezza | |
| Punto di fiamma | −15.6 °C, 257.6 K |
| Simboli di rischio chimico | |
   
| |
| pericolo | |
| Frasi H | 225 - 301 - 332 - 315 - 319 - 350 - 335 - 373 - 411 |
| Consigli P | 201 - 280 - 270 - 264 - 262 - 261 [1] |
Cloroprene è il nome comune del composto organico 2-cloro-1,3-butandiene, che ha formula chimica CH2=CCl-CH=CH2 e rientra pertanto nella classe degli alogenuri alchilici. Questo liquido incolore è il monomero per la produzione del polimero policloroprene, un tipo di gomma sintetica. Il policloroprene è più conosciuto al pubblico come Neoprene, il nome commerciale datogli dalla DuPont quando lo sviluppò per la prima volta utilizzandolo per i DuPont Performance Elastomers.
Produzione del cloroprene[modifica | modifica wikitesto]
Il cloroprene viene prodotto in tre passaggi dal 1,3-butadiene: (i) clorurazione, (ii) isomerizzazione di parte del prodotto, e (iii) deidroclorurazione del 3,4-dicloro-1-butene.
Il cloro si addiziona all'1,3-butadiene per fornire una miscela di 3,4-dicloro-1-butene e 2,3-dicloro-2-butene. L'isomero 2,3-cloro viene successivamente isomerizzato al 3,4-cloro e trattato con una base per indurre la deidroclorurazione a 2-cloro-1,3-butadiene. Questa deidroalogenazione comporta la perdita di un atomo di idrogeno in posizione 3 e di un atomo di cloro in posizione 4 formando quindi un doppio legame tra i carboni 3 e 4. Nel 1983 in questo modo sono stati prodotti circa 2 milioni di kg di cloroprene.[2] La principale impurezza nel cloroprene ottenuto per questa via è l'1-cloro-1,3-butadiene, che viene solitamente separato per distillazione.
Processo dell'acetilene[modifica | modifica wikitesto]
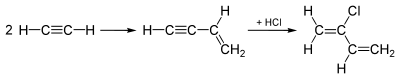
Fino agli anni Sessanta, la produzione del cloroprene era dominata dal "processo dell'acetilene", che era adattato dalla sintesi del vinilacetilene.[3] In questo processo l'acetilene viene dimerizzato a dare il vinil acetilene che viene successivamente combinato con cloruro d'idrogeno per fornire 3-cloro-1,2-butadiene, che finalmente, in presenza di cloruro rameoso, riarrangia al 2-cloro-1,3-butadiene.[2] La conversione è la seguente
Questo processo aveva degli svantaggi in quanto prevedeva molta energia ed alti costi. Inoltre, l'intermedio vinil acetilene è instabile.
Note[modifica | modifica wikitesto]
- ^ scheda del composto su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive. consultata il 03.08.2013
- ^ a b Manfred Rossberg, Wilhelm Lendle, Gerhard Pfleiderer, Adolf Tögel, Eberhard-Ludwig Dreher, Ernst Langer, Heinz Rassaerts, Peter Kleinschmidt, Heinz Strack, Richard Cook, Uwe Beck, Karl-August Lipper, Theodore R. Torkelson, Eckhard Löser, Klaus K. Beutel, “Chlorinated Hydrocarbons” in Ullmann's Encyclopedia of Industrial Chemistry, 2006 John Wiley-VCH: Weinheim.DOI: 10.1002/14356007.a06_233.pub2
- ^ Wallace Carothers, Ira Williams, Arnold M. Collins, and James E. Kirby, Acetylene Polymers and their Derivatives. II. A New Synthetic Rubber: Chloroprene and its Polymers, in J. Am. Chem. Soc., vol. 53, 1937, pp. 4203–4225, DOI:10.1021/ja01362a042.
Altri progetti[modifica | modifica wikitesto]
 Wikizionario contiene il lemma di dizionario «cloroprene»
Wikizionario contiene il lemma di dizionario «cloroprene» Wikimedia Commons contiene immagini o altri file sul cloroprene
Wikimedia Commons contiene immagini o altri file sul cloroprene
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) chloroprene / 2-chloro-1,3-butadiene, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Polychloroprene (CR), chloroprene rubber (PDF), su iisrp.com. URL consultato il 10 marzo 2009 (archiviato dall'url originale il 19 aprile 2009).
- IARC Monograph "Chloroprene."
| Controllo di autorità | LCCN (EN) sh94008140 · GND (DE) 4315356-2 · J9U (EN, HE) 987007558855605171 |
|---|