Numero di riproduzione di base: differenze tra le versioni
m Errori di Lint: Tag non chiusi |
Nessun oggetto della modifica |
||
| Riga 1: | Riga 1: | ||
{{WIP|Rodolfo Baraldini|pagina in costruzione}} |
|||
In [[epidemiologia]] il '''numero di riproduzione di base <ref name=":5" />''', indicato e conosciuto come '''R<sub>0</sub>''', indica il numero di nuovi casi generati in media da un singolo caso durante il proprio periodo infettivo in una popolazione che altrimenti non sarebbe infetta, ovvero esprime il numero atteso di nuove infezioni generate da un singolo individuo infetto nel corso del suo intero periodo di infettività, in una popolazione interamente suscettibile.<ref name=":5">{{Cita web|url=https://www.iss.it/primo-piano/-/asset_publisher/o4oGR9qmvUz9/content/id/5268851|titolo=Che cos’è R0 e perché è così importante - ISS|sito=www.iss.it|accesso=2020-03-30}}</ref> |
In [[epidemiologia]] il '''numero di riproduzione di base <ref name=":5" />''', indicato e conosciuto come '''R<sub>0</sub>''', indica il numero di nuovi casi generati in media da un singolo caso durante il proprio periodo infettivo in una popolazione che altrimenti non sarebbe infetta, ovvero esprime il numero atteso di nuove infezioni generate da un singolo individuo infetto nel corso del suo intero periodo di infettività, in una popolazione interamente suscettibile.<ref name=":5">{{Cita web|url=https://www.iss.it/primo-piano/-/asset_publisher/o4oGR9qmvUz9/content/id/5268851|titolo=Che cos’è R0 e perché è così importante - ISS|sito=www.iss.it|accesso=2020-03-30}}</ref> |
||
La definizione del parametro R<sub>0</sub> come metrica nella biologia o epidemiologia matematica non è universalmente condivisa. |
La definizione del parametro R<sub>0</sub> come metrica nella biologia o epidemiologia matematica non è universalmente condivisa. |
||
| Riga 23: | Riga 21: | ||
Il processo di definizione, calcolo, interpretazione e applicazione di ''R''<sub>0</sub> è tutt'altro che semplice. <ref name=":2">{{Cita pubblicazione|nome=Benjamin|cognome=Ridenhour|data=2014-02|titolo=Unraveling R0: Considerations for Public Health Applications|rivista=American Journal of Public Health|volume=104|numero=2|pp=e32–e41|accesso=2020-03-30|doi=10.2105/ajph.2013.301704|url=http://dx.doi.org/10.2105/ajph.2013.301704|nome2=Jessica M.|cognome2=Kowalik|nome3=David K.|cognome3=Shay}}</ref>Sono state proposte numerose definizioni simili ma non identiche. Dietz afferma che ''R''<sub>0</sub> è "il numero di casi secondari che un caso produrrebbe in una popolazione completamente suscettibile" .<ref name=":3">{{Cita pubblicazione|nome=K.|cognome=Dietz|data=1993-03|titolo=The estimation of the basic reproduction number for infectious diseases|rivista=Statistical Methods in Medical Research|volume=2|numero=1|pp=23–41|accesso=2020-03-30|doi=10.1177/096228029300200103|url=http://dx.doi.org/10.1177/096228029300200103}}</ref> Fine integra questa definizione con la descrizione "numero medio di casi secondari".<ref name=":0" /> Diekmann e colleghi usano la descrizione "numero previsto di casi secondari" e forniscono ulteriore specificità alla terminologia relativa a un singolo caso .<ref>{{Cita pubblicazione|nome=O.|cognome=Diekmann|data=1990|titolo=On the definition and the computation of the basic reproduction ratio R0 in models for infectious diseases in heterogeneous populations|rivista=Journal of Mathematical Biology|volume=28|numero=4|pp=365–382|accesso=2020-03-30|doi=10.1007/bf00178324|url=https://www.ncbi.nlm.nih.gov/pubmed/2117040|nome2=J. A.|cognome2=Heesterbeek|nome3=J. A.|cognome3=Metz}}</ref> Alcune definizioni, come quella del Dipartimento della Salute australiano , aggiungono l'assenza di "qualsiasi intervento deliberato nella trasmissione della malattia".<ref name=":1" /> Il numero di riproduzione di base non deve essere confuso con il [[numero di riproduzione effettiva]] ''R,'' che è il numero di casi generati nello stato attuale di una popolazione e che dipende dalla frazione (V) di popolazione non suscettibile, cioè immune all’infezione, essendo ''R''<sub>=</sub> ''R''<sub>0</sub>(1 – ''V''). Per definizione, ''R''<sub>0</sub> non può essere modificato attraverso campagne di vaccinazione come invece avviene per R. Inoltre è importante notare sia R che ''R''<sub>0</sub> sono numeri senza dimensioni e non tassi.<ref>{{Cita pubblicazione|nome=J.M|cognome=Heffernan|data=2005-09-22|titolo=Perspectives on the basic reproductive ratio|rivista=Journal of the Royal Society Interface|volume=2|numero=4|pp=281–293|accesso=2020-03-30|doi=10.1098/rsif.2005.0042|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1578275/|nome2=R.J|cognome2=Smith|nome3=L.M|cognome3=Wahl}}</ref><ref name=":1">{{Cita web|url=https://www1.health.gov.au/internet/publications/publishing.nsf/Content/mathematical-models~mathematical-models-models.htm~mathematical-models-2.2.htm|titolo=Department of Health {{!}} 2.2 The reproduction number|sito=www1.health.gov.au|accesso=2020-03-30}}</ref> |
Il processo di definizione, calcolo, interpretazione e applicazione di ''R''<sub>0</sub> è tutt'altro che semplice. <ref name=":2">{{Cita pubblicazione|nome=Benjamin|cognome=Ridenhour|data=2014-02|titolo=Unraveling R0: Considerations for Public Health Applications|rivista=American Journal of Public Health|volume=104|numero=2|pp=e32–e41|accesso=2020-03-30|doi=10.2105/ajph.2013.301704|url=http://dx.doi.org/10.2105/ajph.2013.301704|nome2=Jessica M.|cognome2=Kowalik|nome3=David K.|cognome3=Shay}}</ref>Sono state proposte numerose definizioni simili ma non identiche. Dietz afferma che ''R''<sub>0</sub> è "il numero di casi secondari che un caso produrrebbe in una popolazione completamente suscettibile" .<ref name=":3">{{Cita pubblicazione|nome=K.|cognome=Dietz|data=1993-03|titolo=The estimation of the basic reproduction number for infectious diseases|rivista=Statistical Methods in Medical Research|volume=2|numero=1|pp=23–41|accesso=2020-03-30|doi=10.1177/096228029300200103|url=http://dx.doi.org/10.1177/096228029300200103}}</ref> Fine integra questa definizione con la descrizione "numero medio di casi secondari".<ref name=":0" /> Diekmann e colleghi usano la descrizione "numero previsto di casi secondari" e forniscono ulteriore specificità alla terminologia relativa a un singolo caso .<ref>{{Cita pubblicazione|nome=O.|cognome=Diekmann|data=1990|titolo=On the definition and the computation of the basic reproduction ratio R0 in models for infectious diseases in heterogeneous populations|rivista=Journal of Mathematical Biology|volume=28|numero=4|pp=365–382|accesso=2020-03-30|doi=10.1007/bf00178324|url=https://www.ncbi.nlm.nih.gov/pubmed/2117040|nome2=J. A.|cognome2=Heesterbeek|nome3=J. A.|cognome3=Metz}}</ref> Alcune definizioni, come quella del Dipartimento della Salute australiano , aggiungono l'assenza di "qualsiasi intervento deliberato nella trasmissione della malattia".<ref name=":1" /> Il numero di riproduzione di base non deve essere confuso con il [[numero di riproduzione effettiva]] ''R,'' che è il numero di casi generati nello stato attuale di una popolazione e che dipende dalla frazione (V) di popolazione non suscettibile, cioè immune all’infezione, essendo ''R''<sub>=</sub> ''R''<sub>0</sub>(1 – ''V''). Per definizione, ''R''<sub>0</sub> non può essere modificato attraverso campagne di vaccinazione come invece avviene per R. Inoltre è importante notare sia R che ''R''<sub>0</sub> sono numeri senza dimensioni e non tassi.<ref>{{Cita pubblicazione|nome=J.M|cognome=Heffernan|data=2005-09-22|titolo=Perspectives on the basic reproductive ratio|rivista=Journal of the Royal Society Interface|volume=2|numero=4|pp=281–293|accesso=2020-03-30|doi=10.1098/rsif.2005.0042|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1578275/|nome2=R.J|cognome2=Smith|nome3=L.M|cognome3=Wahl}}</ref><ref name=":1">{{Cita web|url=https://www1.health.gov.au/internet/publications/publishing.nsf/Content/mathematical-models~mathematical-models-models.htm~mathematical-models-2.2.htm|titolo=Department of Health {{!}} 2.2 The reproduction number|sito=www1.health.gov.au|accesso=2020-03-30}}</ref> |
||
<br /> |
<br /> |
||
== Variabilità e incertezze del ''R''<sub>0</sub> == |
== Variabilità e incertezze del ''R''<sub>0</sub> == |
||
{| class="wikitable" style="width: 25%; float:right; margin-left:10px; margin-right:10px;" |
{| class="wikitable" style="width: 25%; float:right; margin-left:10px; margin-right:10px;" |
||
|+ |
|+Stime di ''R''<sub>0</sub> |
||
!Malattia |
!Malattia |
||
!Trasmissione |
!Trasmissione |
||
!R <sub>0</sub> |
!R <sub>0</sub> |
||
|- |
|- |
||
|[[Sindrome respiratoria mediorientale da Coronavirus|MERS]] |
|||
|MERS |
|||
|Aerotrasportato |
|Aerotrasportato |
||
|0,3-0,8<ref>{{Cita web|url=https://apps.who.int/iris/bitstream/handle/10665/326126/WHO-MERS-RA-19.1-eng.pdf?ua=1|titolo=WHO MERS Global Summary and Assessment of |
|||
|0,3-0,8 |
|||
Risk}}</ref> |
|||
|- |
|- |
||
|Influenza |
|[[Influenza]] |
||
<small>(ceppi stagionali)</small> |
<small>(ceppi stagionali)</small> |
||
|Aerotrasportato |
|Aerotrasportato |
||
|0,9–2,1<ref>{{Cita pubblicazione|nome=Matthew|cognome=Biggerstaff|data=2014-12|titolo=Estimates of the reproduction number for seasonal, pandemic, and zoonotic influenza: a systematic review of the literature|rivista=BMC Infectious Diseases|volume=14|numero=1|pp=480|lingua=en|accesso=2020-04-01|doi=10.1186/1471-2334-14-480|url=https://bmcinfectdis.biomedcentral.com/articles/10.1186/1471-2334-14-480|nome2=Simon|cognome2=Cauchemez|nome3=Carrie|cognome3=Reed}}</ref> |
|||
|0,9–2,1 |
|||
|- |
|- |
||
|Influenza |
|Influenza |
||
<small>( H1N1 del 2009 )</small> |
<small>( [[Pandemia influenzale del 2009|H1N1 del 2009]] )</small> |
||
|Aerotrasportato |
|Aerotrasportato |
||
|1,4–1,6<ref>{{Cita pubblicazione|nome=Brian J.|cognome=Coburn|data=2009-06-22|titolo=Modeling influenza epidemics and pandemics: insights into the future of swine flu (H1N1)|rivista=BMC medicine|volume=7|pp=30|accesso=2020-04-01|doi=10.1186/1741-7015-7-30|url=https://www.ncbi.nlm.nih.gov/pubmed/19545404|nome2=Bradley G.|cognome2=Wagner|nome3=Sally|cognome3=Blower}}</ref> |
|||
|1,4–1,6 |
|||
|- |
|- |
||
|Influenza |
|Influenza |
||
<small>( H1N1 del 1918 )</small> |
<small>( [[Influenza spagnola|H1N1 del 1918]] )</small> |
||
|Aerotrasportato |
|Aerotrasportato |
||
|1,4–2,8<ref>{{Cita pubblicazione|nome=Neil M.|cognome=Ferguson|data=2006-07-27|titolo=Strategies for mitigating an influenza pandemic|rivista=Nature|volume=442|numero=7101|pp=448–452|accesso=2020-04-01|doi=10.1038/nature04795|url=https://www.ncbi.nlm.nih.gov/pubmed/16642006|nome2=Derek A. T.|cognome2=Cummings|nome3=Christophe|cognome3=Fraser}}</ref> |
|||
|1,4–2,8 |
|||
|- |
|- |
||
|Influenza |
|||
|Ebola |
|||
<small>( [[Influenza di Hong Kong|H3N2 del 1968]] )</small> |
|||
|Aerotrasportato |
|||
|1,1–3,6<ref>{{Cita pubblicazione|nome=Charlotte|cognome=Jackson|data=2010-02-15|titolo=Estimates of the Transmissibility of the 1968 (Hong Kong) Influenza Pandemic: Evidence of Increased Transmissibility Between Successive Waves|rivista=American Journal of Epidemiology|volume=171|numero=4|pp=465–478|accesso=2020-04-01|doi=10.1093/aje/kwp394|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2816729/|nome2=Emilia|cognome2=Vynnycky|nome3=Punam|cognome3=Mangtani}}</ref> |
|||
| ⚫ | |||
|[[Malattia da virus Ebola|Ebola]] |
|||
<small>( epidemia del 2014 )</small> |
<small>( epidemia del 2014 )</small> |
||
|Fluidi corporei |
|Fluidi corporei |
||
|1,5–2,5<ref>{{Cita pubblicazione|nome=N.|cognome=Kobayashi|data=1967-02|titolo=[Small lymphocyte as immunocyte--with special reference to its blastogenesis due to antigenic stimulation]|rivista=Arerugi = [Allergy]|volume=16|numero=2|pp=79–88|accesso=2020-04-01|url=https://www.ncbi.nlm.nih.gov/pubmed/4169395|nome2=H.|cognome2=Hayakawa}}</ref> |
|||
|1,5–2,5 |
|||
|- |
|- |
||
|Difterite |
|[[Difterite]] |
||
|Saliva |
|Saliva |
||
|1,7–4,3<ref>{{Cita pubblicazione|nome=Shaun A|cognome=Truelove|data=2019-08-19|titolo=Clinical and Epidemiological Aspects of Diphtheria: A Systematic Review and Pooled Analysis|rivista=Clinical Infectious Diseases|pp=ciz808|lingua=en|accesso=2020-04-01|doi=10.1093/cid/ciz808|url=https://academic.oup.com/cid/advance-article/doi/10.1093/cid/ciz808/5551532|nome2=Lindsay T|cognome2=Keegan|nome3=William J|cognome3=Moss}}</ref> |
|||
|1,7–4,3 |
|||
|- |
|- |
||
|HIV / AIDS |
|[[AIDS|HIV / AIDS]] |
||
|Fluidi corporei |
|Fluidi corporei |
||
|1,09-2,15<ref>{{Cita pubblicazione|nome=T. Déirdre|cognome=Hollingsworth|data=2008-09-01|titolo=HIV-1 Transmission, by Stage of Infection|rivista=The Journal of Infectious Diseases|volume=198|numero=5|pp=687–693|lingua=en|accesso=2020-04-01|doi=10.1086/590501|url=https://academic.oup.com/jid/article/198/5/687/865839|nome2=Roy M.|cognome2=Anderson|nome3=Christophe|cognome3=Fraser}}</ref> |
|||
| ⚫ | |||
|- |
|- |
||
|[[Epidemia di SARS del 2002-2004|SARS]] |
|||
|SARS |
|||
|Aerotrasportato |
|Aerotrasportato |
||
|2–5<ref>{{Cita pubblicazione|nome=Jacco|cognome=Wallinga|data=2004-09-15|titolo=Different epidemic curves for severe acute respiratory syndrome reveal similar impacts of control measures|rivista=American Journal of Epidemiology|volume=160|numero=6|pp=509–516|accesso=2020-04-01|doi=10.1093/aje/kwh255|url=https://www.ncbi.nlm.nih.gov/pubmed/15353409|nome2=Peter|cognome2=Teunis}}</ref> |
|||
|2–5 |
|||
|- |
|- |
||
|Vaiolo |
|[[Vaiolo]] |
||
|Aerotrasportato |
|Aerotrasportato |
||
|3,5–6<ref>{{Cita pubblicazione|nome=Raymond|cognome=Gani|data=2001-12|titolo=Transmission potential of smallpox in contemporary populations|rivista=Nature|volume=414|numero=6865|pp=748–751|lingua=en|accesso=2020-04-01|doi=10.1038/414748a|url=http://www.nature.com/articles/414748a|nome2=Steve|cognome2=Leach}}</ref> |
|||
|3,5–6 |
|||
|- |
|- |
||
|Parotite |
|[[Parotite]] |
||
|Aerotrasportato |
|Aerotrasportato |
||
|10-12<ref>{{Cita web|url=https://www1.health.gov.au/internet/main/publishing.nsf/Content/cda-phlncd-mumps.htm|titolo=Australia- Department of health - Mumps Laboratory Case Definition}}</ref> |
|||
|4-7 |
|||
|- |
|- |
||
|Rosolia |
|[[Rosolia]] |
||
|Aerotrasportato |
|Aerotrasportato |
||
|4,3-9,2<ref>{{Cita pubblicazione|nome=M. N.|cognome=Kanaan|data=2005-06-02|titolo=Matrix models for childhood infections: a Bayesian approach with applications to rubella and mumps|rivista=Epidemiology and Infection|volume=133|numero=06|pp=1009|lingua=en|accesso=2020-04-01|doi=10.1017/S0950268805004528|url=http://www.journals.cambridge.org/abstract_S0950268805004528|nome2=C. P.|cognome2=Farrington}}</ref> |
|||
|5-7 |
|||
|- |
|- |
||
|Pertosse |
|[[Pertosse]] |
||
|Aerotrasportato |
|Aerotrasportato |
||
|5,5<ref>{{Cita pubblicazione|nome=Mirjam|cognome=Kretzschmar|data=2010-06-22|titolo=Incidence and Reproduction Numbers of Pertussis: Estimates from Serological and Social Contact Data in Five European Countries|rivista=PLoS Medicine|volume=7|numero=6|accesso=2020-04-01|doi=10.1371/journal.pmed.1000291|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2889930/|nome2=Peter F. M.|cognome2=Teunis|nome3=Richard G.|cognome3=Pebody}}</ref> |
|||
|5.5 |
|||
|- |
|- |
||
|Varicella |
|[[Varicella]] |
||
|Aerotrasportato |
|Aerotrasportato |
||
|3,7-5<ref>{{Cita pubblicazione|nome=Luigi|cognome=Marangi|data=2017-05-18|titolo=The natural history of varicella zoster virus infection in Norway: Further insights on exogenous boosting and progressive immunity to herpes zoster|rivista=PLOS ONE|volume=12|numero=5|pp=e0176845|lingua=en|accesso=2020-04-01|doi=10.1371/journal.pone.0176845|url=https://dx.plos.org/10.1371/journal.pone.0176845|nome2=Grazina|cognome2=Mirinaviciute|nome3=Elmira|cognome3=Flem}}</ref> |
|||
|10-12 |
|||
|- |
|- |
||
|Morbillo |
|[[Morbillo]] |
||
|Aerotrasportato |
|Aerotrasportato |
||
|12-18<ref>{{Cita pubblicazione|nome=Fiona M|cognome=Guerra|data=2017-12|titolo=The basic reproduction number (R 0 ) of measles: a systematic review|rivista=The Lancet Infectious Diseases|volume=17|numero=12|pp=e420–e428|lingua=en|accesso=2020-04-01|doi=10.1016/S1473-3099(17)30307-9|url=https://linkinghub.elsevier.com/retrieve/pii/S1473309917303079|nome2=Shelly|cognome2=Bolotin|nome3=Gillian|cognome3=Lim}}</ref> |
|||
|12-18 |
|||
|- |
|- |
||
|colspan=3 |<small>Nota: con aerotrasportato si intende tipicamente la trasmissione con le goccioline respiratorie</small> |
|colspan=3 |<small>Nota: con aerotrasportato si intende tipicamente la trasmissione con le goccioline respiratorie</small> |
||
|} |
|} |
||
Per ogni agente infettivo, la letteratura scientifica potrebbe riportare numerosi valori R<sub>0</sub> diversi . |
Per ogni agente infettivo, la letteratura scientifica potrebbe riportare numerosi valori R<sub>0</sub> diversi .<ref>{{Cita web|url=http://ocw.jhsph.edu/courses/PublicHealthBiology/PDFs/Lecture2.pdf|titolo=The Johns Hopkins University and Gregory E. Glass - Measuring Disease Dynamics in Populations: |
||
Characterizing the Likelihood of Control}}</ref> |
|||
R<sub>0</sub> si basa necessariamente su semplificazioni e dipende da moltissimi fattori, in parte imprevedibili (es: congiunzione con un terremoto, un evento meteorologico, socioeconomico, una crisi umanitaria o una guerra). |
R<sub>0</sub> si basa necessariamente su semplificazioni e dipende da moltissimi fattori, in parte imprevedibili (es: congiunzione con un terremoto, un evento meteorologico, socioeconomico, una crisi umanitaria o una guerra). |
||
| Riga 134: | Riga 140: | ||
I modelli possono adattarsi a malattie infettive nella fase epidemica o endemica, a sistema aperto ( considerando nascite e morti ) o chiuso. I modelli più semplici permettono di ricavare R<sub>0</sub> da una serie di equazioni differenziali mentre nei modelli più complessi si deve ricorrere al calcolo matriciale. I modelli, deterministici (che producono gli stessi risultati ogni volta che vengono eseguiti) o stocastici (che generano una distribuzione di risultati probabili sulla base delle variazioni degli input) danno, R<sub>0</sub> diversi.<ref name=":4" /> |
I modelli possono adattarsi a malattie infettive nella fase epidemica o endemica, a sistema aperto ( considerando nascite e morti ) o chiuso. I modelli più semplici permettono di ricavare R<sub>0</sub> da una serie di equazioni differenziali mentre nei modelli più complessi si deve ricorrere al calcolo matriciale. I modelli, deterministici (che producono gli stessi risultati ogni volta che vengono eseguiti) o stocastici (che generano una distribuzione di risultati probabili sulla base delle variazioni degli input) danno, R<sub>0</sub> diversi.<ref name=":4" /> |
||
<br /> |
|||
== Note == |
== Note == |
||
<references /> |
<references /> |
||
Versione delle 11:53, 1 apr 2020
In epidemiologia il numero di riproduzione di base [1], indicato e conosciuto come R0, indica il numero di nuovi casi generati in media da un singolo caso durante il proprio periodo infettivo in una popolazione che altrimenti non sarebbe infetta, ovvero esprime il numero atteso di nuove infezioni generate da un singolo individuo infetto nel corso del suo intero periodo di infettività, in una popolazione interamente suscettibile.[1] La definizione del parametro R0 come metrica nella biologia o epidemiologia matematica non è universalmente condivisa.
Viene chiamato anche: tasso netto di riproduzione, utilizzando il termine originario derivato dagli studi demografici, oppure numero di riproduzione netto o in certi casi tasso di riproduzione virale. Vari studi interpretano l'uso del termine "tasso" improprio in quanto suggerisce una metrica di una quantità in una unità di tempo. Se R 0 fosse un tasso che coinvolge il tempo fornirebbe informazioni sulla velocità con cui un'epidemia si diffonderà attraverso una popolazione. Ma R0 non indica se si verificheranno nuovi casi entro 24 ore dal caso iniziale o mesi dopo, proprio come R0 non indica se la malattia prodotta dall'infezione è grave. L'incoerenza nel nome e nella definizione del parametro R0 è stata potenzialmente una causa di incomprensione del suo significato.[2][3]
Questo parametro indica la potenziale trasmissibilità di una malattia infettiva. Gli usi più importanti e comuni di R0 sono determinare se una malattia infettiva emergente può diffondersi in una popolazione, determinare quale percentuale della popolazione dovrebbe essere immunizzata attraverso la vaccinazione per sradicare una malattia, prevedere quale potrebbe essere il numero di contagiati in una epidemia o la durata della fase espansiva (il periodo tra l'inizio e il picco) dell'epidemia. Nei modelli di infezione comunemente usati se R0 < 1 l'infezione sul lungo termine si estinguerà, mentre se R0 > 1 l'infezione potrà diffondersi nella popolazione.
Generalmente, più è alto il valore di R0, più difficile è controllare l'epidemia. In un modello semplificato e con un vaccino efficace al 100%, la quota di popolazione che deve essere immune, per precedenti infezioni risolte o per vaccinazione ( copertura vaccinale) per prevenire la diffusione dell'infezione è data da 1 - 1/R0. Più alto è R0 più alta è la percentuale di popolazione immune per raggiungere l'immunità di gregge.[4] Al contrario, la proporzione della popolazione che rimane suscettibile alle infezioni nella condizione di equilibrio endemico è 1/R0 . Il numero di riproduzione di base è influenzato da vari fattori, tra i quali la durata del periodi di infettività, la suscettibilità dell'organismo e il numero di individui suscettibili, all'interno della popolazione, coi quali i pazienti infetti entrano in contatto. Sebbene R0 rappresenti una realtà biologica, questo valore è generalmente stimato con complessi modelli matematici sviluppati utilizzando varie ipotesi.[5] L'interpretazione delle stime di R0 derivate da diversi modelli richiede una comprensione delle strutture, degli input e delle interazioni dei modelli. In popolazioni non omogenee il calcolo del R0 e della dinamica di una epidemia è molto complesso.
Storia
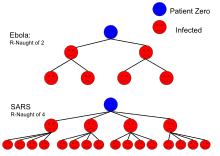
Le radici del concetto di riproduzione di base possono essere rintracciate attraverso il lavoro di Ronald Ross , Alfred Lotka e altri [6], ma la sua prima applicazione moderna in epidemiologia fu di George MacDonald nel 1952, che costruì modelli della diffusione della malaria considerando le ondate successive di infezione come generazioni successive nello sviluppo demografico di una popolazione.[7][8] La storia del concetto e calcolo del R0 nel suo passaggio tra le diverse discipline, dalla demografia e ecologia, all'epidemologia, infettivologia e statistica medica non evidenzia una chiara convergenza ed oggi sia i modelli di calcolo sia le definizioni possono differire anche notevolmente.[9]
Definizione
Il processo di definizione, calcolo, interpretazione e applicazione di R0 è tutt'altro che semplice. [10]Sono state proposte numerose definizioni simili ma non identiche. Dietz afferma che R0 è "il numero di casi secondari che un caso produrrebbe in una popolazione completamente suscettibile" .[11] Fine integra questa definizione con la descrizione "numero medio di casi secondari".[4] Diekmann e colleghi usano la descrizione "numero previsto di casi secondari" e forniscono ulteriore specificità alla terminologia relativa a un singolo caso .[12] Alcune definizioni, come quella del Dipartimento della Salute australiano , aggiungono l'assenza di "qualsiasi intervento deliberato nella trasmissione della malattia".[13] Il numero di riproduzione di base non deve essere confuso con il numero di riproduzione effettiva R, che è il numero di casi generati nello stato attuale di una popolazione e che dipende dalla frazione (V) di popolazione non suscettibile, cioè immune all’infezione, essendo R= R0(1 – V). Per definizione, R0 non può essere modificato attraverso campagne di vaccinazione come invece avviene per R. Inoltre è importante notare sia R che R0 sono numeri senza dimensioni e non tassi.[14][13]
Variabilità e incertezze del R0
| Malattia | Trasmissione | R 0 |
|---|---|---|
| MERS | Aerotrasportato | 0,3-0,8[15] |
| Influenza
(ceppi stagionali) |
Aerotrasportato | 0,9–2,1[16] |
| Influenza
( H1N1 del 2009 ) |
Aerotrasportato | 1,4–1,6[17] |
| Influenza
( H1N1 del 1918 ) |
Aerotrasportato | 1,4–2,8[18] |
| Influenza
( H3N2 del 1968 ) |
Aerotrasportato | 1,1–3,6[19] |
| Ebola
( epidemia del 2014 ) |
Fluidi corporei | 1,5–2,5[20] |
| Difterite | Saliva | 1,7–4,3[21] |
| HIV / AIDS | Fluidi corporei | 1,09-2,15[22] |
| SARS | Aerotrasportato | 2–5[23] |
| Vaiolo | Aerotrasportato | 3,5–6[24] |
| Parotite | Aerotrasportato | 10-12[25] |
| Rosolia | Aerotrasportato | 4,3-9,2[26] |
| Pertosse | Aerotrasportato | 5,5[27] |
| Varicella | Aerotrasportato | 3,7-5[28] |
| Morbillo | Aerotrasportato | 12-18[29] |
| Nota: con aerotrasportato si intende tipicamente la trasmissione con le goccioline respiratorie | ||
Per ogni agente infettivo, la letteratura scientifica potrebbe riportare numerosi valori R0 diversi .[30]
R0 si basa necessariamente su semplificazioni e dipende da moltissimi fattori, in parte imprevedibili (es: congiunzione con un terremoto, un evento meteorologico, socioeconomico, una crisi umanitaria o una guerra).
La scelta dei modelli (e dei parametri inseriti) influenza i risultati che possono differire sensibilmente in studi diversi.
Tale discrepanza è normale e può avere 3 motivi [31] :
- Le variabili considerate differiscono;
- I metodi di modellazione differiscono;
- Le procedure di stima differiscono.
Le stime del valore di R0 sono spesso calcolate in funzione di 3 parametri primari:
- la durata della contagiosità dopo l'infezione di una persona,
- la probabilità di infezione per contatto tra una persona sensibile e una persona infettiva o un vettore
- il tasso di contatto,
insieme con parametri accessori che possono essere aggiunti per descrivere cicli di trasmissione più complessi.[11] Provvedimenti sociali e di sanità pubblica influenzano le dinamiche di trasmissione e, quindi , sono rilevanti per la stima dei valori di R0 .[10]Tuttavia, anche se l'infettività di un patogeno (cioè la probabilità di infezione che si verifica dopo che si è verificato un contatto efficace) e la durata della contagiosità sono costanti biologiche, R0 varierà se le interazioni sociali variano nel tempo o nello spazio. Qualsiasi fattore che potrebbe influenzare il tasso di contatto, compresa la densità di popolazione (ad es. Rurale vs. urbano), l'organizzazione sociale (ad es. Integrata vs. segregata) e la stagionalità (ad es. Stagione umida vs. piovosa per infezioni trasmesse da vettori), alla fine influenza l'R0. Poiché R0 è una funzione dell'effettivo tasso di contatto, il valore di R0 è una funzione del comportamento e dell'organizzazione sociale umana, nonché delle caratteristiche biologiche innate degli agenti patogeni. La stima del R0 presuppone che il numero di infezioni secondarie prodotte da un singolo caso non vari. In realtà alcuni agenti patogeni, come i virus, possono mutare e diventare più o meno contagiosi e/o pericolosi. Ci sono poi soggetti che sono superinfettori ed eventi di super-propagazione, in cui un singolo soggetto, magari asintomatico, può infettare un grande numero di persone. La variabilità nelle stime del valore di R0 per malattie infettive può essere molto ampia. Più di 20 diversi valori di R0 (da 5,4 a 18) sono stati riportati per il morbillo.[32] Sempre in merito al morbillo, una revisione del 2017, ha identificato stime di R0 fatte su dati rilevati localmente che vanno da 3,7 a 203,3.[33] Nessun modello può prendere in considerazione tutta l'eterogeneità spazio-temporale di un contesto eco-epidemiologico, o anche il grado di trasmissibilità o vulnerabilità alle infezioni. Inoltre, nel mondo reale, il numero riproduttivo di base viene costantemente modificato durante l'epidemia, in particolare dalle misure di contenimento di controllo adottate o imposte proprio per ridurlo.
Modelli per il calcolo del R0 di una epidemia
Contare il numero di casi di infezione durante un'epidemia può essere estremamente difficile, anche quando i funzionari della sanità pubblica usano la sorveglianza attiva e la ricerca dei contatti per tentare di localizzare tutte le persone infette. Sebbene sia possibile misurare il tasso d'attacco ed il tasso d'attacco secondario riferiti ad uno specifico periodo temporale, il valore di R0 è quasi sempre stimato dai dati seroepidemiologici o utilizzando modelli matematici teorici.
Sono quasi cento anni che si usano modelli matematici per descrivere la dinamica delle epidemie. Infatti i modelli attualmente usati in gran parte originano dal modello proposto da Kermack e McKendrick nel 1927.[34] I modelli matematici più utilizzati necessitano di classificare la popolazione in compartimenti:
- , suscettibili
- , infetti / infettivi
- , esposti, quando ad esempio la malattia richiede due settimane per rendere l'individuo infettivo
- , deceduti
- , recuperati, guariti dopo aver contratto la malattia.
- , rimossi, soggetti non infettabili perchè immuni o isolati.
- , soggetti con immunità o infettività dalla nascita, materna
- , soggetti portatori (carrier) asintomatici
Per completare i modelli matematici si devono stimare alcuni parametri:età di infezione, cioè da quanto tempo è passato dal contagio, infettività, frequenza di contatto, periodo di incubazione, periodo infettivo, intervallo seriale, cioè il tempo fra la comparsa dei sintomi in un infetto e la comparsa dei sintomi in un individuo infettato dal primo, ed altri parametri ricavati sul campo. Si deve anche definire la legge secondo cui si infettano i suscettibili. I modelli più semplici utilizzano la legge di azione di massa (sistema omogeneo) dove si assume che ogni individuo abbia la stessa probabilità di contattare qualunque altro individuo nella popolazione, indipendentemente dai contatti passati. [35][36][37] La maggioranza dei modelli matematici viene denotata da un acronimo che rappresenta il flusso dell'epidemia tra i diversi compartimenti di popolazione.
- SI :
- SIS :
- SIR :
- SEIR :
- MSIR :
- MSEIR :
I modelli possono adattarsi a malattie infettive nella fase epidemica o endemica, a sistema aperto ( considerando nascite e morti ) o chiuso. I modelli più semplici permettono di ricavare R0 da una serie di equazioni differenziali mentre nei modelli più complessi si deve ricorrere al calcolo matriciale. I modelli, deterministici (che producono gli stessi risultati ogni volta che vengono eseguiti) o stocastici (che generano una distribuzione di risultati probabili sulla base delle variazioni degli input) danno, R0 diversi.[35]
Note
- ^ a b Che cos’è R0 e perché è così importante - ISS, su www.iss.it. URL consultato il 30 marzo 2020.
- ^ (EN) Paul L. Delamater, Erica J. Street e Timothy F. Leslie, Complexity of the Basic Reproduction Number (R0) - Volume 25, Number 1—January 2019 - Emerging Infectious Diseases journal - CDC, DOI:10.3201/eid2501.171901. URL consultato il 30 marzo 2020.
- ^ Notes On R0 James Holland Jones ∗ Department of Anthropological Sciences Stanford University May 1, 2007 (PDF), su web.stanford.edu.
- ^ a b Paul E. M. Fine, Herd Immunity: History, Theory, Practice, in Epidemiologic Reviews, vol. 15, n. 2, 1993, pp. 265–302, DOI:10.1093/oxfordjournals.epirev.a036121. URL consultato il 30 marzo 2020.
- ^ Andrew W Roddam, Mathematical Epidemiology of Infectious Diseases: Model Building, Analysis and Interpretation, in International Journal of Epidemiology, vol. 30, n. 1, 2001-02, pp. 186–186, DOI:10.1093/ije/30.1.186. URL consultato il 30 marzo 2020.
- ^ Popolazioni malthusiane - II (modello di Lotka-Von Foerster), su dei.unipd.it.
- ^ G. Macdonald, Malaria in Britain, in BMJ, vol. 2, n. 4775, 12 luglio 1952, pp. 92–92, DOI:10.1136/bmj.2.4775.92-a. URL consultato il 30 marzo 2020.
- ^ G. Covell, EPIDEMIOLOGY AND CONTROL OF MALARIA, in BMJ, vol. 2, n. 5059, 21 dicembre 1957, pp. 1477–1477, DOI:10.1136/bmj.2.5059.1477. URL consultato il 30 marzo 2020.
- ^ J.A.P. Heesterbeek, A brief history of R0 and a recipe for its calculation, in Acta Biotheoretica, vol. 50, n. 3, 2002, pp. 189–204, DOI:10.1023/A:1016599411804. URL consultato il 30 marzo 2020.
- ^ a b Benjamin Ridenhour, Jessica M. Kowalik e David K. Shay, Unraveling R0: Considerations for Public Health Applications, in American Journal of Public Health, vol. 104, n. 2, 2014-02, pp. e32–e41, DOI:10.2105/ajph.2013.301704. URL consultato il 30 marzo 2020.
- ^ a b K. Dietz, The estimation of the basic reproduction number for infectious diseases, in Statistical Methods in Medical Research, vol. 2, n. 1, 1993-03, pp. 23–41, DOI:10.1177/096228029300200103. URL consultato il 30 marzo 2020.
- ^ O. Diekmann, J. A. Heesterbeek e J. A. Metz, On the definition and the computation of the basic reproduction ratio R0 in models for infectious diseases in heterogeneous populations, in Journal of Mathematical Biology, vol. 28, n. 4, 1990, pp. 365–382, DOI:10.1007/bf00178324. URL consultato il 30 marzo 2020.
- ^ a b Department of Health | 2.2 The reproduction number, su www1.health.gov.au. URL consultato il 30 marzo 2020.
- ^ J.M Heffernan, R.J Smith e L.M Wahl, Perspectives on the basic reproductive ratio, in Journal of the Royal Society Interface, vol. 2, n. 4, 22 settembre 2005, pp. 281–293, DOI:10.1098/rsif.2005.0042. URL consultato il 30 marzo 2020.
- ^ WHO MERS Global Summary and Assessment of Risk, su apps.who.int.
- ^ (EN) Matthew Biggerstaff, Simon Cauchemez e Carrie Reed, Estimates of the reproduction number for seasonal, pandemic, and zoonotic influenza: a systematic review of the literature, in BMC Infectious Diseases, vol. 14, n. 1, 2014-12, pp. 480, DOI:10.1186/1471-2334-14-480. URL consultato il 1º aprile 2020.
- ^ Brian J. Coburn, Bradley G. Wagner e Sally Blower, Modeling influenza epidemics and pandemics: insights into the future of swine flu (H1N1), in BMC medicine, vol. 7, 22 giugno 2009, pp. 30, DOI:10.1186/1741-7015-7-30. URL consultato il 1º aprile 2020.
- ^ Neil M. Ferguson, Derek A. T. Cummings e Christophe Fraser, Strategies for mitigating an influenza pandemic, in Nature, vol. 442, n. 7101, 27 luglio 2006, pp. 448–452, DOI:10.1038/nature04795. URL consultato il 1º aprile 2020.
- ^ Charlotte Jackson, Emilia Vynnycky e Punam Mangtani, Estimates of the Transmissibility of the 1968 (Hong Kong) Influenza Pandemic: Evidence of Increased Transmissibility Between Successive Waves, in American Journal of Epidemiology, vol. 171, n. 4, 15 febbraio 2010, pp. 465–478, DOI:10.1093/aje/kwp394. URL consultato il 1º aprile 2020.
- ^ N. Kobayashi e H. Hayakawa, [Small lymphocyte as immunocyte--with special reference to its blastogenesis due to antigenic stimulation], in Arerugi = [Allergy], vol. 16, n. 2, 1967-02, pp. 79–88. URL consultato il 1º aprile 2020.
- ^ (EN) Shaun A Truelove, Lindsay T Keegan e William J Moss, Clinical and Epidemiological Aspects of Diphtheria: A Systematic Review and Pooled Analysis, in Clinical Infectious Diseases, 19 agosto 2019, pp. ciz808, DOI:10.1093/cid/ciz808. URL consultato il 1º aprile 2020.
- ^ (EN) T. Déirdre Hollingsworth, Roy M. Anderson e Christophe Fraser, HIV-1 Transmission, by Stage of Infection, in The Journal of Infectious Diseases, vol. 198, n. 5, 1º settembre 2008, pp. 687–693, DOI:10.1086/590501. URL consultato il 1º aprile 2020.
- ^ Jacco Wallinga e Peter Teunis, Different epidemic curves for severe acute respiratory syndrome reveal similar impacts of control measures, in American Journal of Epidemiology, vol. 160, n. 6, 15 settembre 2004, pp. 509–516, DOI:10.1093/aje/kwh255. URL consultato il 1º aprile 2020.
- ^ (EN) Raymond Gani e Steve Leach, Transmission potential of smallpox in contemporary populations, in Nature, vol. 414, n. 6865, 2001-12, pp. 748–751, DOI:10.1038/414748a. URL consultato il 1º aprile 2020.
- ^ Australia- Department of health - Mumps Laboratory Case Definition, su www1.health.gov.au.
- ^ (EN) M. N. Kanaan e C. P. Farrington, Matrix models for childhood infections: a Bayesian approach with applications to rubella and mumps, in Epidemiology and Infection, vol. 133, n. 06, 2 giugno 2005, pp. 1009, DOI:10.1017/S0950268805004528. URL consultato il 1º aprile 2020.
- ^ Mirjam Kretzschmar, Peter F. M. Teunis e Richard G. Pebody, Incidence and Reproduction Numbers of Pertussis: Estimates from Serological and Social Contact Data in Five European Countries, in PLoS Medicine, vol. 7, n. 6, 22 giugno 2010, DOI:10.1371/journal.pmed.1000291. URL consultato il 1º aprile 2020.
- ^ (EN) Luigi Marangi, Grazina Mirinaviciute e Elmira Flem, The natural history of varicella zoster virus infection in Norway: Further insights on exogenous boosting and progressive immunity to herpes zoster, in PLOS ONE, vol. 12, n. 5, 18 maggio 2017, pp. e0176845, DOI:10.1371/journal.pone.0176845. URL consultato il 1º aprile 2020.
- ^ (EN) Fiona M Guerra, Shelly Bolotin e Gillian Lim, The basic reproduction number (R 0 ) of measles: a systematic review, in The Lancet Infectious Diseases, vol. 17, n. 12, 2017-12, pp. e420–e428, DOI:10.1016/S1473-3099(17)30307-9. URL consultato il 1º aprile 2020.
- ^ The Johns Hopkins University and Gregory E. Glass - Measuring Disease Dynamics in Populations: Characterizing the Likelihood of Control (PDF), su ocw.jhsph.edu.
- ^ Chris T. Bauch, James O. Lloyd-Smith e Megan P. Coffee, Dynamically Modeling SARS and Other Newly Emerging Respiratory Illnesses: Past, Present, and Future, in Epidemiology, vol. 16, n. 6, 2005, pp. 791–801. URL consultato il 30 marzo 2020.
- ^ Roy M. Anderson, The Population Dynamics of Infectious Diseases: Theory and Applications, Springer US, 1982, pp. 1–37, ISBN 978-0-412-21610-7. URL consultato il 30 marzo 2020.
- ^ Fiona M Guerra, Shelly Bolotin e Gillian Lim, The basic reproduction number (R 0 ) of measles: a systematic review, in The Lancet Infectious Diseases, vol. 17, n. 12, 2017-12, pp. e420–e428, DOI:10.1016/s1473-3099(17)30307-9. URL consultato il 30 marzo 2020.
- ^ (EN) A contribution to the mathematical theory of epidemics, in Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character, vol. 115, n. 772, 1927-08, pp. 700–721, DOI:10.1098/rspa.1927.0118. URL consultato il 31 marzo 2020.
- ^ a b Mollison, Denis., Epidemic models : their structure and relation to data, New York, NY, 1995, ISBN 0-521-47536-8, OCLC 32347982. URL consultato il 31 marzo 2020.
- ^ Brauer, Fred., Van den Driessche, Pauline, 1941- e Wu, Jianhong, 1964-, Mathematical epidemiology, Springer, 2008, ISBN 978-3-540-78910-9, OCLC 225958569. URL consultato il 31 marzo 2020.
- ^ Ma, Stefan., Xia, Yingcun. e National University of Singapore. Institute for Mathematical Sciences., Mathematical understanding of infectious disease dynamics, World Scientific, 2009, ISBN 978-981-283-483-6, OCLC 608624741. URL consultato il 31 marzo 2020.












