Titanato di stronzio
| Titanato di stronzio | |
|---|---|
 | |
| Nomi alternativi | |
| Ossido di stronzio e titanio, fabulite | |
| Caratteristiche generali | |
| Formula bruta o molecolare | SrTiO3 |
| Aspetto | cristalli bianchi opachi |
| Numero CAS | |
| Numero EINECS | 235-044-1 |
| PubChem | 82899 |
| SMILES | [Sr++].[O-][Ti]([O-])=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 5,11 |
| Indice di rifrazione | 2,394 |
| Solubilità in acqua | insolubile |
| Temperatura di fusione | 2080 °C |
| Indicazioni di sicurezza | |
Il titanato di stronzio è un ossido di stronzio e titanio con la formula chimica SrTiO3. A temperatura ambiente è un materiale paraelettrico centrosimmetrico con struttura tipo perovskite. A basse temperature si avvicina a una transizione di fase ferroelettrica con una costante dielettrica molto grande ~104 ma rimane paraelettrico fino alle temperature più basse misurate come risultato delle fluttuazioni quantistiche, rendendolo un paraelettrico quantistico[1]. Per molto tempo si è pensato che fosse un materiale completamente artificiale, fino al 1982 quando la sua controparte naturale, scoperta in Siberia e denominata tausonite, è stata riconosciuta dall'Associazione Mineralogica Internazionale. La tausonite rimane un minerale estremamente raro in natura, che si presenta come cristalli molto piccoli. La sua applicazione più importante è stata nella sua forma sintetizzata in cui si incontra occasionalmente come simil-diamante, nell'ottica di precisione, nei varistori e nella ceramica avanzata.
Il nome tausonite è stato dato in onore di Lev Vladimirovich Tauson (1917–1989), un geochimico russo. I nomi commerciali in disuso per il prodotto sintetico includono mesotitanato di stronzio, Diagem e Marvelite. Questo prodotto è anche commercializzato per il suo uso in gioielleria con il nome Fabulite[2]. Oltre alla sua località tipo nel massiccio del Murun nella Repubblica di Sakha, la tausonite naturale si trova anche a Cerro Sarambi, nel dipartimento di Concepción in Paraguay e lungo il fiume Kotaki di Honshū, in Giappone[3][4].
Proprietà[modifica | modifica wikitesto]

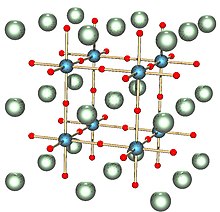
Il titanato di stronzio ha una bandgap indiretto di 3,25 eV e un gap diretto di 3,75 eV[5] nella gamma tipica dei semiconduttori. Il titanato di stronzio sintetico ha una costante dielettrica molto grande (300) a temperatura ambiente e un campo elettrico basso. Ha una resistività specifica di oltre 109 Ωcm per cristalli molto puri[6]. Viene anche utilizzato nei condensatori ad alta tensione. L'introduzione di portatori di carica mobili mediante drogaggio porta a un comportamento metallico Fermi-liquido già a densità di portatori di carica molto basse[7]. Ad alte densità di elettroni il titanato di stronzio diventa superconduttore al di sotto di 0,35 K ed è stato il primo isolante e ossido scoperto ad avere tale caratteristica[8].
Il titanato di stronzio è sia molto più denso (gravità specifica 4,88 per il composto naturale, 5,13 per quello sintetico) sia molto più morbido (durezza Mohs 5,5 per il composto sintetico, 6–6,5 per quello naturale) del diamante. Il suo sistema cristallino è cubico e il suo indice di rifrazione (2,410, misurato dalla luce del sodio a lunghezza d'onda di 589,3 nm) è quasi identico a quello del diamante (a 2,417), ma la dispersione (la proprietà ottica responsabile del "fuoco" delle pietre tagliate) del titanato di stronzio è 4,3 volte quello del diamante, a 0,190 (intervallo B–G). Ciò si traduce in un'elevata dispersione rispetto a diamanti e simulanti di diamanti come il granato di ittrio e alluminio (YAG), granato di gadolinio e alluminio (GAG), granato di gadolinio e gallio (GGG), zirconia cubica e moissanite[3][4].
I sintetici sono generalmente trasparenti e incolori, ma possono essere drogati con alcune terre rare o metalli di transizione per dare colorazioni rosse, gialle, marroni e blu. La tausonite naturale è solitamente di aspetto che va dal traslucido all'opaco, nei toni del marrone rossastro, rosso scuro o grigio. Entrambi hanno una lucentezza adamantina (simile a un diamante). Il titanato di stronzio è considerato estremamente fragile con una frattura concoidale; il materiale naturale ha un abito cristallino cubico o ottaedrico e striature marroni. Attraverso uno spettroscopio portatile (visione diretta), i sintetici drogati mostreranno un ricco spettro di assorbimento tipico delle pietre drogate. Il materiale sintetico ha un punto di fusione di circa 2080 °C ed è prontamente attaccato dall'acido fluoridrico[3][4]. A una pressione parziale di ossigeno estremamente bassa, il titanato di stronzio si decompone per sublimazione incongruente dello stronzio ben al di sotto della temperatura di fusione[9].
A temperature inferiori a 105 K, la sua struttura cubica si trasforma in tetragonale[10]. I suoi monocristalli possono essere utilizzati come finestre ottiche e bersagli di deposizione per sputtering di alta qualità.

Il titanato di stronzio è un eccellente substrato per la crescita epitassiale di superconduttori ad alta temperatura e molti film sottili a base di ossido. È particolarmente noto come substrato per la crescita dell'interfaccia alluminato di lantanio-titanato di stronzio. Il drogaggio del titanato di stronzio con il niobio lo rende elettricamente conduttivo, essendo uno dei pochi substrati di cristallo singolo conduttivi disponibili in commercio per la crescita di ossidi di perovskite. Il suo parametro di reticolo di massa di 3,905 Å lo rende adatto come substrato per la crescita di molti altri ossidi, tra cui le manganiti delle terre rare, i titanati, l'alluminato di lantanio (LaAlO3), il rutenato di stronzio (Sr2RuO4) e molti altri. Le vacanze di ossigeno sono abbastanza comuni nei cristalli di titanato di stronzio e nei film sottili. Le vacanze di ossigeno inducono elettroni liberi nella banda di conduzione del materiale, rendendolo più conduttivo e opaco. Questi posti vacanti possono essere causati dall'esposizione a condizioni riducenti, come il vuoto spinto a temperature elevate.
Strati di titanato di stronzio epitassiali di alta qualità possono anche essere coltivati su silicio senza formare diossido di silicio, rendendo così il titanato di stronzio un materiale dielettrico alternativo. Ciò consente anche l'integrazione di altri ossidi di perovskite a film sottile sul silicio[11].
Il titanato di stronzio ha dimostrato di possedere una fotoconduttività persistente in cui l'esposizione del cristallo alla luce aumenterà la sua conduttività elettrica di oltre 2 ordini di grandezza. Dopo lo spegnimento della luce, la maggiore conduttività persiste per diversi giorni, con un decadimento trascurabile[12][13].
A causa della sua significativa conduzione ionica ed elettronica, il titanato di stronzio può essere utilizzato come conduttore misto[14].
Sintesi[modifica | modifica wikitesto]

Il titanato di stronzio sintetico era uno dei numerosi titanati brevettati tra la fine degli anni Quaranta e l'inizio degli anni Cinquanta; altri titanati includevano il titanato di bario e il titanato di calcio. La ricerca è stata condotta principalmente presso la National Lead Company (in seguito ribattezzata NL Industries) negli Stati Uniti, che brevettò per la prima volta il processo di crescita nel 1953[senza fonte]; una serie di perfezionamenti furono successivamente brevettati nei quattro anni successivi, come modifiche alla polvere di mangime e aggiunte di coloranti droganti.
Una modifica al metodo di Verneuil (noto anche come fusione a fiamma) è il metodo di crescita preferito. Viene utilizzato un cannello a soffiatura ossidrico invertito, con polvere di alimentazione miscelata con ossigeno accuratamente alimentata attraverso il cannello nel modo tipico, ma con l'aggiunta di un terzo tubo per fornire ossigeno, creando un bruciatore triconico. L'ossigeno extra è necessario per la formazione di titanato di stronzio, che altrimenti non si ossida completamente a causa del componente titanio. Il rapporto è di circa 1,5 volumi di idrogeno per ogni volume di ossigeno. La polvere di mangime altamente purificata si ottiene producendo dapprima il sale di doppio ossalato di titanile (SrTiO(C2O4)2 · 2 H2O) facendo reagire cloruro di stronzio (SrCl2) e acido ossalico ((COOH)2 · 2 H2O) con tetracloruro di titanio (TiCl4). Il sale viene lavato per eliminare completamente il cloruro, riscaldato a 1000 °C per produrre una polvere granulare a flusso libero della composizione richiesta, quindi viene macinato e setacciato per garantire che tutte le particelle abbiano una dimensione compresa tra 0,2 e 0,5 micrometri[15].
La polvere di alimentazione cade attraverso la fiamma ossidrica, si scioglie e atterra su un piedistallo sottostante posto in rotazione. L'altezza del piedistallo viene costantemente regolata per mantenere la sua sommità nella posizione ottimale al di sotto della fiamma, e per un certo numero di ore la polvere fusa si raffredda e cristallizza per formare un unico cristallo a forma di boccia. Questa boccia di solito non è più grande di 2,5 centimetri di diametro e lunga 10 centimetri; all'inizio è di colore nero opaco, che richiede un'ulteriore ricottura in un'atmosfera ossidante per rendere il cristallo incolore e alleviare la tensione. Questa operazione viene eseguita a oltre 1000 °C per 12 ore[15].
Film sottili di titanato di stronzio possono essere cresciuti epitassialmente con vari metodi, tra cui deposizione laser pulsata, epitassia da fasci molecolari, sputtering RF e deposizione di strati atomici. Come nella maggior parte dei film sottili, metodi di crescita diversi possono comportare densità di difetti e impurità e qualità cristallina significativamente diverse, con conseguente grande variazione delle proprietà elettroniche e ottiche.
Utilizzo come simulante di diamante[modifica | modifica wikitesto]
La sua struttura cubica e l'elevata dispersione un tempo rendevano il titanato di stronzio sintetico un ottimo candidato per creare simulanti del diamante. A metà degli anni '50, grandi quantità di titanato di stronzio furono prodotte per questo unico scopo. Il titanato di stronzio all'epoca era in competizione con il rutilo sintetico (titania) e aveva il vantaggio di mancare della sfortunata sfumatura gialla e della forte birifrangenza inerente a quest'ultimo materiale. Sebbene fosse più morbido, era significativamente più vicino al diamante per aspetto. Alla fine, però, entrambi cadrebbero in disuso, venendo eclissati dalla creazione di simulanti "migliori": prima dal granato ittrio e alluminio (YAG) e seguito poco dopo dal granato gadolinio gallio (GGG); e infine dal simulante (finora) ultimo in termini di somiglianza con il diamante e rapporto costo-efficacia, la zirconia cubica[16].
Nonostante sia fuori moda, il titanato di stronzio è ancora prodotto e periodicamente incontrato in gioielleria. È uno dei simulanti di diamanti più costosi e, a causa della sua rarità, i collezionisti arrivano a pagare prezzi alti per esemplari di grandi dimensioni (>2 carati (400 mg). Come simulante del diamante, il titanato di stronzio è più ingannevole se mescolato con pietre miste, cioè <0,20 carati (40 mg) e quando viene utilizzato come materiale di base per una pietra composita o doppietta (con, ad esempio, corindone sintetico come corona o sommità della pietra). Al microscopio, i gemmologi distinguono il titanato di stronzio dal diamante per la morbidezza del primo, manifestata da abrasioni superficiali, e l'eccessiva dispersione (per l'occhio allenato) e bolle di gas occasionali che sono resti di sintesi. I doppietti possono essere rilevati da una linea di giunzione alla cintura ("vita" della pietra) e bolle d'aria appiattite o colla visibili all'interno della pietra nel punto di incollaggio[17][18][19].
Uso nei generatori termoelettrici di radioisotopi[modifica | modifica wikitesto]
A causa del suo alto punto di fusione e insolubilità in acqua, il titanato di stronzio è stato utilizzato come materiale contenente stronzio-90 nei generatori termoelettrici di radioisotopi, come la serie US Sentinel e Beta-M sovietica[20][21].
Uso in celle a combustibile a ossido solido[modifica | modifica wikitesto]
La conduttività mista del titanato di stronzio ha attirato l'attenzione per l'uso nelle celle a combustibile a ossido solido (SOFC). Dimostra conduttività sia elettronica che ionica che è utile per gli elettrodi SOFC perché c'è uno scambio di gas e ioni ossigeno nel materiale ed elettroni su entrambi i lati della cella:
- (anodo)
- (catodo)
Il titanato di stronzio è drogato con materiali diversi per l'uso su lati differenti di una cella a combustibile. Sul lato del carburante (anodo), dove si verifica la prima reazione, viene spesso drogato con lantanio per formare titanato di stronzio drogato con lantanio (LST). In questo caso il sito A, o posizione nella cella unitaria in cui di solito si trova lo stronzio, a volte è riempito da lantanio: questo fa sì che il materiale mostri proprietà di semiconduttore di tipo n, inclusa la conduttività elettronica. Mostra anche la conduzione degli ioni di ossigeno a causa della tolleranza della struttura della perovskite per le vacanze di ossigeno. Questo materiale ha un coefficiente di espansione termica simile a quello della comune zirconia stabilizzata con ossido di ittrio elettrolita (YSZ), possiede stabilità chimica durante le reazioni che si verificano agli elettrodi delle celle a combustibile, e infine conducibilità elettronica fino a 360 S/cm in condizioni operative SOFC[22]. Un altro vantaggio chiave di questi LST è che mostrano resistenza all'avvelenamento da zolfo, che è un problema con gli anodi in nichel-ceramica (cermet) utilizzati[23].
Un altro composto correlato è la ferrite di titanio e stronzio (STF) che viene utilizzata come materiale catodico (lato ossigeno) nelle SOFC. Questo materiale mostra anche una conduttività ionica ed elettronica mista, il che è importante in quanto significa che la reazione di riduzione che avviene al catodo può avvenire su un'area più ampia[24]. Basandosi su questo materiale aggiungendo cobalto sul sito B (in sostituzione del titanio) e ferro, si ottiene il materiale STFC, o STF sostituito con cobalto, che mostra una notevole stabilità come materiale catodico e una resistenza alla polarizzazione inferiore rispetto ad altri comuni materiali catodici, come ferrite di cobalto-lantanio-stronzio. Questi catodi hanno anche il vantaggio di non contenere metalli delle terre rare che li rendono più economici di molte delle alternative[25].
Note[modifica | modifica wikitesto]
- ^ (EN) K. A. Muller e H. Burkard, SrTiO3: An intrinsic quantum paraelectric below 4 K, in Phys. Rev. B, vol. 19, n. 7, 1979, pp. 3593–3602, DOI:10.1103/PhysRevB.19.3593.
- ^ Annibale Mottana, Una brillante sintesi, in Scienza e Dossier, vol. 1, n. 1, Giunti, marzo 1986, p. 9.
- ^ a b c (EN) Tausonite, su webmineral.com, Webmineral. URL consultato il 6 giugno 2009.
- ^ a b c (EN) Tausonite, su mindat.org, Mindat. URL consultato il 6 giugno 2009.
- ^ (EN) K. van Benthem, C. Elsässer e R. H. French, Bulk electronic structure of SrTiO3: Experiment and theory, in Journal of Applied Physics, vol. 90, n. 12, 2001, p. 6156, DOI:10.1063/1.1415766.
- ^ (EN) Strontium Titanate, in ESPI Metals, ESPICorp (archiviato dall'url originale il 24 settembre 2015).
- ^ (EN) Xiao Lin, Benoît Fauqué e Kamran Behnia, Scalable T2 resistivity in a small single-component Fermi surface, in Science, vol. 349, n. 6251, 2015, pp. 945–948, DOI:10.1126/science.aaa8655, PMID 26315430.
- ^ (EN) C.S. Koonce e Marvin L. Cohen, Superconducting Transition Temperatures of Semiconducting SrTiO3, in Phys. Rev., vol. 163, n. 2, 1967, p. 380, DOI:10.1103/PhysRev.163.380.
- ^ (EN) C. Rodenbücher, P. Meuffels, W. Speier, M. Ermrich, D. Wrana, F. Krok e K. Szot, Stability and Decomposition of Perovskite-Type Titanates upon High-Temperature Reduction, in Phys. Status Solidi RRL, vol. 11, n. 9, 2017, p. 1700222, DOI:10.1002/pssr.201700222.
- ^ (EN) L. Rimai e G. A. deMars, Electron Paramagnetic Resonance of Trivalent Gadolinium Ions in Strontium and Barium Titanates, in Phys. Rev., vol. 127, n. 3, 1962, p. 702, DOI:10.1103/PhysRev.127.702.
- ^ (EN) R. A. McKee, F. J. Walker e M. F. Chisholm, Crystalline Oxides on Silicon: The First Five Monolayers, in Phys. Rev. Lett., vol. 81, n. 14, 1998, p. 3014, DOI:10.1103/PhysRevLett.81.3014.
- ^ (EN) Persistent Photoconductivity in Strontium Titanate, su prl.aps.org, Department of Physics and Astronomy, Washington State University. URL consultato il 18 novembre 2013.
- ^ (EN) Light Exposure Increases Crystal's Electrical Conductivity 400-fold [VIDEO], su natureworldnews.com, Nature World News. URL consultato il 18 novembre 2013.
- ^ (EN) Mixed conductors, su fkf.mpg.de, Max Planck institute for solid state research. URL consultato il 16 settembre 2016.
- ^ a b (EN) H. J. Scheel e P. Capper, Crystal growth technology: from fundamentals and simulation to large-scale production, Wiley-VCH, 2008, p. 431, ISBN 978-35-27-31762-2.
- ^ (EN) R.W. Hesse, Jewelrymaking through history: an encyclopedia, Greenwood Publishing Group, 2007, p. 73, ISBN 978-03-13-33507-5.
- ^ (EN) Nassau, K., Gems made by man, Santa Monica, California, Gemological Institute of America, 1980, pp. 214–221, ISBN 0-87311-016-1.
- ^ (EN) O'Donoghue, M., Synthetic, imitation & treated gemstones, Elsevier Butterworth-Heinemann, 2002, pp. 34, 65, ISBN 0-7506-3173-2.
- ^ (EN) Read, P.G., Gemmology, second edition, Butterworth-Heinemann, 1999, pp. 173, 176, 177, 293, ISBN 0-7506-4411-7.
- ^ (EN) Power Sources for Remote Arctic Applications (PDF), su govinfo.library.unt.edu, Washington, DC, U.S. Congress, Office of Technology Assessment, giugno 1994.
- ^ (EN) W.J.F. Standring, Ø.G. Selnæs, M. Sneve, I.E. Finne, A. Hosseini, I. Amundsen e P. Strand, Assessment of environmental, health and safety consequences of decommissioning radioisotope thermal generators (RTGs) in Northwest Russia (PDF), StrålevernRapport 2005:4, Østerås, Norwegian Radiation Protection Authority, 2005. URL consultato il 18 marzo 2022 (archiviato dall'url originale il 3 marzo 2016).
- ^ (EN) O. Marina, Thermal, electrical, and electrocatalytical properties of lanthanum-doped strontium titanate, in Solid State Ionics, vol. 149, 1–2, 2002, pp. 21–28, DOI:10.1016/S0167-2738(02)00140-6.
- ^ (EN) Mingyang Gong, Xingbo Liu, Jason Trembly e Christopher Johnson, Sulfur-tolerant anode materials for solid oxide fuel cell application, in Journal of Power Sources, vol. 168, n. 2, 2007, pp. 289–298, DOI:10.1016/j.jpowsour.2007.03.026.
- ^ (EN) WooChul Jung e Harry L. Tuller, Impedance study of SrTi1−xFexO3−δ (x=0.05 to 0.80) mixed ionic-electronic conducting model cathode, in Solid State Ionics, vol. 180, 11–13, 2009, pp. 843–847, DOI:10.1016/j.ssi.2009.02.008.
- ^ (EN) Shan-Lin Zhang, Hongqian Wang, Matthew Y. Lu, Ai-Ping Zhang, Liliana V. Mogni, Qinyuan Liu, Cheng-Xin Li, Chang-Jiu Li e Scott A. Barnett, Cobalt-substituted SrTi0.3Fe0.7O3−δ : a stable high-performance oxygen electrode material for intermediate-temperature solid oxide electrochemical cells, in Energy & Environmental Science, vol. 11, n. 7, 2018, pp. 1870–1879, DOI:10.1039/C8EE00449H.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Titanato di stronzio
Wikimedia Commons contiene immagini o altri file su Titanato di stronzio
| Controllo di autorità | GND (DE) 4183773-3 |
|---|

