Utente:Grasso Luigi/sanbox1/ione disolfito
| Ione disolfito | |
|---|---|
 | |
| Nome IUPAC | |
| Disolfito [1] | |
| Nomi alternativi | |
pentaoxido-1κ3O,2κ2O-disulfate(S—S)(2−)
| |
| Caratteristiche generali | |
| Formula bruta o molecolare | S2O2−5 |
| Massa molecolare (u) | 144.115 |
| Numero CAS | Immagine_3D_disolfito |
| PubChem | 159940 |
| SMILES | [O-]S(=O)S(=O)(=O)[O-] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| attenzione | |
| Frasi H | --- |
| Consigli P | --- |
Un disolfito, conosciuto comunemente come metabisolfito o pirosolfito, è un composto chimico dianione detto pure ione disolfito (ione metabisolfito) di formula chimica S2O2−5.
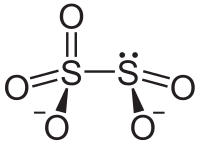
Struttura[modifica | modifica wikitesto]
Sorprendentemente, e in contrasto con lo ione disolfato (S2O2−7), lo ione disolfito (S2O2−5) ha due atomi di zolfo connessi in maniera diretta, e la struttura viene detta "tionito-tionato", o [O2S–SO3]2−, al posto della forma simmetrica [O2S–O–SO2]2−.[2]
Il numero di ossidazione dell'atomo di zolfo legato ai 3 atomi di ossigeno è +5 (+V) mentre quello dell'altro atomo di zolfo è +3 (+III). L'anione consiste di un gruppo SO2 collegato ad un gruppo SO3, con la carica negativa maggiormente localizzata sul termine SO3. La lunghezza del legame S–S è 2.22 Å, e le distanze S-O nel "tionato" e nel "tionito" sono 1.46 e 1.50 Å rispettivamente.[3]
Reazioni[modifica | modifica wikitesto]
Produzione[modifica | modifica wikitesto]
Lo ione disolfito è un dimero dello ione bisolfito (HSO−3). Può formarsi da una
In aqueous solution, the disulfite ion is formed in minor amounts by dehydration of bisulfite in an equilibrium:
Although the equilibrium lies far to the left, evaporation of a bisulfite salt will produce a substantial amount of disulfite. [4]
In fact, disulfite is the ion of disulfurous acid (pyrosulfurous acid), which originates from sulfurous acid in accordance with the
dehydration reaction above:
- 2 H2SO3 → 2 HSO−3 + 2 H+ → H2S2O5 + H2O
The disulfite ion also arises from the addition of sulfur dioxide to the sulfite ion:
| HSO−3 SO32− + SO2 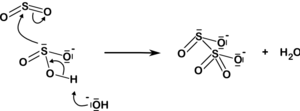 |
Altre reazioni[modifica | modifica wikitesto]
In aqueous solution, disulfite salts decompose with acids:
- S2O2−5 + H+ → HSO−3 + SO2
Composti derivati[modifica | modifica wikitesto]
- Sodium metabisulfite (E223) and potassium metabisulfite (E224) are used as a preservative and antioxidant in food.
Note[modifica | modifica wikitesto]
- ^ Nomenclature of Inorganic Chemistry : IUPAC Recommendations 2005 (Red Book), Cambridge, The Royal Society of Chemistry, 2005, p. 315, ISBN 978-0-85404-438-2.
- ^ I. Lindqvist and M. Mörtsell; "The structure of potassium pyrosulfite and the nature of the pyrosulfite ion". Acta Crystallogr. (1957). 10, 406–409. DOI: 10.1107/S0365110X57001322
- ^ K. L. Carter, T. A. Siddiquee, K. L. Murphy, D. W. Bennett "The surprisingly elusive crystal structure of sodium metabisulfite" Acta Crystallogr. (2004). B60, 155–162. DOI: 10.1107/S0108768104003325
- ^ Bassam Z. Shakhashiri: Chemical demonstrations: a handbook for teachers of chemistry The University of Wisconsin Press, 1992, p.9
Altri progetti[modifica | modifica wikitesto]



